R.EcoRII - R.EcoRII
Restrikční endonukleáza (REASE) EcoRII (vyslovuje se „eco R two“) je enzym z systém modifikace omezení (RM) přirozeně se vyskytující v Escherichia coli, a Gramnegativní bakterie. Své molekulová hmotnost je 45,2 kDa, se skládá z 402 aminokyseliny.[1]
Režim akce
EcoRII je bakteriální Typ IIE[2] REASE který interaguje se dvěma[3] nebo tři[4] kopie pseudopalindromu DNA sekvence rozpoznávání 5' -CC ŽGG -3' (Š = A nebo T ), z nichž jeden je skutečným terčem štěpení, druhý slouží jako alosterický aktivátor (s). EcoRII snižuje cíl DNA sekvence CCWGG, generování lepivé konce.[5]
Vyjmout diagram
| Místo pro rozpoznávání | Výsledky řezu |
5 's. ŠCCWGGNN3 'NNGGWCCNN | 5 's. Š CCWGGNN3 'NNGGWCC NN |
Struktura
| Restrikční endonukleáza EcoRII, N-terminál | |||||||||
|---|---|---|---|---|---|---|---|---|---|
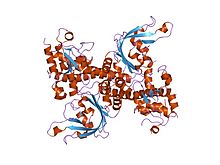 krystalová struktura restrikční endonukleázy ecorii mutant r88a | |||||||||
| Identifikátory | |||||||||
| Symbol | EcoRII-N | ||||||||
| Pfam | PF09217 | ||||||||
| Pfam klan | CL0405 | ||||||||
| InterPro | IPR015300 | ||||||||
| SCOP2 | 1na6 / Rozsah / SUPFAM | ||||||||
| |||||||||
| Terminál EcoRII C. | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 krystalová struktura restrikční endonukleázy ecorii mutant r88a | |||||||||
| Identifikátory | |||||||||
| Symbol | EcoRII-C | ||||||||
| Pfam | PF09019 | ||||||||
| Pfam klan | CL0236 | ||||||||
| InterPro | IPR015109 | ||||||||
| |||||||||
The apo krystal struktura EcoRII mutant R88A (PDB: 1NA6)[6] byl vyřešen 2.1 A rozlišení. EcoRII monomer má dva domén, N-terminál a C-terminál, propojené prostřednictvím a závěs smyčka.
Efektorová vazebná doména
N-terminál efektor -vazebná doména má archetypální záhyb DNA vázající pseudobarrel (SCOP 101936 ) s prominentní rozštěp. Strukturální superpozice ukázal, že to evolučně souvisí s:
- B3 DNA vazebná doména (SCOP 117343 ) z transkripční faktory v vyšší rostliny (PDB: 1WID)[7]
- C-terminální doména restrikční endonukleáza BfiI[8] (PDB: 2C1L)[9]
Katalytická doména
C-terminál katalytická doména má typický[10] restrikční záhyb podobný endonukleáze (SCOP 52979 ) a patří mezi velké (více než 30 členů) restrikční endonukleáza nadčeleď (SCOP 52980 ).
Mechanismus automatické inhibice / aktivace
Sekvence založená na struktuře zarovnání a místně zaměřená mutageneze identifikoval domnělou PD..D / EXK aktivní stránky dimeru katalytické domény EcoRII, které jsou v apo struktuře prostorově blokovány N-koncovými doménami.[6]
Viz také
- EcoRI, další nukleázový enzym z Escherichia coli.
- EcoRV, další nukleázový enzym z Escherichia coli.
- B3 DNA vazebná doména z vyšší rostliny je evoluční v souvislosti s EcoRII
- FokI, další nukleázový enzym z Flavobacterium okeanokoites
externí odkazy
- EcoRII v databázi restrikčních enzymů REBASE
Reference
- ^ Richard J. Roberts. „EcoRII“. REBASE - Databáze restrikčních enzymů. Citováno 2008-03-23.
- ^ Roberts RJ, Belfort M, Bestor T a kol. (2003). „Názvosloví pro restrikční enzymy, DNA methyltransferázy, naváděcí endonukleázy a jejich geny“. Nucleic Acids Res. 31 (7): 1805–12. doi:10.1093 / nar / gkg274. PMC 152790. PMID 12654995. PDF
- ^ Mücke M, Lurz R, Mackeldanz P, Behlke J, Krüger DH, Reuter M (2000). "Zobrazovací smyčky DNA indukované restrikční endonukleázou EcoRII. Jedna aminokyselinová substituce odpojí rozpoznávání cíle od kooperativní DNA interakce a štěpení". J. Biol. Chem. 275 (39): 30631–7. doi:10,1074 / jbc.M003904200. PMID 10903314.PDF
- ^ Shlyakhtenko LS, Gilmore J, Portillo A, Tamulaitis G, Siksnys V, Lyubchenko YL (2007). „Přímá vizualizace trojitého synaptického komplexu EcoRII-DNA mikroskopem atomové síly“. Biochemie. 46 (39): 11128–36. doi:10.1021 / bi701123u. PMID 17845057. S2CID 27800123.
- ^ Griffiths, Anthony J. F. (1999). Úvod do genetické analýzy. San Francisco: W.H. Freemane. ISBN 978-0-7167-3520-5.
- ^ A b Zhou XE, Wang Y, Reuter M, Mücke M, Krüger DH, Meehan EJ, Chen L (2004). „Krystalová struktura restrikční endonukleázy typu IIE EcoRII odhaluje autoinhibiční mechanismus pomocí nové vazby efektoru“. J. Mol. Biol. 335 (1): 307–19. doi:10.1016 / j.jmb.2003.10.030. PMID 14659759.
- ^ Yamasaki K, Kigawa T, Inoue M, Tateno M, Yamasaki T, Yabuki T, Aoki M, Seki E, Matsuda T, Tomo Y, Hayami N, Terada T, Shirouzu M, Osanai T, Tanaka A, Seki M, Shinozaki K , Yokoyama S (2004). „Struktura řešení vazebné domény B3 DNA transkripčního faktoru RAV1 reagujícího na chlad za studena Arabidopsis“. Rostlinná buňka. 16 (12): 3448–59. doi:10.1105 / tpc.104.026112. PMC 535885. PMID 15548737.PDF
- ^ Richard J. Roberts. "BfiI". REBASE - Databáze restrikčních enzymů. Citováno 2008-03-23.
- ^ Grazulis S, Manakova E, Roessle M, Bochtler M, Tamulaitiene G, Huber R, Siksnys V (2005). „Struktura restrikčního enzymu BfiI nezávislého na kovu odhaluje fúzi specifické domény vázající DNA s nespecifickou nukleázou“ (PDF). Proc. Natl. Acad. Sci. USA. 102 (44): 15797–802. Bibcode:2005PNAS..10215797G. doi:10.1073 / pnas.0507949102. PMC 1266039. PMID 16247004. PDF
- ^ Niv MY, Ripoll DR, Vila JA, Liwo A, Vanamee ES, Aggarwal AK, Weinstein H, Scheraga HA (2007). „Topologie revizí typu II znovu navštívena; strukturální třídy a společné konzervované jádro“. Výzkum nukleových kyselin. 35 (7): 2227–37. doi:10.1093 / nar / gkm045. PMC 1874628. PMID 17369272.

