Dimangan dekakarbonyl - Dimanganese decacarbonyl
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC bis (pentakarbonylmangan)) (Mn—Mn) | |
| Ostatní jména Mangan karbonyl Decacarbonyldimanganese | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.030.392 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Mn2(CO)10 | |
| Molární hmotnost | 389,98 g / mol |
| Vzhled | Žluté krystaly |
| Hustota | 1,750 g / cm3 |
| Bod tání | 154 ° C (309 ° F; 427 K) |
| Bod varu | sublimuje 60 ° C (140 ° F; 333 K) při 0,5 mm Hg |
| Nerozpustný | |
| Struktura[1] | |
| monoklinický | |
A = 14,68 Å, b = 14,16 Å, C = 7,16 Å a = 90 °, β = 75 °, γ = 90 ° | |
Jednotky vzorce (Z) | 4 |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | Zdroj CO |
| R-věty (zastaralý) | 23/24/25 |
| S-věty (zastaralý) | 22-26-36/37/39-45 |
| Související sloučeniny | |
Související sloučeniny | Re2(CO)10 Spol2(CO)8 Fe3(CO)12 Fe2(CO)9 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dimangan dekakarbonyl je chemická sloučenina s vzorec Mn2(CO)10. Tento kovový karbonyl je důležité činidlo v organokovová chemie z mangan.[2]
Syntéza
Sloučenina byla nejprve připravena v nízkém výtěžku redukcí jodidu manganatého s hořčík pod CO.[1] Účinnější příprava zahrnuje redukci bezvodého MnCl2 sodíkem benzofenon ketyl pod 200 atmosfér CO.[3] Dostupnost levné methylcyklopentadienyl mangan trikarbonyl („MMT“) vedlo k nízkotlaké cestě do Mn2(CO)10.[4]
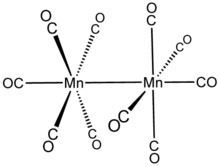
Struktura
Mn2(CO)10 nemá překlenovací CO ligandy: lze jej popsat (CO)5Mn-Mn (CO)5. Existují dva druhy CO ligandů; jeden CO na každém Mn je koaxiální s vazbou Mn-Mn (293 odpoledne ) a čtyři na každém manganu, které jsou na něj kolmé (rovníkové). Ve stabilním rotameru jsou dva Mn (CO)5 podjednotky jsou potácel se. Celková molekula tedy patří k bodová skupina D4d, což je neobvyklá symetrie sdílená s S2F10.[5]
Reakce
Mn2(CO)10 je na vzduchu stabilní jako krystalická pevná látka, ale řešení vyžadují Schlenk techniky. Najde omezené použití v organická syntéza.[6] Charakteristické reakce:
- Snížení Mn2(CO)10 dává manganový pentakarbonyl anion, který lze izolovat jako a sůl:
- Mn2(CO)10 + 2 Na → 2 Na [Mn (CO)5]
Anion je univerzální nukleofil. Protonace dává hydrid [HMn (CO)5] a methylace dává [(CH3) Mn (CO)5].
- Bromace Mn2(CO)10 postupuje štěpením vazby Mn-Mn na dávání pentakarbonylbromid manganatý.
- Mn2(CO)10 + Br2 → 2 [Mn (CO)5Br]
- Homolýza Mn2(CO)10 teplem nebo světlem dává · Mn (CO)5 radikální, umožňující Mn2(CO)10 použít jako iniciátor pro různé polymerační reakce.[6]
Bezpečnost
Mn2(CO)10 je těkavý zdroj kovu a zdroj CO.
Reference
- ^ A b Brimm, E.O .; Lynch, M. A .; Sesny, W. J. „Preparation and Properties of Manganese Carbonyl“ Journal of the American Chemical Society 1954, svazek 76, strana 3831 - 3835.
- ^ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ King, R. B. Organokovové syntézy. Svazek 1 Transition-Metal Compounds; Academic Press: New York, 1965. ISBN 0-444-42607-8
- ^ King, R. B .; Stokes, J. C .; Korenowski, T. F. „Pohodlná syntéza dimangan dekarbonylu z levných výchozích materiálů při atmosférickém tlaku“, Journal of Organometallic Chemistry 1968, svazek 11, strany 641-643.
- ^ L. F. Dahl, E. Ishishi, R. E. Rundle "Polynuclear Metal Carbonyls. I. Struktury Mn2(CO)10 a Re2(CO)10 J. Chem. Phys. 1957, svazek 26, s. 1750. doi:10.1063/1.1743615
- ^ A b Pauson, P. L. „Decacarbonyldimanganese“ v Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002 / 047084289X.rd001.pub2.
