PET pro zobrazování kostí - PET for bone imaging - Wikipedia
Pozitronová emisní tomografie pro Bone Imaging, jako in vivo sledovací technika umožňuje měření regionální koncentrace radioaktivita úměrné obrazu pixel hodnoty zprůměrované v oblasti zájmu (ROI) v kostech. Pozitronová emisní tomografie je a funkční zobrazování technika, která používá [18F] NaF radiotracer vizualizovat a kvantifikovat regionální kostní metabolismus a průtok krve. [18F] NaF se používá k zobrazování kostí za posledních 60 let. Tento článek se zaměřuje na farmakokinetika z [18F] NaF v kostech a různé semikvantitativní a kvantitativní metody kvantifikace regionálního kostního metabolismu pomocí [18F] NaF PET obrázky.
Proč [18F] NaF PET?
Měření regionálního metabolismu kostí je zásadní pro pochopení patofyziologie metabolických onemocnění kostí.
- Kostní biopsie je považován za zlatý standard pro kvantifikaci kostního obratu; jeho provedení je však invazivní, složité a nákladné a podléhá významným chybám měření.[1]
- Měření sérum nebo moč biomarkery kostního obratu jsou jednoduché, levné, rychlé a neinvazivní při měření změn v kostním metabolismu, ale poskytují pouze informace o globální kostře.[2]
- The funkční zobrazování technika dynamiky [18F] NaF PET skeny mohou kvantifikovat regionální kostní obrat na konkrétních klinicky významných místech, jako je bederní páteř a boky[3] a byl ověřen porovnáním se zlatým standardem kostní biopsie.[4][5][6]
Farmakokinetika [18F] NaF
Chemicky stabilní anion z Fluor-18-fluorid je kost - hledám radiotracer v zobrazování skeletu. [18F] NaF má afinitu k ukládání v oblastech, kde se kost nově mineralizuje.[5][7][8][9][10] Mnoho studií má [18F] NaF PET na míru kostní metabolismus na boky,[3] bederní páteř, a humerus.[11] [18F] NaF je absorbován exponenciálním způsobem představujícím ekvilibraci indikátoru s extracelulárními a buněčnými tekutinovými prostory s poločas rozpadu 0,4 hodiny a s ledvinami s biologickým poločasem 2,4 hodiny.[12] Jednokanálová extrakce [18F] NaF v kosti je 100%.[13] Po hodině zůstává pouze 10% injikované aktivity krev.[14]
18Fionty jsou považovány za obsazené extracelulární tekutina prostory, protože za prvé se vyrovnávají s transcelulární tekutina prostory a zadruhé to nejsou úplně extracelulární ionty.[15][16][17] Fluorid podléhá rovnováze s fluorovodík, který má vysokou propustnost umožňující fluoridu procházet plazmatickou krví membrána.[18] Cirkulace fluoridů v červené krvinky představuje 30%.[19] Je však volně k dispozici pro příjem na povrchu kostí, protože rovnováha mezi erytrocyty a plazmou je mnohem rychlejší než doba průchodu kapilárou. To podporují studie uvádějící 100% jednoprůchodovou extrakci plné krve 18F-ion kostí[13] a rychlé uvolnění 18Fionty z erytrocytů s rychlostní konstantou 0,3 za sekundu.[20]
[18F] NaF je také přijímán nezralými erytrocyty v kostní dřeň,[21] který hraje roli v kinetice fluoridů.[22] Vazba na plazmatické bílkoviny [18F] NaF je zanedbatelný.[23] [18F] NaF renální clearance je ovlivněna dietou[24] a pH úroveň,[25] kvůli jeho opětovné absorpci v nefronu, který je zprostředkován fluorovodíkem.[26] Velké rozdíly v průtok moči[19] při kontrolovaných experimentech se jim vyhýbá udržováním dobře hydratovaných patentů.[21]
Výměnná skupina a velikost metabolicky aktivních povrchů v kostech určuje množství nahromaděného nebo vyměněného indikátoru[27] s kostí extracelulární tekutina,[28] chemisorpce na krystaly hydroxyapatitu za vzniku fluorapatitu, [14][29][9] jak je znázorněno v rovnici-1:[30][31]
Rovnice-1
Fluoridové ionty z krystalické matrice kosti se uvolňují při remodelaci kosti, což poskytuje míru rychlosti kostního metabolismu.[32][33][34]
Měření SUV
Definice
The standardizovaná hodnota příjmu (SUV) je definována jako tkáňová koncentrace (KBq / ml) dělená aktivitou injikovanou normalizovanou na tělesná hmotnost.[35]
Vhodnost
SUV měřené od velké ROI vyhlazuje hluk, a proto je vhodnější v [18F] Studie kostí NaF, protože radiotracer je poměrně rovnoměrně absorbován v celé kosti. Měření SUV je snadné,[36] levné a rychlejší provedení, což je pro klinické použití atraktivnější. Používá se při diagnostice a hodnocení účinnosti terapie.[37][38] SUV lze měřit na jednom místě nebo na celé kostře pomocí řady statických skenů a je omezeno malým zorným polem PET skeneru.[32]
Známé problémy
SUV se ukázalo jako klinicky užitečný, i když kontroverzní, semikvantitativní nástroj v PET analýze.[39] Pro získání správného SUV je nezbytná standardizace zobrazovacích protokolů a měření SUV současně po injekci radiotraceru[40] protože zobrazování před nástupní plošinou přináší u SUV nepředvídatelné chyby až o 50%.[41] Šum, rozlišení obrazu a rekonstrukce ovlivňují přesnost SUV, ale korekce pomocí fantomu může tyto rozdíly minimalizovat při srovnání SUV pro multicentrická klinická hodnocení.[42][43] SUV může postrádat citlivost při měření reakce na léčbu, protože se jedná o jednoduché měřítko vychytávání stopovače v kosti, které je kromě cílové ROI ovlivněno absorpcí stopovače v jiných konkurenčních tkáních a orgánech.[44][45]
Měření K.i
Kvantifikace dynamických PET studií pro měření Ki vyžaduje měření skeletu křivky čas-aktivita (TAC) z oblasti zájmu (ROI) a funkce arteriálního vstupu (AIF), které lze měřit různými způsoby. Nejběžnější je však korekce obrazových křivek čas-aktivita krve pomocí několika vzorků venózní krve odebraných v diskrétních časových bodech, zatímco je pacient skenován. Výpočet rychlostních konstant nebo K.i vyžaduje tři kroky:[3]
- Měření funkce arteriálního vstupu (AIF), který funguje jako první vstup do matematického modelu distribuce stopovací látky.
- Měření křivka čas-aktivita (TAC) v zájmové oblasti skeletu, která působí jako druhý vstup do matematického modelu distribuce značkovače.
- Kinetické modelování AIF a TAC pomocí matematického modelování k získání čisté plazmatické clearance (K.i) na kostní minerál.

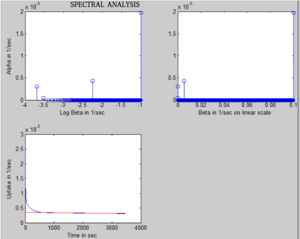
Spektrální metoda
Metodu poprvé popsali Cunningham & Jones[46] v roce 1993 pro analýzu dynamických PET dat získaných v mozku. Předpokládá, že funkci odezvy na tkáňový impuls (IRF) lze popsat jako kombinaci mnoha exponenciálů. Protože A tkáňový TAC lze vyjádřit jako konvoluci naměřené arteriální vstupní funkce s IRF, Ckost(t) lze vyjádřit jako:
kde, je operátor konvoluce, Ckost(t) je koncentrace aktivity kostní tkáně indikátoru (v jednotkách: MBq / ml) po dobu t, Cplazma(t) je plazmatická koncentrace indikátoru (v jednotkách: MBq / ml) po dobu t, IRF (t) se rovná součtu exponenciálních hodnot, hodnoty β jsou fixní mezi 0,0001 s−1 a 0,1 s−1 v intervalech 0,0001, n je počet složek α, které vyplynuly z analýzy a β1, β2,…, Βn odpovídá příslušnému α1, α2,…, Αn složky z výsledného spektra. Hodnoty α se poté odhadnou z analýzy přizpůsobením multi-exponenciálu IRF. Průsečík lineárního přizpůsobení pomalé složce této exponenciální křivky se považuje za plazmatickou clearance (K.i) na kostní minerál.
Metoda dekonvoluce
Metoda byla poprvé popsána v Williams et al. v klinickém kontextu.[47] Metoda byla použita v mnoha dalších studiích.[48][49][50] Toto je možná nejjednodušší ze všech matematických metod pro výpočet K.i ale ten nejcitlivější na hluk přítomný v datech. Tkáňový TAC je modelován jako konvoluce měřené arteriální vstupní funkce s IRF, odhady pro IRF jsou získány iterativně, aby se minimalizovaly rozdíly mezi levou a pravou stranou následující rovnice:
kde, je operátor konvoluce, Ckost(t) je koncentrace aktivity kostní tkáně indikátoru (v jednotkách: MBq / ml) po dobu t, Cplazma(t) je plazmatická koncentrace indikátoru (v jednotkách: MBq / ml) po dobu t a IRF (t) je impulzní odezva systému (tj. v tomto případě tkáně). The K.i se získá z IRF podobným způsobem, jaký se získá pro spektrální analýzu, jak je znázorněno na obrázku.
Hawkinsův model

Měření Ki z dynamických PET skenů vyžaduje kinetické modelování sledovače, aby se získaly parametry modelu popisující biologické procesy v kost, jak je popsáno v Hawkins et al.[22] Vzhledem k tomu, že tento model má dva tkáňové oddíly, někdy se mu říká dvoukompaktní kompaktní model. Existují různé verze tohoto modelu; zde je však považován za nejzásadnější přístup se dvěma tkáňovými oddíly a čtyřmi parametry výměny indikátoru. Celý proces kinetického modelování pomocí Hawkinsova modelu lze shrnout do jediného snímku, jak je vidět na pravé straně. Pro získání rychlostních konstant jsou vyřešeny následující diferenciální rovnice:
Rychlostní konstanta K.1 (v jednotkách: ml / min / ml) popisuje jednosměrnou clearance fluoridu z plazmy do celé kostní tkáně, k2 (v jednotkách: min−1) popisuje zpětný transport fluoridu z oddílu ECF do plazmy, k3 a k4 (v jednotkách min−1) popisují dopředu a dozadu transport fluoridu z kompartmentu kostních minerálů.
K.i představuje čistou plazmatickou clearance pouze na kostní minerály. K.i je funkcí obou K.1, což odráží tok krve v kostech a zlomek indikátoru, který prochází specifickou vazbou na kostní minerál k3 / (k2 + k3). Proto,
Hawkins a kol. zjistil, že zahrnutí dalšího parametru zvaného frakční objem krve (BV), představující vaskulární tkáňové prostory v ROI, zlepšil problém s přizpůsobením dat, ačkoli toto zlepšení nebylo statisticky významné.[51]
Patlakova metoda
Patlakova metoda[52] je založen na předpokladu, že zpětný tok značkovací látky z kostního minerálu do kostní ECF je nulový (tj. k4= 0). Výpočet K.i použití Patlakovy metody je jednodušší než použití nelineární regrese (NLR) kování funkce arteriálního vstupu a tkáň křivka čas-aktivita data do modelu Hawkins. Je důležité si uvědomit, že Patlakova metoda může měřit pouze clearance kostní plazmy (K.i) a nemůže měřit jednotlivé kinetické parametry, K.1, k2, k3, nebo k4.
Koncentraci stopovací látky v sledované oblasti tkáně lze představovat jako součet koncentrace v kostním ECF a kostním minerálu. Může být matematicky vyjádřen jako
kde v zájmové oblasti tkáně z PET obrazu Ckost(T) je koncentrace aktivity kostní tkáně indikátoru (v jednotkách: MBq / ml) kdykoli T, C.plazma(T) je plazmatická koncentrace indikátoru (v jednotkách: MBq / ml) v čase T, VÓ je zlomek ROI obsazené jednotkou ECF a je plocha pod křivkou plazmy je čistý přísun stopovače do sledované oblasti tkáně (v jednotkách: MBq.Sec / ml) v čase T. Patlakova rovnice je lineární rovnice formy

Proto je lineární regrese přizpůsobena datům vyneseným na ose Y a X mezi 4–60 minutami, aby byla získána m a C hodnoty, kde m je sklon regresní přímky představující K.i a C je Y-průsečík regresní přímky představující VÓ.[52]
Siddique-Blakeova metoda
Výpočet Ki pomocí arteriální vstupní funkce, křivky časové aktivity a Hawkinsova modelu byl omezen na malou oblast skeletu pokrytou úzkým zorným polem PET skeneru při získávání dynamického skenování. Siddique a kol.[53] v roce 2012 ukázal, že je možné měřit K.i hodnoty v kostech pomocí statické [18F] NaF PET skenování. Blake a kol.[32] později v roce 2019 ukázal, že K.i získaný metodou Siddique-Blake má chyby přesnosti menší než 10%. Přístup Siddique-Blake je založen na kombinaci Patlakovy metody,[52] arteriální vstupní funkce založená na semi-populaci,[54] a informace, které VÓ významně nemění následnou léčbu. Tato metoda využívá informace, že lineární regresní přímku lze zakreslit pomocí dat z minimálně dvou časových bodů, aby získala m a C jak je vysvětleno v Patlakově metodě. Pokud však VÓ je znám nebo opraven, k získání druhého časového bodu k měření je zapotřebí pouze jeden statický PET obraz m, představující K.i hodnota. Tato metoda by měla být aplikována s velkou opatrností na jiné klinické oblasti, kde tyto předpoklady nemusí platit.
SUV vs K.i
Nejzásadnější rozdíl mezi SUV a K.i Hodnoty jsou, že SUV je jednoduché měřítko absorpce, které se normalizuje na tělesnou hmotnost a vstřikovanou aktivitu. SUV nebere v úvahu dodávku značkovače do místní oblasti zájmu, odkud jsou získávána měření, tedy ovlivněna spotřebou fyziologického procesu [18F] NaF jinde v těle. Na druhou stranu Ki měří plazmatickou clearance na kostní minerály, přičemž bere v úvahu absorpci stopovací látky jinde v těle, která ovlivňuje dodávku stopovací látky do oblasti zájmu, odkud jsou měření získána. Rozdíl v měření Ki a SUV v kostní tkáni pomocí [18F] NaF jsou vysvětleny podrobněji Blake et al.[34]
Je důležité si uvědomit, že většina metod pro výpočet Ki vyžadují dynamické PET skenování přes hodinu, kromě metod Siddique-Blake. Dynamické skenování je komplikované a nákladné. Výpočet SUV však vyžaduje jediné statické PET vyšetření provedené přibližně 45–60 minut po injekci stopovací látky v jakékoli oblasti zobrazené ve skeletu.
Mnoho vědců prokázalo vysokou korelaci mezi SUV a K.i hodnoty na různých místech skeletu.[55][56][57] Nicméně, SUV a K.i metody mohou být v rozporu s měřením reakce na léčbu.[45] Jelikož SUV nebyl validován proti histomorfometrii, je jeho užitečnost ve studiích kostí, které měří odpověď na léčbu a progresi onemocnění, nejistá.
Viz také
- Kost
- Pozitronová emisní tomografie
- Křivka čas-aktivita
- Funkce arteriálního vstupu
- Lékařské zobrazování
- Radiologie
- Molekulární zobrazování
- Lékařské zobrazování
- Kostní scintigrafie
Reference
- ^ Compston, J. E.; Croucher, P.I. (Srpen 1991). "Histomorfometrické hodnocení remodelace trabekulární kosti při osteoporóze". Kosti a minerály. 14 (2): 91–102. doi:10.1016 / 0169-6009 (91) 90086-f. ISSN 0169-6009. PMID 1912765.
- ^ Beck Jensen, J. E .; Kollerup, G .; Ørensen, H. A .; Nielsen, S. Pors; Sørensen, O. H. (leden 1997). „Jediné měření biochemických markerů kostního obratu má u jednotlivé osoby omezenou užitečnost.“ Scandinavian Journal of Clinical and Laboratory Investigation. 57 (4): 351–359. doi:10.3109/00365519709099408. ISSN 0036-5513. PMID 9249882.
- ^ A b C Puri, T .; Frost, M.L .; Curran, K. M .; Siddique, M .; Moore, A. E. B .; Cook, G. J. R .; Marsden, P. K .; Fogelman, I .; Blake, G. M. (2012-05-12). „Rozdíly v regionálním kostním metabolismu páteře a kyčle: kvantitativní studie využívající pozitronovou emisní tomografii 18F-fluorid“. Osteoporóza mezinárodní. 24 (2): 633–639. doi:10.1007 / s00198-012-2006-x. ISSN 0937-941X. PMID 22581294. S2CID 22146999.
- ^ Aaltonen, Louise; Koivuviita, Niina; Seppänen, Marko; Tong, Xiaoyu; Kröger, Heikki; Löyttyniemi, Eliisa; Metsärinne, Kaj (květen 2020). „Korelace mezi pozitronovou emisní tomografií 18F-fluorid sodný a kostní histomorfometrií u dialyzovaných pacientů“. Kost. 134: 115267. doi:10.1016 / j.bone.2020.115267. ISSN 8756-3282. PMID 32058018.
- ^ A b Messa, C. (1993-10-01). "Kostní metabolická aktivita měřená pozitronovou emisní tomografií a [18F] fluoridovým iontem v renální osteodystrofii: korelace s kostní histomorfometrií". Journal of Clinical Endocrinology & Metabolism. 77 (4): 949–955. doi:10.1210 / jc.77.4.949. ISSN 0021-972X. PMID 8408470.
- ^ Piert, Morand; Zittel, Tilman T .; Machulla, Hans-Jurgen; Becker, Georg Alexander; Jahn, Michael; Maier, Gerhard; Bares, Roland; Becker, Horst Dieter (01.08.1998). "Měření průtoku krve pomocí [15O] H2O a [18F] fluoridového iontového PET u prasat obratlů". Journal of Bone and Mineral Research. 13 (8): 1328–1336. doi:10.1359 / jbmr.1998.13.8.1328. ISSN 0884-0431. PMID 9718202. S2CID 19824951.
- ^ Piert, Morand; Machulla, Hans-Jürgen; Jahn, Michael; Stahlschmidt, Anke; Becker, Georg A .; Zittel, Tilman T. (2002-04-13). „Spojení toku krve a metabolismu vepřových kostí při vysokém obratu kostních onemocnění měřeno pomocí [15O] H2O a [18F] pozitronové emisní tomografie pomocí fluoridových iontů“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 29 (7): 907–914. doi:10.1007 / s00259-002-0797-2. ISSN 1619-7070. PMID 12111131. S2CID 2591493.
- ^ Schumichen, C .; Rempfle, H .; Wagner, M .; Hoffmann, G. (1979). "Krátkodobá fixace radiofarmak v kosti". Evropský žurnál nukleární medicíny. 4 (6): 423–428. doi:10.1007 / bf00300839. ISSN 0340-6997. PMID 520356. S2CID 23813593.
- ^ A b Narita, Naoki; Kato, Kazuo; Nakagaki, Haruo; No, Norikazu; Kameyama, Yoichiro; Weatherell, John A. (březen 1990). "Distribuce koncentrace fluoridů v kosti krysy". Kalcifikovaná tkáňová mezinárodní. 46 (3): 200–204. doi:10.1007 / bf02555045. ISSN 0171-967X. PMID 2106380. S2CID 2707183.
- ^ REEVE, J .; ARLOT, M .; WOOTTON, R .; EDOUARD, C .; TELLEZ, M .; HESP, R .; GREEN, J. R .; MEUNIER, P. J. (červen 1988). „Skeletální průtok krve, iliakální histomorfometrie a kinetika stroncia v osteoporóze: vztah mezi průtokem krve a rychlostí korekce“. The Journal of Clinical Endocrinology & Metabolism. 66 (6): 1124–1131. doi:10.1210 / jcem-66-6-1124. ISSN 0021-972X. PMID 3372678.
- ^ Cook, Gary J. R .; Lodge, Martin A .; Blake, Glen M .; Marsden, Paul K .; Fogelman, Ignac (2010-02-18). „Rozdíly v kinetice skeletu mezi obratlovými a humerálními kostmi měřené pozitronovou emisní tomografií 18F-fluor u žen po menopauze“. Journal of Bone and Mineral Research. 15 (4): 763–769. doi:10.1359 / jbmr.2000.15.4.763. ISSN 0884-0431. PMID 10780868. S2CID 10630967.
- ^ Krishnamurthy, GT; Huebotter, RJ; Tubis, M; Blahd, WH (únor 1976). „Farmakokinetika současných radiofarmak hledajících kostru“. American Journal of Roentgenology. 126 (2): 293–301. doi:10.2214 / ajr.126.2.293. ISSN 0361-803X. PMID 175699.
- ^ A b Wootton, R; Dore, C (listopad 1986). "Jednoprůchodová extrakce 18 F v králičí kosti". Klinická fyzika a fyziologické měření. 7 (4): 333–343. Bibcode:1986CPPM .... 7..333W. doi:10.1088/0143-0815/7/4/003. ISSN 0143-0815. PMID 3791879.
- ^ A b Blau, Monte; Ganatra, Ramanik; Bender, Merrill A. (leden 1972). "18F-fluorid pro zobrazování kostí". Semináře z nukleární medicíny. 2 (1): 31–37. doi:10.1016 / s0001-2998 (72) 80005-9. ISSN 0001-2998. PMID 5059349.
- ^ Edelman, I.S .; Leibman, J. (srpen 1959). "Anatomie tělesné vody a elektrolytů". American Journal of Medicine. 27 (2): 256–277. doi:10.1016/0002-9343(59)90346-8. ISSN 0002-9343. PMID 13819266.
- ^ Pierson, R. N .; Price, D. C .; Wang, J .; Jain, R. K. (01.09.1978). "Měření extracelulární vody: kinetika stopového orgánu bromidu a sacharózy u potkanů a lidí". American Journal of Physiology-Renal Physiology. 235 (3): F254 – F264. doi:10.1152 / ajprenal.1978.235.3.f254. ISSN 1931-857X. PMID 696835.
- ^ Staffurth, J. S .; Birchall, I. (leden 1959). „Význam stanovení radioaktivního jódu vázaného na bílkoviny u hypertyreózy“. Acta Endocrinologica. 30 (1): 42–52. doi:10.1530 / acta.0.0300042. ISSN 0804-4643. PMID 13605561.
- ^ Whitford, G.M. (Červen 1994). "Příjem a metabolismus fluoridů". Pokroky v zubním výzkumu. 8 (1): 5–14. doi:10.1177/08959374940080011001. ISSN 0895-9374. PMID 7993560. S2CID 21763028.
- ^ A b Hosking, D. J .; Chamberlain, M. J. (01.02.1972). "Studie na člověku s 18F". Klinická věda. 42 (2): 153–161. doi:10.1042 / cs0420153. ISSN 0009-9287. PMID 5058570.
- ^ TOSTESON, D. C. (leden 1959). „Halogenidový transport v červených krvinkách“. Acta Physiologica Scandinavica. 46 (1): 19–41. doi:10.1111 / j.1748-1716.1959.tb01734.x. ISSN 0001-6772.
- ^ A b Blake, Glen M .; Park-Holohan, So-Jin; Cook, Gary J.R .; Fogelman, Ignac (leden 2001). „Kvantitativní studie kostí s použitím 18F-fluoridu a 99mTc-methylendifosfonátu“. Semináře z nukleární medicíny. 31 (1): 28–49. doi:10.1053 / snuc.2001.18742. ISSN 0001-2998. PMID 11200203.
- ^ A b Hoh, Carl K .; Hawkins, Randall A .; Dahlbom, Magnus; Glaspy, John A .; Seeger, Leanne L .; Choi, Yong; Schiepers, Christiaan W .; Huang, Sung-cheng; Satyamurthy, Nagichettiar; Barrio, Jorge R .; Phelps, Michael E. (leden 1993). "Zobrazování celého těla s použitím [18F] fluoridových iontů a PET". Journal of Computer Assisted Tomography. 17 (1): 34–41. doi:10.1097/00004728-199301000-00005. ISSN 0363-8715. PMID 8419436.
- ^ TAVES, DONALD R. (listopad 1968). „Elektroforetická mobilita fluoridu v séru“. Příroda. 220 (5167): 582–583. Bibcode:1968 Natur.220..582T. doi:10.1038 / 220582a0. ISSN 0028-0836. PMID 5686731. S2CID 4220484.
- ^ Ekstrand, J .; Spak, C. J .; Ehrnebo, M. (2009-03-13). „Renální clearance fluoru v ustáleném stavu u člověka: Vliv průtoku moči a změny pH dietou“. Acta Pharmacologica et Toxicologica. 50 (5): 321–325. doi:10.1111 / j.1600-0773.1982.tb00982.x. ISSN 0001-6683. PMID 7113707.
- ^ Ekstrand, Jan; Ehrnebo, Mats; Boréus, Lars O. (březen 1978). „Biologická dostupnost fluoridů po intravenózním a orálním podání: Význam renální clearance a odtoku moči“. Klinická farmakologie a terapeutika. 23 (3): 329–337. doi:10.1002 / cpt1978233329. ISSN 0009-9236. PMID 627140. S2CID 26176903.
- ^ Whitford, GM; Pashley, DH; Stringer, GI (01.02.1976). "Fluoridová renální clearance: událost závislá na pH". American Journal of Physiology-Legacy Content. 230 (2): 527–532. doi:10.1152 / ajplegacy.1976.230.2.527. ISSN 0002-9513. PMID 1259032.
- ^ Costeas, A .; Woodard, H. Q .; Laughlin, J. S. (květen 1971). "Srovnávací kinetika vápníku a fluoridů v králičí kosti". Radiační výzkum. 46 (2): 317. Bibcode:1971RadR ... 46..317C. doi:10.2307/3573023. ISSN 0033-7587. JSTOR 3573023. PMID 5564840.
- ^ Walker, P. G. (listopad 1958). „CHEMICKÁ DYNAMIKA KOSTNÍHO MINERÁLU. William F. Neuman a Margaret W. Neuman. 9 × 5 × 0,5 palce. Xi + 209, s 51 čísly a 24 tabulkami. Rejstřík. 1958. Chicago: University of Chicago Press. Londýn: Cambridge University Press. Cena 37 s. 6 d ". The Journal of Bone and Joint Surgery. Britský svazek. 40-B (4): 846. doi:10.1302 / 0301-620x.40b4.846. ISSN 0301-620X.
- ^ Ishiguro, Koji; Nakagaki, Haruo; Tsuboi, Shinji; Narita, Naoki; Kato, Kazuo; Li, Jianxue; Kamei, Hideo; Yoshioka, Ikuo; Miyauchi, Kenichi; Hosoe, Hiroyo; Shimano, Ryouyu (duben 1993). "Distribuce fluoridu v kortikální kosti lidského žebra". Kalcifikovaná tkáňová mezinárodní. 52 (4): 278–282. doi:10.1007 / bf00296652. ISSN 0171-967X. PMID 8467408. S2CID 31137242.
- ^ Grynpas, Marc D. (2010-02-25). "Účinky fluoridů na kostní krystaly". Journal of Bone and Mineral Research. 5 (S1): S169 – S175. doi:10,1002 / jbmr.5650051362. ISSN 0884-0431. PMID 2187325. S2CID 22713623.
- ^ Jones, Alun G .; Francis, Marion D .; Davis, Michael A. (leden 1976). "Skenování kostí: Radionuklidové reakční mechanismy". Semináře z nukleární medicíny. 6 (1): 3–18. doi:10.1016 / s0001-2998 (76) 80032-3. ISSN 0001-2998. PMID 174228.
- ^ A b C Blake, Glen M .; Puri, Tanuj; Siddique, Musib; Frost, Michelle L .; Moore, Amelia E. B .; Fogelman, Ignac (únor 2018). „Lokální měření tvorby kostí pomocí [18F] fluoridu sodného PET / CT“. Kvantitativní zobrazování v medicíně a chirurgii. 8 (1): 47–59. doi:10.21037 / qims.2018.01.02. PMC 5835654. PMID 29541623.
- ^ Grant, F. D .; Fahey, F. H .; Packard, A. B .; Davis, R. T .; Alavi, A .; Treves, S. T. (12. 12. 2007). „Skeletální PET s 18F-fluoridem: Aplikace nové technologie na starý sledovač“. Journal of Nuclear Medicine. 49 (1): 68–78. doi:10,2967 / jnumed.106.037200. ISSN 0161-5505. PMID 18077529.
- ^ A b Blake, Glen M .; Siddique, Musib; Frost, Michelle L .; Moore, Amelia E.B .; Fogelman, Ignac (září 2011). „Radionuklidové studie kostního metabolismu: Zajišťují vychytávání kostí a clearance kostní plazmy ekvivalentní měření kostního obratu?“. Kost. 49 (3): 537–542. doi:10.1016 / j.bone.2011.05.031. ISSN 8756-3282. PMID 21689803.
- ^ Huang, (Henry) Sung-Cheng (říjen 2000). "Anatomie SUV". Nukleární medicína a biologie. 27 (7): 643–646. doi:10.1016 / s0969-8051 (00) 00155-4. ISSN 0969-8051. PMID 11091106.
- ^ Basu, Sandip; Zaidi, Habib; Houseni, Mohamed; Bural, Gonca; Udupa, Jay; Acton, Paul; Torigian, Drew A .; Alavi, Abass (květen 2007). „Nové kvantitativní techniky pro hodnocení regionální a globální funkce a struktury založené na moderních zobrazovacích modalitách: důsledky pro normální variace, stárnutí a nemocné státy“. Semináře z nukleární medicíny. 37 (3): 223–239. doi:10.1053 / j.semnuclmed.2007.01.005. ISSN 0001-2998. PMID 17418154.
- ^ Lucignani, G .; Paganelli, G .; Bombardieri, E. (červenec 2004). „Využití standardizovaných hodnot absorpce pro hodnocení absorpce FDG s PET v onkologii: klinická perspektiva“. Komunikace nukleární medicíny. 25 (7): 651–656. doi:10.1097 / 01.mnm.0000134329.30912.49. ISSN 0143-3636. PMID 15208491. S2CID 38728335.
- ^ Frost, M.L .; Blake, G. M .; Park-Holohan, S.-J .; Cook, G. J. R.; Curran, K. M .; Marsden, P. K .; Fogelman, I. (2008-04-15). „Dlouhodobá přesnost 18F-fluoridových PET kosterních kinetických studií při hodnocení kostního metabolismu“. Journal of Nuclear Medicine. 49 (5): 700–707. doi:10.2967 / jnumed.107.046987. ISSN 0161-5505. PMID 18413385.
- ^ Visser, E. P .; Boerman, O. C .; Oyen, W. J.G. (2010-01-15). „SUV: Od hloupé zbytečné hodnoty k inteligentní hodnotě příjmu“. Journal of Nuclear Medicine. 51 (2): 173–175. doi:10.2967 / jnumed.109.068411. ISSN 0161-5505. PMID 20080897.
- ^ Halama, J; Sadjak, R; Wagner, R (červen 2006). „SU-FF-I-82: Variabilita a přesnost standardizovaných hodnot příjmu v PET skenech FDG“. Lékařská fyzika. 33 (6Part4): 2015–2016. Bibcode:2006MedPh..33.2015H. doi:10.1118/1.2240762. ISSN 0094-2405.
- ^ Fischman, Alan J .; Alpert, Nathaniel M .; Babich, John W .; Rubin, Robert H. (leden 1997). "Role pozitronové emisní tomografie ve farmakokinetické analýze". Recenze metabolismu drog. 29 (4): 923–956. doi:10.3109/03602539709002238. ISSN 0360-2532. PMID 9421680.
- ^ Krak, Nanda C .; Boellaard, R .; Hoekstra, Otto S .; Twisk, Jos W. R .; Hoekstra, Corneline J .; Lammertsma, Adriaan A. (2004-10-15). "Účinky definice ROI a metody rekonstrukce na kvantitativní výsledek a použitelnost ve studii monitorování odezvy". Evropský žurnál nukleární medicíny a molekulárního zobrazování. 32 (3): 294–301. doi:10.1007 / s00259-004-1566-1. ISSN 1619-7070. PMID 15791438. S2CID 22518269.
- ^ Westerterp, Marinke; Pruim, Jan; Oyen, Wim; Hoekstra, Otto; Paans, Anne; Visser, Eric; van Lanschot, Jan; Sloof, Gerrit; Boellaard, Ronald (11.10.2006). „Kvantifikace studií FDG PET pomocí standardizovaných hodnot absorpce v multicentrických studiích: účinky rekonstrukce obrazu, rozlišení a parametrů definice ROI“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 34 (3): 392–404. doi:10.1007 / s00259-006-0224-1. ISSN 1619-7070. PMID 17033848. S2CID 1521701.
- ^ Blake, G. M .; Frost, M.L .; Fogelman, I. (2009-10-16). „Kvantitativní radionuklidové studie kostí“. Journal of Nuclear Medicine. 50 (11): 1747–1750. doi:10,2967 / jnumed.10.06.063263. ISSN 0161-5505. PMID 19837752.
- ^ A b Frost, Michelle L; Siddique, Musib; Blake, Glen M; Moore, Amelia EB; Schleyer, Paul J; Dunn, Joel T; Somer, Edward J; Marsden, Paul K; Eastell, Richard; Fogelman, Ignac (květen 2011). „Diferenciální účinky teriparatidu na regionální tvorbu kostí pomocí pozitronové emisní tomografie 18F-fluoridem“. Journal of Bone and Mineral Research. 26 (5): 1002–1011. doi:10,1002 / jbmr.305. ISSN 0884-0431. PMID 21542003. S2CID 40840920.
- ^ Cunningham, Vincent J .; Jones, Terry (leden 1993). „Spektrální analýza dynamických PET studií“. Journal of Cerebral Blood Flow & Metabolism. 13 (1): 15–23. doi:10.1038 / jcbfm.1993.5. ISSN 0271-678X. PMID 8417003.
- ^ Spedding, V. (2001). „Živá laboratoř bude analyzovat tržní data v reálném čase“. Kvantitativní finance. 1 (6): 568–570. doi:10.1088/1469-7688/1/6/606. ISSN 1469-7688. S2CID 154537213.
- ^ Liberati, D .; Turkheimer, F. (1999). "Lineární spektrální dekonvoluce poklesu katabolické plazmatické koncentrace při dialýze". Lékařské a biologické inženýrství a výpočetní technika. 37 (3): 391–395. doi:10.1007 / bf02513317. ISSN 0140-0118. PMID 10505392. S2CID 25080033.
- ^ Lau, Chi-hoi Lun, Pak-kong Daniel Feng, D. David (1998). Neinvazivní kvantifikace fyziologických procesů s dynamickým PET pomocí slepé dekonvoluce. IEEE. OCLC 697321031.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Chi-Hoi Lau; Lun, D.P.-K .; Dagan Feng (1998). "Neinvazivní kvantifikace fyziologických procesů s dynamickým PET pomocí slepé dekonvoluce". Sborník mezinárodní konference IEEE z roku 1998 o akustice, zpracování řeči a signálu, ICASSP '98 (kat. Č. 98CH36181). IEEE. 3: 1805–1808. doi:10.1109 / icassp.1998.681811. ISBN 0-7803-4428-6. S2CID 5947145.
- ^ Puri, Tanuj; Blake, Glen M .; Frost, Michelle L .; Siddique, Musib; Moore, Amelia E.B .; Marsden, Paul K .; Cook, Gary J.R .; Fogelman, Ignac; Curran, Kathleen M. (červen 2012). „Srovnání šesti kvantitativních metod pro měření kostního obratu v oblasti kyčle a bederní páteře pomocí 18F-fluoridu PET-CT“. Komunikace nukleární medicíny. 33 (6): 597–606. doi:10.1097 / MNM.0b013e3283512adb. ISSN 0143-3636. PMID 22441132. S2CID 23490366.
- ^ A b C Patlak, Clifford S .; Blasberg, Ronald G .; Fenstermacher, Joseph D. (březen 1983). „Grafické vyhodnocení konstant přenosu krve do mozku z údajů o vícenásobném příjmu“. Journal of Cerebral Blood Flow & Metabolism. 3 (1): 1–7. doi:10.1038 / jcbfm.1983.1. ISSN 0271-678X. PMID 6822610.
- ^ Siddique, Musib; Blake, Glen M .; Frost, Michelle L .; Moore, Amelia E. B .; Puri, Tanuj; Marsden, Paul K .; Fogelman, Ignac (08.11.2011). "Odhad regionálního kostního metabolismu z celotělového 18F-fluoridového PET statického obrazu". Evropský žurnál nukleární medicíny a molekulárního zobrazování. 39 (2): 337–343. doi:10.1007 / s00259-011-1966-r. ISSN 1619-7070. PMID 22065012. S2CID 23959977.
- ^ Blake, Glen Mervyn; Siddique, Musib; Puri, Tanuj; Frost, Michelle Lorraine; Moore, Amelia Elizabeth; Cook, Gary James R .; Fogelman, Ignac (srpen 2012). "Semipopulační vstupní funkce pro kvantifikaci statických a dynamických 18F-fluoridových PET skenů". Komunikace nukleární medicíny. 33 (8): 881–888. doi:10,1097 / mnm.0b013e3283550275. ISSN 0143-3636. PMID 22617486. S2CID 42973690.
- ^ Puri, Tanuj; Blake, Glen M .; Frost, Michelle L .; Siddique, Musib; Moore, Amelia E.B .; Marsden, Paul K .; Cook, Gary J.R .; Fogelman, Ignac; Curran, Kathleen M. (červen 2012). "Srovnání šesti kvantitativních metod pro měření kostního obratu v kyčli a bederní páteři pomocí 18F-fluoridu PET-CT". Komunikace nukleární medicíny. 33 (6): 597–606. doi:10.1097 / mnm.0b013e3283512adb. ISSN 0143-3636. PMID 22441132. S2CID 23490366.
- ^ BRENNER, W. (2004). „Srovnání různých kvantitativních přístupů k 18F-fluoridovým PET skenům“. J Nucl Med. 45 (9): 1493–500. PMID 15347716.
- ^ Brenner, Winfried; Vernon, Cheryl; Conrad, ErnestU .; Eary, JanetF. (2004-06-10). "Hodnocení metabolické aktivity kostních štěpů s 18F-fluoridovým PET". Evropský žurnál nukleární medicíny a molekulárního zobrazování. 31 (9): 1291–8. doi:10.1007 / s00259-004-1568-z. ISSN 1619-7070. PMID 15197502. S2CID 10000344.
| Prostředky knihovny o PET |










