Seznam biofyzikálně důležitých makromolekulárních krystalových struktur - List of biophysically important macromolecular crystal structures

Krystalické struktury molekul bílkovin a nukleových kyselin a jejich komplexy jsou ústředním bodem praxe většiny částí biofyzika, a formovali mnoho z toho, co vědecky chápeme na úrovni atomových detailů biologie. Jejich význam zdůrazňuje OSN, která prohlásila rok 2014 jako Mezinárodní rok krystalografie, k 100. výročí Max von Laue rok 1914 Nobelova cena za objevení difrakce rentgenových paprsků krystaly. Tento chronologický seznam biofyzikálně významných struktur proteinů a nukleových kyselin je volně založen na přehledu v Biofyzikální deník.[1] Seznam obsahuje všech prvních tucet odlišných struktur, ty, které prolomily nové základy v předmětu nebo metodě, a ty, které se staly modelovými systémy pro práci v budoucích biofyzikálních oblastech výzkumu.
Myoglobin


1960 - Myoglobin byla vůbec první krystalovou strukturou molekuly proteinu s vysokým rozlišením.[2] Myoglobin je kolébkou obsahující železo heme skupina, která reverzibilně váže kyslík pro použití při napájení sval vlákna a tyto první krystaly byly z myoglobinu z vorvaně, jehož svaly potřebují velké zásoby kyslíku pro hluboké ponory. Myoglobinová trojrozměrná struktura je tvořena 8 alfa-šroubovice a krystalová struktura ukázala, že jejich konformace byla pravá a velmi těsně odpovídala geometrii navržené Linus Pauling, s 3,6 zbytky na otáčku a vodíkovými vazbami hlavního řetězce z peptidu NH jednoho zbytku na peptid CO zbytku i + 4. Myoglobin je modelový systém pro mnoho typů biofyzikálních studií,[3] zejména zahrnující proces vázání malých ligandů, jako jsou kyslík a kysličník uhelnatý.
Hemoglobin

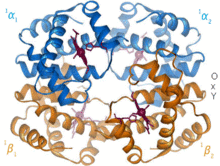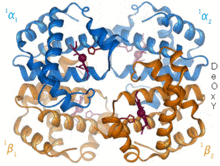
1960 - The Hemoglobin Krystalická struktura[4] ukázal tetramer dvou příbuzných typů řetězců a byl vyřešen s mnohem nižším rozlišením než monomerní myoglobin, ale měl jasně stejnou základní 8šroubovicovou architekturu (nyní označovanou jako „globin fold“). Další hemoglobinové krystalové struktury při vyšším rozlišení [PDB 1MHB, 1DHB) brzy ukázaly spojenou změnu jak lokálních, tak kvartérní konformace mezi stavy kyslíku a deoxy hemoglobinu,[5] což vysvětluje kooperativitu vazby kyslíku v krvi a alosterický účinek faktorů, jako je pH a DPG. Po celá desetiletí byl hemoglobin primárním výukovým příkladem pro koncept allostery, stejně jako intenzivní zaměření výzkumu a diskuse o allostery. V roce 1909 byly krystaly hemoglobinu z> 100 druhů použity k uvedení taxonomie do souvislosti s molekulárními vlastnostmi.[6] Tuto knihu citoval Perutz ve zprávě z roku 1938[7] krystalů koňského hemoglobinu, který zahájil jeho dlouhou ságu k vyřešení krystalové struktury. Krystaly hemoglobinu jsou pleochroický - tmavě červená ve dvou směrech a světle červená ve třetím[6] - kvůli orientaci lemů a světlé Soretské pásmo hemu porfyrin skupiny se používá ve spektroskopické analýze vazby ligandu hemoglobinu.

Lysozym ze slepičích vajec
1965 - Slepičí vejce lysozym (Soubor PDB 1lyz).[8] byla první krystalovou strukturou enzymu (štěpí se v malém množství sacharidy na jednoduché cukry), používané pro rané studie mechanismu enzymů.[9] Obsahovalo to beta list (antiparalelní) i helixy a byla také první makromolekulární strukturou, která měla své atomové souřadnice vylepšené (v reálném prostoru).[10] Výchozí materiál pro přípravu lze zakoupit v obchodě a lysozym ze slepičích vajec velmi snadno krystalizuje v mnoha různých vesmírné skupiny; je to oblíbený testovací případ pro nové krystalografické experimenty a nástroje. Posledními příklady jsou nanokrystaly lysozymu pro sběr dat laserovým paprskem s volnými elektrony[11] a mikrokrystaly pro difrakci mikroelektronů.[12]

Ribonukleáza
1967 - Ribonukleáza A (Soubor PDB 2RSA)[13] je enzym štěpící RNA stabilizovaný 4 disulfidovými vazbami. Bylo použito v Anfinsen Klíčový výzkum skládání proteinů, který vedl k konceptu, že 3-dimenzionální struktura proteinu byla určena jeho aminokyselina sekvence. Ribonukleáza S., rozštěpená, dvousložková forma, kterou studoval Fred Richards, byl také enzymaticky aktivní, měl téměř identickou krystalovou strukturu (soubor PDB 1RNS),[14] a ukázalo se, že je katalyticky aktivní i v krystalu,[15] pomáhá rozptýlit pochybnosti o důležitosti struktur proteinových krystalů pro biologickou funkci.

Serinové proteázy
1967 - The serinové proteázy jsou historicky velmi důležitou skupinou enzymových struktur, protože společně osvětlovaly katalytický mechanismus (v jejich případě Ser-His-Asp „katalytickou triádou“), základ odlišných substrátových specificit a aktivační mechanismus, kterým kontrolovaný enzymatický štěpení pohřbí nový konec řetězu, aby se správně uspořádalo aktivní místo.[16] Zahrnuty rané krystalové struktury chymotrypsin(Soubor PDB 2CHA),[17] chymotrypsinogen (Soubor PDB 1CHG),[18] trypsin (Soubor PDB 1PTN),[19] a elastáza (Soubor PDB 1EST).[20] Byly také prvními proteinovými strukturami, které vykazovaly dvě téměř identické domény, pravděpodobně příbuzné genová duplikace. Jedním z důvodů jejich širokého použití jako příkladů učebnic a učeben byl systém číslování inzerčních kódů (nenáviděný všemi počítačovými programátory), díky kterému byly Ser195 a His57 konzistentní a nezapomenutelné i přes rozdíly v sekvenci specifické pro protein.
Papain
1968 - Papain


Karboxypeptidáza
1969 - Karboxypeptidáza A je zinek metaloproteáza. Jeho krystalová struktura (soubor PDB 1CPA)[21] ukázaly první paralelní beta strukturu: velký zkroucený centrální list 8 pramenů s aktivním místem Zn umístěným na C-terminálním konci středních pramenů a list lemovaný na obou stranách alfa helixy. Je to exopeptidáza který štěpí peptidy nebo proteiny z karboxy-terminálního konce spíše než interně v sekvenci. Později byl vyřešen malý proteinový inhibitor karboxypeptidázy (PDB soubor 4CPA)[22] který mechanicky zastaví katalýzu tím, že prezentuje svůj C-terminální konec, který právě vyčnívá z kruhu disulfidových vazeb s těsnou strukturou za sebou, což brání enzymu nasávat řetězec kolem prvního zbytku.

Subtilisin
1969 - Subtilisin (Soubor PDB 1 sbt [23]) byl druhým typem serinové proteázy s téměř identickým aktivním místem jako rodina enzymů trypsinu, ale se zcela odlišným celkovým složením. To poskytlo první pohled na konvergentní evoluci na atomové úrovni. Později intenzivní mutační studie na subtilisinu dokumentovala účinky všech 19 dalších aminokyselin v každé jednotlivé poloze.[24]
Laktátdehydrogenáza
1970 - Laktátdehydrogenáza

Inhibitor trypsinu
1970 - Základní pankreatická inhibitor trypsinunebo BPTI (soubor PDB 2pti[25]), je malý, velmi stabilní protein, který byl vysoce produktivním modelovým systémem pro studium super-těsné vazby, disulfidová vazba (SS) formace, skládání bílkovin, molekulární stabilita aminokyselinou mutace nebo výměna vodík-deuterium a rychlá místní dynamika pomocí NMR. Biologicky se BPTI váže a inhibuje trypsin zatímco jsou uloženy v slinivka břišní umožňující aktivaci trávení bílkovin až po uvolnění trypsinu do žaludku.

Rubredoxin
1970 - Rubredoxin (Soubor PDB 2rxn[26]) byla první vyřešenou redoxní strukturou, minimalistický protein se železem vázaným 4 bočními řetězci Cys ze 2 smyček v horní části β vlásenek. Zlomil se na 1,2 A, což umožnilo první reciproční prostor upřesnění bílkoviny (4,5rxn[27]). [Pozn .: pozor 4rxn, provedeno bez omezení geometrie!] Archaeal rubredoxiny představují mnoho malých struktur s nejvyšším rozlišením v PNR.


Inzulín
1971 - Inzulín (Soubor PDB 1INS)[28] je hormon centrální vůči metabolismus skladování cukru a tuků a důležité při lidských nemocech, jako je obezita a cukrovka. Je biofyzikálně pozoruhodný svou vazbou na Zn, rovnováhou mezi stavy monomeru, dimeru a hexameru, schopností tvořit krystaly in vivo a svou syntézou jako delší „pro“ formu, která se poté štěpí, aby se složila jako aktivní 2- řetězec, SS vázaný monomer. Inzulin byl úspěšný NASA program růstu krystalů na internetu raketoplán, produkující hromadné přípravky velmi uniformních drobných krystalů pro kontrolované dávkování.
Stafylokoková nukleáza
1971 - Stafylokoková nukleáza
Cytochrom C.
1971 - Cytochrom C.
F4 lyzozym fága
1974 - F4 fág lysozym
Imunoglobuliny
1974 - Imunoglobuliny
Superoxid dismutáza
1975 - Cu, Zn Superoxid dismutáza
Přeneste RNA
1976 - Přeneste RNA

Triosa fosfát izomeráza
1976 - Triosa fosfát izomeráza
Aspartové proteázy podobné pepsinu
1976 - Rhizopuspepsin
1976 - Endothiapepsin
1976 - Penicillopepsin
Ikosahedrální viry
1978 - Icosahedral virus
1981 - Dickerson ve tvaru B. DNA dodecamer
1981 - Crambin
1985 - Kalmodulin
1985 - DNA polymeráza

1985 - Centrum fotosyntetické reakce Páry bakteriochlorofylů (zelené) uvnitř membrány zachycují energii ze slunečního záření a poté putují mnoha kroky, aby byly k dispozici u hemových skupin (červená) v modulu cytochrom-C nahoře. Toto byla první krystalová struktura vyřešená pro membránový protein, milník uznaný Nobelovou cenou Hartmutovi Michelovi, Hansi Deisenhoferovi a Robertu Huberovi.
Interakce represor / DNA

1986 - Interakce represor / DNA
1987 Hlavní komplex histokompatibility '
1987 Ubikvitin
1987 ROP protein
Aspartová proteáza HIV-1
1989 HIV-1 proteáza
1990 Bakteriorhodopsin
1991 GCN4 svinutá cívka
HIV-1 reverzní transkriptáza
1991 HIV-1 reverzní transkriptáza
1993 Beta šroubovice z Pektátová lyáza
1994 Kolagen
1994 Barnase / barstar komplex
1994 F1 ATPáza
1995 Heterotrimerické G proteiny
1996 Zelený fluorescenční protein

Kinesin
1996 - Kinesin motorický protein
1997 GroEL / ES chaperone
1997 Nukleosom
1998 Seskupování intronů skupiny I

DNA topoizomeráza
1998 - DNA topoizomerázas provádět biologicky důležitou a nezbytnou práci při rozmotávání řetězců DNA nebo šroubovic, které se navzájem propletou nebo se příliš pevně zkroutí během normálních buněčných procesů, transkripce genetické informace.
1998 Tubulin alfa / beta dimer
1998 Draselný kanál
1998 Křižovatka Holliday
2000 Ribozom
2000 AAA + ATPáza
2002 Ankyrin opakování
2003 TOP7 proteinový design
2004 Sinice Cirkadiánní hodiny bílkoviny
2004 Riboswitch
2006 Člověk exozom

Receptor spojený s G-proteinem
2007 Receptor spojený s G-proteinem

Částice trezoru
2009 Částice trezoru je zajímavý nový objev velké duté částice běžné v buňkách s několika různými návrhy na její možnou biologickou funkci. Krystalové struktury (soubory PDB 2zuo, 2zv4, 2zv5[29] a 4hl8[30]) ukazují, že každá polovina trezoru je složena z 39 kopií dlouhého proteinu o 12 doménách, které spolu krouží a tvoří obal. Porucha na samém horním a dolním konci naznačuje otvory pro možný přístup do vnitřku trezoru.

Laserová krystalografie s volnými elektrony
2010 - Laser s volnými elektrony krystalografie
Reference
- ^ Richardson JS, Richardson DC (2014). „Biofyzikální vlastnosti z 54 let makromolekulární krystalografie“. Biofyzikální deník. 106 (3): 510–525. doi:10.1016 / j.bpj.2014.01.001. PMC 3945011. PMID 24507592.
- ^ Kendrew JC, Dickerson RE, Strandberg BE, Davies DR, Phillips DC, Shore VC (1960). „Struktura myoglobinu: trojrozměrná Fourierova syntéza při rozlišení 2Å“. Příroda. 185 (4711): 422–427. doi:10.1038 / 185422a0. PMID 18990802.
- ^ Frauenfelder H, McMahon BH, Fenimore PW (2003). „Myoglobin: atom vodíku biologie a paradigma složitosti“. Sborník Národní akademie věd USA. 100 (15): 8615–8617. doi:10.1073 / pnas.1633688100. PMC 166357. PMID 12861080.
- ^ Perutz MF, Rossmann MG, Cullis AF, Muirhead H, North AC (1960). „Struktura hemoglobinu: trojrozměrná Fourierova syntéza při rozlišení 5,5 Á, získaná rentgenovou analýzou“. Příroda. 185 (4711): 416–422. doi:10.1038 / 185416a0. PMID 18990801.
- ^ Perutz MF (1970). "Stereochemistry of Cooperative Effects in Hemoglobin: Haem-Haem Interaction and the Problem of Allostery". Příroda. 228 (5273): 726–734. doi:10.1038 / 228726a0. PMID 5528785.
- ^ A b Edward Tyson Reichert a Amos Peaslee Brown (1909). Diferenciace a specificita odpovídajících proteinů a dalších životně důležitých látek ve vztahu k biologické klasifikaci a organické evoluci: krystalografie hemoglobinů. Washington, DC: Carnegie Institution.
- ^ Bernal JD, Fankuchen I, Perutz M (1938). „Rentgenová syudie chymotrypsinu a hemoglobinu“. Příroda. 141: 523–524. doi:10.1038 / 141523a0.
- ^ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR (1965). „Struktura lysozymu vaječných bílků slepic: trojrozměrná Fourierova syntéza při rozlišení 2Å“. Příroda. 206 (4986): 757–761. doi:10.1038 / 206757a0. PMID 5891407.
- ^ Warshel A, Levitt M (1976). „Teoretické studie enzymatických reakcí: Dielektrická, elektrostatická a sterická stabilizace uhlíkového iontu při reakci lysozymu“. J Mol Biol. 103 (2): 227–49. doi:10.1016/0022-2836(76)90311-9. PMID 985660.
- ^ Diamond R (1974). „Zdokonalení struktury lysozymu vaječných bílků v reálném prostoru“. Journal of Molecular Biology. 82 (3): 371–374. doi:10.1016/0022-2836(74)90598-1.
- ^ Boutet S, Lomb L, Williams GJ a kol. (2012). „Stanovení proteinové struktury s vysokým rozlišením sériovou femtosekundovou krystalografií“ (PDF). Věda. 337 (6092): 362–364. doi:10.1126 / science.1217737.
- ^ Shi D, Nannenga BL, Iadenza MG, Gonen T (2013). „Trojrozměrná elektronová krystalografie proteinových mikrokrystalů“. eLife. 2: e01345. doi:10,7554 / elife.01345. PMC 3831942. PMID 24252878.
- ^ Kartha G, Bello J, Harker D (1967). "Terciární struktura ribonukleázy". Příroda. 213 (5079): 862–865. doi:10.1038 / 213862a0. PMID 6043657.
- ^ Wyckoff HW, Hardman KD, Allewell NM, Inagami T, Johnson LN, Richards FM (1967). "Struktura ribonukleázy-S při rozlišení 3,5 Å". Journal of Biological Chemistry. 242: 3984–3988.
- ^ Doscher MS, Richards FM (1963). "Aktivita enzymu v krystalickém stavu: Ribonukleáza-S". Journal of Biological Chemistry. 238: 2399–2406.
- ^ Dickerson RE, Geis I (1969). Struktura a působení proteinů. New York: Harper.
- ^ Matthews BW, Sigler PB, Henderson R, Blow DM (1967). "Trojrozměrná struktura tosyl-α-chymotrypsinu". Příroda. 214 (5089): 652–656. doi:10.1038 / 214652a0. PMID 6049071.
- ^ Freer ST, Kraut J, Robertus JD, Tonle H, Wright HT (1970). „Chymotrypsinogen: krystalová struktura 2,5 Å, srovnání s α-chymotrypsinem a důsledky pro aktivaci zymogenu“. Biochemie. 9 (9): 1997–2009. doi:10.1021 / bi00811a022. PMID 5442169.
- ^ Fehlhammer H, Bode W (1975). „Rafinovaná krystalová struktura hovězího beta-trypsinu v rozlišení 1,8 Á, II. Krystalografická rafinace, vazebné místo pro vápník a aktivní místo při pH 7,0“. Journal of Molecular Biology. 98: 693–697. doi:10.1016 / s0022-2836 (75) 80005-2.
- ^ Sawyer L, Shotton DM, Campbell JW, Ladner RC (1978). „Atomová struktura krystalické prasečí pankreatické elastázy při rozlišení 2,5 Á: srovnání se strukturou alfa-chymotrypsinu“. Journal of Molecular Biology. 118: 137–208. doi:10.1016/0022-2836(78)90412-6. PMID 628010.
- ^ Lipscomb WN; Hartsuck JA; Reeke GN; Quiocho FA; Bethge PH; Ludwif = g ML; Steitz TA; Muirhead H; Coppola JC (1969). "Struktura karboxypeptidázy A, VII. 2,0-Á rozlišení studie enzymu a jeho komplexu s glycyltyrosinem a mechanické odhady." Brookhaven Symposia in Biology. 21 (1): 24–90. PMID 5719196.
- ^ Rees DC, Lipscomb WN (1982). "Rafinovaná krystalová struktura komplexu bramborových inhibitorů karboxypeptidázy A při rozlišení 2,5 A". Journal of Molecular Biology. 160 (3): 475–498. doi:10.1016/0022-2836(82)90309-6. PMID 7154070.
- ^ Alden RA, Birktoft JJ, Kraut J, Robertus JD, Wright CS (1971). Msgstr "Atomové souřadnice pro subtilisin BPN '(nebo novo)". Biochem Biophys Res Commun. 45: 337–44.
- ^ Wells J, Estell D (1988). "Subtilisin - enzym navržený k inženýrství". Trends Biochem Sci. 13: 291–297. doi:10.1016/0968-0004(88)90121-1.
- ^ Huber R, Kukla D, Ruhmann A, Epp O, Formanek H (1970). "Základní inhibitor trypsinu u hovězí slinivky břišní. I. Strukturní analýza a konformace polypeptidového řetězce". Naturwissenschaften. 57 (5304): 389–392. doi:10.1038 / 231506a0. PMID 4932997.
- ^ Herriott JR, Sieker LC, Jensen LH, Lovenberg W (1970). „Struktura rubredoxinu: rentgenová studie s rozlišením 2,5 Á“. Journal of Molecular Biology. 50: 391–402. doi:10.1016/0022-2836(70)90200-7.
- ^ Watenpaugh KD, Sieker LC, Jensen LH (1980). "Krystalografická rafinace rubredoxinu v rozlišení 1,2Å". Journal of Molecular Biology. 138: 615–633. doi:10.1016 / s0022-2836 (80) 80020-9.
- ^ Blundell TL, Cutfield JF, Cutfield SM, Dodson EJ, Dodson GG, Hodgkin DC, Mercola DA, Vijayan M (1971). "Atomové pozice v romboedrickém 2-zinkovém krystalu inzulínu". Příroda. 231 (5304): 506–511. doi:10.1038 / 231506a0. PMID 4932997.
- ^ Tanaka H, Kato K, Yamashita E, Sumizawa T, Zhou Y, Yau M, Iwasaki K, Yoshimura M, Tsukihara T (2009). "Struktura krysí jaterní klenby při rozlišení 3,5 Angstromu". Věda. 323 (5912): 384–388. doi:10.1126 / science.1164975. PMID 19150846.
- ^ Casanas A, Querol-Audi J, Guerra P, Pous J, Tanaka H, Tsukihara T, Verdaguer N, Fita I (2013). „Nové funkce architektury úložiště a dynamiky odhalené novým zdokonalením pomocí přístupu deformovatelné elastické sítě“ (PDF). Acta Crystallographica. D69 (Pt 6): 1054–1061. doi:10.1107 / S0907444913004472. PMID 23695250.
