Kobaltocen - Cobaltocene
| |||
| Jména | |||
|---|---|---|---|
| Názvy IUPAC Kobaltocen Bis (η5-cyklopentadienyl) kobalt | |||
| Ostatní jména Str2Spol | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.013.692 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| [Co (η5-C5H5)2] | |||
| Molární hmotnost | 189,12 g / mol | ||
| Vzhled | Tmavě fialová pevná látka | ||
| Bod tání | 171–173 ° C (340–343 ° F; 444–446 K) | ||
| Nerozpustný | |||
| Struktura | |||
| sendvič | |||
| nula | |||
| Termochemie | |||
Std molární entropie (S | 236 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | +237 kJ / mol (nejistý) | ||
Std entalpie of spalování (ΔCH⦵298) | -5839 kJ / mol | ||
| Nebezpečí | |||
| Bezpečnostní list | Externí BL | ||
| Piktogramy GHS |   [1] [1] | ||
| Signální slovo GHS | Nebezpečí[1] | ||
| H228, H317, H351[1] | |||
| P210, P261, P280, P363, P405, P501[1] | |||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Příbuzný metaloceny | Ferrocen Nikelocen Rhodocen | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kobaltocen, známý také jako bis (cyklopentadienyl) kobalt (II) nebo dokonce „bis Cp kobalt“, je organokobaltová sloučenina se vzorcem Co (C5H5)2. Je to tmavě fialová pevná látka, která sublimuje snadno mírně nad pokojovou teplotou. Kobaltocen byl objeven krátce poté ferrocen, první metalocen. Vzhledem ke snadnosti reakce s kyslíkem je nutné se sloučeninou zacházet a skladovat ji bezvzduchové techniky.
Syntéza

Kobaltocen se připravuje reakcí cyklopentadienid sodný (NaC5H5) s bezvodým chlorid kobaltnatý v THF řešení. Chlorid sodný kogeneruje a organokovový produkt je obvykle čištěn pomocí vakuová sublimace.[2]
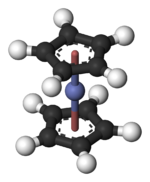
Struktura a lepení
V Co (C.5H5)2 centrum Co je „vloženo“ mezi dva cyklopentadienyl (Cp) kroužky. Délky vazby Co – C jsou asi 2,1 Å, o něco delší než vazby Fe – C ve ferrocenu.[3]
Co (C.5H5)2 patří do skupiny organokovových sloučenin zvaných metaloceny nebo sendvičové sloučeniny.[4] Kobaltocen má 19 valenčních elektronů, jeden více, než se obvykle nachází v komplexech organo-přechodných kovů, jako je jeho velmi stabilní relativní ferrocen. (Vidět 18-elektronové pravidlo.) Tento další elektron zaujímá oběžnou dráhu, která je antibondingová vzhledem k vazbám Co-C. Následkem toho jsou vzdálenosti Co – C o něco delší než vazby Fe – C ve ferrocenu. Mnoho chemických reakcí Co (C.5H5)2 jsou charakterizovány jeho tendencí ztrácet tento „extra“ elektron za vzniku 18-elektronového kationtu známého jako kobalcenium:
Jinak blízký příbuzný kobaltocenu, rhodocen neexistuje jako monomer, ale spontánně dimerizuje vytvořením vazby C-C mezi Cp kruhy.
Reakce
Redoxní vlastnosti
Co (C.5H5)2 je v laboratoři běžným jednoelektronovým redukčním činidlem.[5] Ve skutečnosti je reverzibilita Co (C.5H5)2 redox pár je tak vychovaný, že Co (C.5H5)2 lze použít v cyklická voltametrie jako vnitřní standard. Jeho permethylovaný analog dekametylkobtocen (Co (C.5Mě5)2) je obzvláště silné redukční činidlo v důsledku indukčního darování elektronové hustoty z 10 methylových skupin, což kobalt nutí ještě více se vzdát svého „extra“ elektronu. Tyto dvě sloučeniny jsou vzácnými příklady reduktantů, které se rozpouštějí v nepolárních organických rozpouštědlech. The redukční potenciály z těchto sloučenin následuje pomocí ferrocenferrocenium pár jako reference:
| Poloviční reakce | E0 (PROTI) |
|---|---|
| Fe (C. 5H 5)+ 2 + e− ⇌ Fe (C.5H5)2 | 0,00 (podle definice) |
| Fe (C. 5Mě 5)+ 2 + e− ⇌ Fe (C.5Mě5)2 | −0.59 |
| Co (C. 5H 5)+ 2 + e− ⇌ Co (C.5H5)2 | −1.33 |
| Co (C. 5Mě 5)+ 2 + e− ⇌ Co (C.5Mě5)2 | −1.94 |
Data ukazují, že dekamethylové sloučeniny jsou přibližně o 600 mV redukčnější než mateřské metaloceny. Tento substituční účinek je však zastíněn vlivem kovu: změna z Fe na Co činí redukci příznivější o více než 1,3 voltu.
Karbonylace
Léčba Co (C.5H5)2 s kysličník uhelnatý dává derivát kobaltu (I) Co (C.5H5) (CO)2, současně se ztrátou jednoho ligandu Cp. Tato přeměna se provádí blízko 130 ° C s 500 psi CO.[2][6]
Viz také
Reference
- ^ A b C d „Bis (cyklopentadienyl) kobalt (II)“. Americké prvky. Citováno 2018-08-24.
- ^ A b King, R. B. (1965). Organokovové syntézy. 1. New York, NY: Academic Press.
- ^ Antipin, M. Yu .; Boese, R .; Augart, N .; Schmid, G. (1993). „Nové určení krystalové struktury kobaltocenu při 100 K a 297 K: Srovnání s ferrocenem a nikelocenem“. Struct. Chem. 4 (2): 91–101. doi:10.1007 / BF00677370.
- ^ Elschenbroich, C .; Salzer, A. (1992). Organometallics: Stručný úvod (2. vyd.). Weinheim: Wiley-VCH. ISBN 978-3-527-28165-7.
- ^ Connelly, N. G .; Geiger, W. E. (1996). "Chemické redoxní látky pro organokovovou chemii". Chem. Rev. 96 (2): 877–910. doi:10.1021 / cr940053x. PMID 11848774.
- ^ King, R. B .; Stone, F. G. A. (1967). "Cyklopentadienyl Metalkarbonyly a některé deriváty". Anorganické syntézy. 7: 99–115. doi:10.1002 / 9780470132388.ch31. ISBN 9780470132388.