HBx - HBx
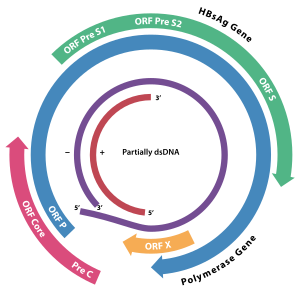
HBx je žloutenka typu B virový protein.[1][2] Je to 154 aminokyseliny dlouhý a interferuje s transkripcí, signální transdukcí, buněčný cyklus pokrok, degradace bílkovin, apoptóza a chromozomální stabilita v hostiteli. Tvoří heterodimerní komplex se svým buněčným cílovým proteinem (HBX interagující protein: HBXIP ), a tato interakce dysregulates centrosome dynamika a mitotické vřeteno formace.[3] Interaguje s DDB1 (Poškozený protein vázající DNA 1) přesměrující ubikvitin ligáza činnost CUL4 -DDB1 E3 komplexy, které se úzce účastní intracelulární regulace DNA replikace a opravy, transkripce a přenos signálu.[4]
Ačkoli protein X normálně chybí v Avihepadnavirus byla v genomu viru kachní hepatitidy identifikována pozůstatková verze.[5]
Ačkoli postrádá významnou sekvenční identitu s jakýmikoli bílkovinami obratlovců, zdá se pravděpodobné, že se vyvinul z a DNA glykosyláza.[6]
U transgenních myší exprimujících X protein v játrech je pravděpodobnější vývoj hepatocelulárního karcinomu než u divokého typu. Je to proto, že protein X podporuje progresi buněčného cyklu, zatímco se váže na a potlačuje tumor supresorový protein p53 ve výkonu své role. Experimentální pozorování také naznačují, že se zvyšuje protein HBx TERT a telomeráza aktivita, prodlužuje životnost hepatocytů a přispívá k maligní transformaci.[7]
Molekulární účinky HBx
HBx způsobuje mnoho buněčných změn. Tyto změny jsou způsobeny přímými akcemi HBx a nepřímými akcemi kvůli velkým nárůstům intracelulární reaktivní formy kyslíku (ROS) částečně indukovaný HBx. Zdá se, že HBx dysreguluje řadu buněčných cest. HBx způsobuje dysregulaci vazbou na genomovou DNA, změnou expresních vzorců miRNA, ovlivněním histonmethyltransferáz, vazbou na SIRT1 protein aktivovat transkripci a ve spolupráci s histon methylázami a demethylázami změnit vzory buněčné exprese.[8]
HBx je částečně zodpovědný za přibližně 10 000násobné zvýšení intracelulárního ROS po chronické infekci HBV.[9][10] HBx se může lokalizovat do mitochondrií, kde HBx snižuje potenciál mitochondriální membrány a způsobuje zvýšené uvolňování ROS.[11] Kromě toho, další proteiny HBV, HBsAg[11] a HBcAg,[10] také zvýšit ROS prostřednictvím interakcí s endoplazmatické retikulum. ROS způsobují více než 20 typů poškození DNA.[12] Oxidační poškození DNA je mutagenní.[13]
HBx má velké účinky na úrovně transkripce mnoha genů. V modelu transgenních myší exprimujících gen HBx viru hepatitidy B (ale ne jiné geny HBV) se u většiny myší vyvinuly jaterní nádory.[14] U těchto HBx transgenních myší bylo 10 553 rozdílně DNA methylovaná oblasti (6 668 hypermethylovaných a 3 885 hypomethylovaných oblastí). V savčích buňkách jsou velké shluky CpG dinukleotidů známé jako CpG ostrovy (CGI) působí jako klíč epigenetický prvky regulující genovou expresi. Hyper-methylace CGI v promotorech může umlčet geny, zatímco hypo-methylace CGI v distálních exony genů může také potlačovat transkripci genů.[14] Velká část změn methylace u HBx transgenních myší byla na CGI. HBx zvláště vyvolala hypo-methylaci distálních intragenních CGI požadovaných pro aktivní expresi. Bylo 647 genů obsahujících intragenní CGI, které byly hypo-methylovány v HBx transgenních myších játrech.[14]
HBx také přímo interaguje s mnoha geny. Zdá se, že několik tisíc genů kódujících proteiny má vazebná místa pro HBx.[8][15] Kromě vazby na geny kódující proteiny se HBx váže na promotory ovládající 15 mikroRNA a 16 Dlouhé nekódující RNA.[15] U 15 miRNA s promotory vázanými na HBx se hladiny exprese zvýšily u osmi, poklesly u 5 a u dvou se významně nezměnily. Každá mikroRNA se změněnou úrovní exprese může ovlivnit expresi několika stovek messengerových RNA (viz mikroRNA ).
Kromě svých účinků na hladiny transkripce hostitelských genů HBx švy ovlivňují in vivo syntézu pgRNA v buňkách replikujících se HBV. Jako HBx se rekrutuje cccDNA, snižuje hladinu acetylace histonu snížením náboru p300 acetylázy a zvyšování náboru hSirtl a HDAC1 deacetylázy.[16] To zase snižuje heterochromatinizaci HBV minichromozomu a zvyšuje produkci pgRNA. V buňkách infikovaných mutanty s defektem HBx zůstávají hladiny cccDNA beze změny, zatímco dochází ke snížení transkripce pgRNA. Zavedení jaderně lokalizovaných proteinových švů HBx k obnovení replikace viru do buněk infikovaných virem s deficitem HBx.[17]
Vztah k PRMT1
Ve studii čištění rakovinných jaterních buněk infikovaných HBV byla hladina výraz bílkoviny arginin methyltransferázy 1 (PRMT1 ) bylo zjištěno, že je spojena se změnami transkripce v důsledku methyltransferáza funkce PRMT1. Nadměrná exprese způsobuje snížení počtu transkribovaných genů HBV, zatímco naopak podexprese způsobuje zvýšení. Bylo také zjištěno, že PRMT1 je získáván HBV DNA během replikačního procesu, aby reguloval transkripční proces. Zvýšená exprese HBx zase vede k inhibici proteinu zprostředkovaného PRMT1 methylace, prospívající virové replikaci.[18]
Reference
- ^ McClain SL, Clippinger AJ, Lizzano R, Bouchard MJ (listopad 2007). „Replikace viru hepatitidy B je spojena se zvýšením hladin cytosolického vápníku závislým na mitochondriích závislým na HBx“. Journal of Virology. 81 (21): 12061–5. doi:10.1128 / JVI.00740-07. PMC 2168786. PMID 17699583.
- ^ Bouchard MJ, Puro RJ, Wang L, Schneider RJ (červenec 2003). „Aktivace a inhibice buněčných signálních drah vápníku a tyrosinkinázy identifikuje cíle proteinu HBx podílejícího se na replikaci viru hepatitidy B“. Journal of Virology. 77 (14): 7713–9. doi:10.1128 / JVI.77.14.7713-7719.2003. PMC 161925. PMID 12829810.
- ^ Wen Y, Golubkov VS, Strongin AY, Jiang W, Reed JC (únor 2008). „Interakce virového onkoproteinu hepatitidy B s buněčným cílem HBXIP dysreguloval dynamiku centrozomu a tvorbu mitotického vřetene“. The Journal of Biological Chemistry. 283 (5): 2793–803. doi:10,1074 / jbc.M708419200. PMID 18032378.
- ^ Li T, Robert EI, van Breugel PC, Strubin M, Zheng N (leden 2010). „Promiskuitní alfa-šroubovicový motiv ukotví virové únosce a receptory substrátu na strojní zařízení pro ubikvitin ligázu CUL4-DDB1“. Přírodní strukturní a molekulární biologie. 17 (1): 105–11. doi:10.1038 / nsmb.1719. PMC 2823288. PMID 19966799.
- ^ Lin B, Anderson DA (2000). „Zbytkový X otevřený čtecí rámec u kachního viru hepatitidy B“. Intervirologie. 43 (3): 185–90. doi:10.1159/000025037. PMID 11044813.
- ^ van Hemert FJ, van de Klundert MA, Lukashov VV, Kootstra NA, Berkhout B, Zaaijer HL (2011). „Protein X viru hepatitidy B: podobnost původu a struktury s centrální doménou DNA glykosylázy“. PLOS ONE. 6 (8): e23392. Bibcode:2011PLoSO ... 623392V. doi:10.1371 / journal.pone.0023392. PMC 3153941. PMID 21850270.
- ^ Kew MC (leden 2011). „Virus hepatitidy B x protein v patogenezi hepatocelulárního karcinomu vyvolaného virem hepatitidy B“. Journal of Gastroenterology and Hepatology. 26 Suppl 1 (Suppl 1): 144–52. doi:10.1111 / j.1440-1746.2010.06546.x. PMID 21199526.
- ^ A b Balakrishnan L, Milavetz B (listopad 2017). „Epigenetická regulace virových biologických procesů“. Viry. 9 (11): 346. doi:10,3390 / v9110346. PMC 5707553. PMID 29149060.
- ^ Valgimigli M, Valgimigli L, Trerè D, Gaiani S, Pedulli GF, Gramantieri L, Bolondi L (září 2002). "Měření oxidačního stresu EPR v lidských játrech metodou radikální sondy. Korelace s etiologií, histologií a buněčnou proliferací". Volný radikální výzkum. 36 (9): 939–48. doi:10.1080/107156021000006653. PMID 12448819.
- ^ A b Ivanov AV, Valuev-Elliston VT, Tyurina DA, Ivanova ON, Kochetkov SN, Bartosch B, Isaguliants MG (leden 2017). „Oxidační stres, spouštěč karcinogeneze jater vyvolané virem hepatitidy C a B“. Cílový cíl. 8 (3): 3895–3932. doi:10.18632 / oncotarget.13904. PMC 5354803. PMID 27965466.
- ^ A b Higgs MR, Chouteau P, Lerat H (květen 2014). "'Játra nechají zemřít: oxidační poškození DNA a hepatotropní viry “ (PDF). The Journal of General Virology. 95 (Pt 5): 991–1004. doi:10.1099 / vir.0.059485-0. PMID 24496828.
- ^ Yu Y, Cui Y, Niedernhofer LJ, Wang Y (prosinec 2016). „Výskyt, biologické důsledky a význam poškození zdraví DNA oxidačním stresem pro lidské zdraví“. Chemický výzkum v toxikologii. 29 (12): 2008–2039. doi:10.1021 / acs.chemrestox.6b00265. PMC 5614522. PMID 27989142.
- ^ Dizdaroglu M (prosinec 2012). "Oxidačně indukované poškození DNA: mechanismy, oprava a nemoc". Dopisy o rakovině. 327 (1–2): 26–47. doi:10.1016 / j.canlet.2012.01.016. PMID 22293091.
- ^ A b C Lee SM, Lee YG, Bae JB, Choi JK, Tayama C, Hata K a kol. (Červenec 2014). „HBx indukuje hypomethylaci distálních intragenních CpG ostrovů potřebných pro aktivní expresi vývojových regulátorů“. Sborník Národní akademie věd Spojených států amerických. 111 (26): 9555–60. Bibcode:2014PNAS..111,9555L. doi:10.1073 / pnas.1400604111. PMC 4084425. PMID 24941955.
- ^ A b Guerrieri F, Belloni L, D'Andrea D, Pediconi N, Le Pera L, Testoni B a kol. (Únor 2017). „Identifikace přímých genomových cílů HBx v celém genomu“. BMC Genomics. 18 (1): 184. doi:10.1186 / s12864-017-3561-5. PMC 5316204. PMID 28212627.
- ^ Belloni L, Pollicino T, De Nicola F, Guerrieri F, Raffa G, Fanciulli M a kol. (Listopad 2009). „Nukleární HBx váže minichromozom HBV a modifikuje epigenetickou regulaci funkce cccDNA“. Sborník Národní akademie věd Spojených států amerických. 106 (47): 19975–9. Bibcode:2009PNAS..10619975B. doi:10.1073 / pnas.0908365106. PMC 2775998. PMID 19906987.
- ^ Keasler VV, Hodgson AJ, Madden CR, Slagle BL (červenec 2009). „Protein HBx viru hepatitidy B lokalizovaný v jádru obnovuje replikaci viru s deficitem HBx v buňkách HepG2 a in vivo u myší s hydrodynamickou injekcí“. Virologie. 390 (1): 122–9. doi:10.1016 / j.virol.2009.05.001. PMC 2749295. PMID 19464721.
- ^ Benhenda S, Ducroux A, Rivière L, Sobhian B, Ward MD, Dion S a kol. (Duben 2013). „Methyltransferáza PRMT1 je vazebným partnerem HBx a negativním regulátorem transkripce viru hepatitidy B“. Journal of Virology. 87 (8): 4360–71. doi:10.1128 / JVI.02574-12. PMC 3624337. PMID 23388725.
