Transgenerační epigenetická dědičnost - Transgenerational epigenetic inheritance
Tento článek musí být aktualizováno. (Březen 2020) |

Transgenerační epigenetická dědičnost, (TEI), je přenos epigenetických markerů z jednoho organismu do druhého (tj. přenos z rodiče na dítě), který ovlivňuje rysy potomků bez změny primární struktura z DNA (tj. sekvence nukleotidů)[2]:168[3]-jinými slovy, epigeneticky. Méně přesný termín "epigenetická dědičnost" může zahrnovat přenos informací buňka-buňka i organismus-organismus. Ačkoli jsou tyto dvě úrovně epigenetické dědičnosti ekvivalentní jednobuněčné organismy, mohou mít odlišné mechanismy a evoluční rozdíly v mnohobuněčné organismy.
Faktory prostředí mohou u některých epigeneticky ovlivněných znaků vyvolat epigenetické značky (epigenetické značky),[2] zatímco některé známky jsou dědičné,[2] což vedlo některé k tomu, aby přehodnotili předchozí odmítnutí většiny biologů z dědičnost získaných vlastností (lamarckismus) .[3]
Epigenetické kategorie
Jsou známy čtyři obecné kategorie epigenetické modifikace:[4]
- soběstačné metabolické smyčky, ve kterých a mRNA nebo protein stimuluje produkt genu transkripce genu; např. Wor1 gen v Candida albicans[5]
- strukturální šablony, ve kterých jsou struktury replikovány pomocí šablony nebo struktury lešení na nadřazené; např. orientace a architektura cytoskeletálních struktur, řasinek a bičíků,[6] priony, proteiny, které se replikují změnou struktury normálních proteinů tak, aby odpovídaly jejich vlastním[7]
- chromatin značky, ve kterých se methylové nebo acetylové skupiny vážou na DNA nukleotidy nebo histony čímž se mění vzorce genové exprese; např. Lcyc gen v Linaria vulgaris popsané níže
- Umlčení RNA, ve kterém interferují malé řetězce RNA (RNAi ) s transkripcí DNA nebo translací mRNA; známé pouze z několika studií, většinou v Caenorhabditis elegans[8]
Dědičnost epigenetických znaků
Ačkoli existují různé formy dědičných epigenetických markerů, lze dědičnost epigenetických markerů shrnout jako šíření epigenetických informací pomocí zárodečné linie.[9] Kromě toho má epigenetická variace obvykle jednu ze čtyř obecných forem, ačkoli existují ještě další formy, které je třeba ještě objasnit. V současné době samonosné zpětnovazební smyčky, prostorové šablonování, značení chromatinu a dráhy zprostředkované RNA modifikují epigeny jednotlivých buněk. Epigenetická variace v mnohobuněčných organismech je buď endogenní nebo exogenní. Endogenní je generován buněčnou signalizací (např. Během buněčné diferenciace v rané fázi vývoje), zatímco exogenní je buněčnou odpovědí na podněty prostředí.
Odstranění vs. zadržení
U pohlavně se množících organismů se většina epigenetických modifikací v buňkách resetuje během meiózy (např. Stopy na lokusu FLC kontrolujícím vernalizaci rostlin[10]), i když se ukázalo, že některé epigenetické reakce jsou zachovány (např. metylace transposonu v rostlinách)[10]). Diferenciální dědičnost epigenetických znaků v důsledku základních předsudků matky nebo otce v mechanismech odstraňování nebo zadržování může vést k přiřazení epigenetické příčinné souvislosti některým účinkům rodičů původu u zvířat[11] a rostliny.[12]
Přeprogramování
U savců jsou epigenetické stopy vymazány během dvou fází životního cyklu. Za prvé těsně po oplodnění a za druhé, ve vyvíjejících se prvotních zárodečných buňkách, předchůdcích budoucích gamet.[2] Během oplodnění se mužské a ženské gamety spojují v různých stavech buněčného cyklu a s různou konfigurací genomu. Epigenetické stopy mužského pohlaví se rychle zředí. Nejprve jsou protaminy spojené s mužskou DNA nahrazeny histony ze samice cytoplazma, z nichž většina je acetylována buď kvůli většímu množství acetylovaných histonů v cytoplazmě ženy, nebo prostřednictvím preferenčního vázání mužské DNA na acetylované histony.[13][14] Zadruhé, mužská DNA je v mnoha organismech systematicky demetylovaná,[15][16] možná prostřednictvím 5-hydroxymethylcytosin. Tomuto přeprogramování však mohou uniknout některé epigenetické znaky, zejména methylace mateřské DNA; což vede k otiskům rodičů.
V pravěku zárodečné buňky (PGC) dochází k rozsáhlejšímu mazání epigenetických informací. Některá vzácná místa se však také mohou vyhnout vymazání metylace DNA.[17] Pokud se epigenetické značky vyhnou vymazání během událostí přeprogramování zygotických i PGC, mohlo by to umožnit transgenerační epigenetickou dědičnost.
Uznání důležitosti epigenetického programování pro stanovení a fixaci identity buněčné linie během rané embryogeneze v poslední době stimulovalo zájem o umělé odstranění epigenetického programování.[18] Epigenetické manipulace mohou umožnit obnovení totipotence v kmenové buňky nebo buňky obecněji, tedy zobecňující regenerativní medicína.
Zadržení
Buněčné mechanismy mohou umožňovat společný přenos některých epigenetických znaků. Během replikace jsou DNA polymerázy pracující na předních a zaostávajících řetězcích spojeny s faktorem DNA procesu proliferující buněčný jaderný antigen (PCNA), který se také podílí na vzorování a přeslechu řetězců, který umožňuje kopírovat věrnost epigenetických značek.[19][20] Práce na věrnosti kopií modifikace histonů zůstala ve fázi modelu, ale časná úsilí naznačují, že modifikace nových histonů jsou vytvořeny podle vzorců starých histonů a že nové a staré histony se náhodně třídí mezi dvěma dceřinými řetězci DNA.[21] Pokud jde o přechod na další generaci, mnoho značek je odstraněno, jak je popsáno výše. Nové studie hledají vzorce epigenetické ochrany napříč generacemi. Například, centromerický satelity odolávají demetylaci.[22] Mechanismus zodpovědný za tuto ochranu není znám, i když některé důkazy naznačují, že methylace histonů může přispět.[22][23] Byla také identifikována dysregulace načasování metylace promotoru spojená s dysregulací genové exprese v embryu.[24]
Rozklad
Vzhledem k tomu, že rychlost mutace v daném 100bázovém genu může být 10−7 za generaci mohou epigeny několikrát „mutovat“ za generaci nebo mohou být fixovány po mnoho generací.[25] To vyvolává otázku: tvoří změny ve frekvencích epigenu evoluci? Rychle se rozpadající epigenetické účinky na fenotypy (tj. Trvající méně než tři generace) mohou vysvětlit některé zbytkové variace fenotypů po zohlednění genotypu a prostředí. Avšak rozlišování těchto krátkodobých účinků od účinků mateřského prostředí na časné ontogeneze zůstává výzvou.
Příspěvek k fenotypům
Relativní význam genetického a epigenetického dědictví je předmětem debaty.[26][27] Ačkoli byly publikovány stovky příkladů epigenetické modifikace fenotypů,[28][29] několik studií bylo provedeno mimo laboratorní prostředí.[30] Interakce genů a epigenů s prostředím proto nelze odvodit navzdory ústřední roli prostředí v přirozeném výběru. Experimentální metodiky manipulace s epigenetickými mechanismy jsou rodící se (např.[31]) a bude nutné důkladně demonstrovat, než budou studie výslovně testující relativní příspěvky genotypu, prostředí a epigenotypu proveditelné.
V rostlinách

Studie týkající se transgenerační epigenetické dědičnosti v rostlinách byly hlášeny již v 50. letech.[32] Jedním z prvních a nejlépe charakterizovaných příkladů je b1 paramutace v kukuřici.[32][33][34][35][36][37][38][39] Gen b1 kóduje a základní šroubovice-smyčka-šroubovice transkripční faktor který je zapojen do antokyan výrobní cesta. Když je exprimován gen b1, rostlina hromadí antokyan ve svých tkáních, což vede k fialovému zabarvení těchto tkání. Alela B-I (pro B-Intense) má vysokou expresi b1, což vede k tmavé pigmentaci tkání pláště a slupky, zatímco alela B '(výrazná B-prime) má nízkou expresi b1, což vede k nízké pigmentaci v těchto tkáních.[40] Když homozygotní B-I rodiče jsou zkříženi na homozygotní B ', výslednice F1 potomci všechny vykazují nízkou pigmentaci, která je způsobena umlčení genů z b1.[32][40] Neočekávaně, když se rostliny F1 samy kříží, výsledná generace F2 vykazuje nízkou pigmentaci a nízkou hladinu exprese b1. Dále, když je jakákoli rostlina F2 (včetně těch, které jsou geneticky homozygotní pro B-I) křížena s homozygotní B-I, potomci budou všichni vykazovat nízkou pigmentaci a expresi bl.[32][40] Příkladem je nedostatek tmavě pigmentovaných jedinců v potomstvu F2 nemendelovské dědictví a další výzkumy naznačují, že alela B-I je konvertována na B 'pomocí epigenetických mechanismů.[34][35] Alely B 'a B-I jsou považovány za epialleles protože jsou identické na úrovni sekvence DNA, ale liší se na úrovni Methylace DNA, siRNA produkce a chromozomální interakce uvnitř jádra.[38][41][37][36] Rostliny vadné v součástech RNA-řízená DNA-methylační cesta vykazují zvýšenou expresi b1 u B 'jedinců podobnou jako u B-I, avšak jakmile jsou tyto komponenty obnoveny, rostlina se vrátí do stavu nízké exprese.[39][42][43][44] I když byla pozorována spontánní přeměna z B-I na B ', reverze z B' na B-I (zelená na fialovou) nebyla nikdy pozorována po dobu 50 let a tisíce rostlin ve skleníkových i polních experimentech.[45]
Byly také popsány příklady environmentálně indukované transgenerační epigenetické dědičnosti v rostlinách.[46][47][48] V jednom případě rostliny rýže, které byly vystaveny ošetření simulací sucha, vykazovaly zvýšenou toleranci vůči suchu po 11 generacích expozice a množení pomocí jediného semene ve srovnání s rostlinami neošetřenými suchem.[46] Rozdíly v tolerance vůči suchu byl spojen se směrovými změnami v úrovních methylace DNA v celém genomu, což naznačuje, že dědičné změny ve vzorcích DNA-methylace vyvolané stresem mohou být důležité při adaptaci na opakující se stresy.[46] V jiné studii rostliny, které byly po několik generací vystaveny mírnému býložravci housenky, vykazovaly zvýšenou odolnost vůči býložravcům v následujících generacích (měřeno suchou hmotou housenky) ve srovnání s rostlinami bez tlaku býložravců.[47] Toto zvýšení odolnosti vůči býložravcům přetrvávalo po generaci růstu bez jakékoli expozice býložravcům, což naznačuje, že reakce byla přenášena napříč generacemi.[47] Zpráva dospěla k závěru, že složky dráhy DNA-methylace řízené RNA se podílejí na zvýšené rezistenci napříč generacemi.[47]
U lidí
I když je genetická dědičnost při popisu důležitá fenotypový výsledky nelze zcela vysvětlit, proč se potomci podobají svým rodičům. Kromě genů zdědili potomci podobné kulturní a environmentální faktory stanovené předchozími generacemi.[9] Je nutné vzít v úvahu jak kulturní, tak environmentální faktory, protože každý z těchto faktorů může ovlivnit druhý (tj. Kulturní normy mohou ovlivnit podmínky prostředí a podmínky prostředí mohou ovlivnit kulturní normy) a mohou následně ovlivnit zdraví následujících generací.[9] Jedno prostředí, které všichni lidští potomci běžně sdílejí po dobu devíti měsíců, je jejich matka lůno. S ohledem na dobu trvání fetální stadia vývoje, prostředí matčiny lůna může mít dlouhodobé účinky na zdraví potomků.[9] Příklad toho, jak může prostředí v děloze ovlivnit zdraví potomků, lze vysvětlit zvážením důsledků nizozemské hladové zimy a rolí vyvolaných transgeneračních epigenetických dědičných nemocí.[9] Řada studií naznačuje existenci transgenerační epigenetické dědičnosti u lidí,[2] který zahrnuje nizozemský hladomor v letech 1944–45. Během nizozemské hladové zimy byli potomci narozeni během hladomoru menší než ti, kteří se narodili rok před hladomorem, a účinky mohly trvat až dvě generace. Navíc bylo zjištěno, že u těchto potomků existuje zvýšené riziko intolerance glukózy v dospělosti.[49] Diferenciální methylace DNA byla nalezena u dospělých samic potomků, kteří byli vystaveni hladomoru in utero, ale není známo, zda jsou tyto rozdíly přítomny v jejich zárodečné linii.[49] Předpokládá se, že inhibuje PIM3 gen mohl v pozdějších generacích způsobit pomalejší metabolismus, ale příčinná souvislost nebyla prokázána, pouze korelace.[50] Tento jev se někdy označuje jako Holandský zimní syndrom hladu. Navíc zvýšené sazby metabolické nemoci, kardiovaskulární choroby a další zvýšené rizikové faktory pro zdraví generací F1 a F2 během nizozemské hladové zimy je známý jev zvaný „fetální programování „, Což je způsobeno expozicí škodlivým faktorům prostředí v děloze.[9] Další studie předpokládá epigenetické změny na Y chromozom vysvětlit rozdíly v délce života mezi mužskými potomky váleční zajatci v americká občanská válka.[51]
The Studie Överkalix zaznamenané účinky specifické pro pohlaví; větší index tělesné hmotnosti (BMI) v 9 letech u synů, ale ne dcer, otců, kteří začali kouřit brzy. Zásobování potravinami dědečka z otcovy strany souviselo pouze s RR úmrtí vnuků a nikoli vnuček. Zásobování potravinami babičky z otcovy strany bylo spojeno pouze s poměrem rizika úmrtí vnuček. Když měla babička dobrý přísun potravy, byla spojena s dvojnásobně vyšší úmrtností (RR). Tato transgenerační dědičnost byla pozorována při expozici během období pomalého růstu (SGP). SGP je čas před začátkem puberta, kdy faktory prostředí mají větší dopad na tělo. SGP předků v této studii byl stanoven ve věku 9–12 let pro chlapce a 8–10 let pro dívky. K tomu došlo v SGP obou prarodičů nebo během těhotenství období / kojenecký život babiček, ale ne během puberty obou prarodičů. Špatné zásobování otcem a dobré zásobování matkou bylo spojeno s nižším rizikem kardiovaskulární smrt.[49][52]
Ztráta genetické exprese, která má za následek Prader-Williho syndrom nebo Angelmanov syndrom bylo v některých případech zjištěno, že je způsobeno epigenetickými změnami (nebo "epimutacemi") na obou alely, spíše než zahrnovat jakoukoli genetickou mutace. Ve všech 19 informativních případech jde o epimutace, které spolu s fyziologickým otiskem, a tedy umlčením druhého alela, způsobující tyto syndromy, byly lokalizovány na chromozomu se specifickým původem rodičů a prarodičů. Konkrétně otcovsky odvozený chromozom měl na mateřské škole abnormální mateřskou značku SNURF-SNRPN a tato neobvyklá známka byla zděděna po babičce z otcovy strany.[49]
Podobně epimutace na MLH1 gen byl nalezen u dvou jedinců s fenotypem dědičná nepolypózní kolorektální rakovina a bez jakékoli upřímné mutace MLH1, která by jinak způsobila onemocnění. Stejné epimutace byly také nalezeny na spermiích jednoho z jedinců, což naznačuje potenciál přenosu na potomky.[49]
Navíc epimutace do MLH1 gen, bylo zjištěno, že některé druhy rakoviny, jako např rakovina prsu, mohou vznikat během fetální etapy v rámci děloha.[53] Dále důkazy shromážděné v různých studiích s využitím modelové systémy (tj. zvířata) zjistili, že expozice během rodičovské generace může mít za následek vícegenerační a transgenerační dědičnost rakoviny prsu.[53] V poslední době studie objevily souvislost mezi adaptací mužské zárodečné buňky přes před koncepcí otcovský diety a regulace rakoviny prsu u vyvíjejících se potomků.[53] Studie konkrétněji začaly odhalovat nová data, která podtrhují vztah mezi transgenerační epigenetickou dědičností rakoviny prsu a rodový potravinové komponenty nebo související markery, například porodní váha. [53] Využitím modelových systémů, jako jsou myši, studie ukázaly, že stimulovaná otcovská obezita v době početí může epigeneticky pozměnit otcovskou zárodečnou linii. Otcovská zárodečná linie je zodpovědná za regulaci hmotnosti jejich dcer při narození a za potenciál jejich dcery k rozvoji rakoviny prsu.[54] Dále bylo zjištěno, že úpravy miRNA výraz profil mužské zárodečné linie je spojen se zvýšenou tělesnou hmotností.[54] Kromě toho otcovská obezita vedla ke zvýšení procenta vývoje ženských potomků karcinogen -indukovaný nádory mléčné žlázy, což je způsobeno změnami v expresi miRNA v mléce. [54]
Jedna studie prokázala zneužívání v dětství, které je definováno jako „sexuální kontakt, těžké fyzické týrání a / nebo vážné zanedbávání“, což vede k epigenetickým modifikacím exprese glukokortikoidových receptorů.[55][56] Exprese glukokortikoidových receptorů hraje zásadní roli v aktivitě hypotalamus-hypofýza-nadledviny (HPA). Pokusy na zvířatech navíc ukázaly, že epigenetické změny mohou záviset na interakcích matka-dítě po narození.[57] Navíc nedávná studie zkoumající korelace mezi stres matky v těhotenství a methylace u dospívajících / jejich matek zjistila, že u dětí žen, které byly během těhotenství zneužívány, byla větší pravděpodobnost, že budou mít geny methylovaného glukokortikoidu-receptoru.[58] Děti s methylovanými geny pro glukokortikoidové receptory tedy mají pozměněnou reakci na stres, což nakonec vede k vyšší náchylnosti k úzkosti. [58]
Další studie zkoumající účinky diethylstilbestrol (DES), což je endokrinní disruptor, zjistili, že vnoučata (třetí generace) žen vystavených DES významně zvýšila pravděpodobnost vývoje jejich vnoučat porucha pozornosti / hyperaktivita (ADHD).[59] Je to proto, že ženy jsou vystaveny endokrinní disruptory, například DES, během těhotenství mohou být spojeny s vícegeneračními neurovývojový deficity.[59] Studie na zvířatech dále naznačují, že endokrinní disruptory mají zásadní dopad na zárodečné buňky a neurovývoj.[59] Příčina vícegeneračního dopadu DES se předpokládá jako výsledek biologických procesů s nimi spojených epigenetické přeprogramování z zárodečná linie, ačkoli toto ještě musí být určeno.[59]
Účinky na kondici
Epigenetická dědičnost může mít pouze vliv zdatnost pokud to předvídatelně změní vlastnost při výběru. Byl předložen důkaz, že podněty prostředí jsou důležitými činiteli při změně epigenů. Je ironií, že darwinovská evoluce může působit na tyto neolamarckiánské získané vlastnosti i na buněčné mechanismy, které je produkují (např. Geny methyltransferázy). Epigenetická dědičnost může organizmům, které se v přechodném časovém měřítku zabývají změnami prostředí, poskytnout kondiční výhodu.[60] Změny s krátkým cyklem pravděpodobně budou mít regulační procesy kódované DNA, protože pravděpodobnost, že potomci budou muset reagovat na změny několikrát během své délky života, je vysoká. Na druhé straně bude přirozený výběr působit na populace, které zažívají změny při změnách životního prostředí s delšími cykly. V těchto případech, pokud epigenetická priming příští generace škodí kondici po většinu intervalu (např. dezinformace o životním prostředí), tyto genotypy a epigenotypy budou ztraceny. Pro střední časové cykly je pravděpodobnost, že se potomci setkají s podobným prostředím, dostatečně vysoká bez podstatného selektivního tlaku na jednotlivce, kterým chybí genetická architektura schopná reagovat na dané prostředí. Absolutní délky krátkých, středních a dlouhých cyklů prostředí budou přirozeně záviset na vlastnostech, délce epigenetické paměti a generační době organismu. Velká část interpretace účinků epigenetické zdatnosti se soustředí na hypotézu, že epigeny jsou důležité přispívá k fenotypům, které zbývá vyřešit.
Škodlivé účinky
Zděděné epigenetické znaky mohou být důležité pro regulaci důležitých složek kondice. Například v rostlinách Lcyc gen v Linaria vulgaris řídí symetrii květu. Linné poprvé popsány radiálně symetrické mutanty, které vznikají, když Lcyc je silně methylovaný.[61] Vzhledem k významu květinové formy pro opylovače,[62] methylace Lcyc homology (např. CYKLOIDEA) může mít škodlivé účinky na kondici rostlin. U zvířat četné studie ukázaly, že zděděné epigenetické stopy mohou zvýšit náchylnost k chorobám. Předpokládá se také, že transgenerační epigenetické vlivy přispívají k onemocnění, zejména rakovině, u lidí. Ukázalo se, že vzorce methylace nádoru v promotorech genů pozitivně korelují s rodinnou anamnézou rakoviny.[63] Dále methylace MSH2 Gen koreluje s rakovinami tlustého střeva a konečníku s časným nástupem.[64]
Předpokládané adaptivní účinky
Experimentálně demetylovaná semena modelový organismus Arabidopsis thaliana mají výrazně vyšší úmrtnost, zakrnělý růst, opožděné kvetení a nižší množení plodů,[65] což naznačuje, že epigeny mohou zvyšovat kondici. Kromě toho se ukázalo, že environmentálně indukované epigenetické reakce na stres jsou zděděné a pozitivně korelují s kondicí.[66] U zvířat společné hnízdění mění chování myší a zvyšuje režimy rodičovské péče[67] a sociální schopnosti[68] předpokládá se, že zvýší přežití potomků a přístup ke zdrojům (jako je jídlo a kamarádi).
Makroevoluční vzory
Zděděné epigenetické účinky na fenotypy byly dobře zdokumentovány u bakterií, protistů, hub, rostlin, hlístic a ovocných mušek.[28][9] Ačkoli nebyla provedena systematická studie epigenetické dědičnosti (většina se zaměřuje na modelové organismy), existují předběžné důkazy, že tento způsob dědičnosti je důležitější u rostlin než u zvířat.[28] Časná diferenciace zvířat zárodečné linie pravděpodobně vylučuje epigenetické značení vyskytující se později ve vývoji, zatímco u rostlin a hub somatický buňky mohou být začleněny do zárodečné linie.[69][70]
Předpokládá se, že transgenerační epigenetická dědičnost může určitým populacím umožnit snadné přizpůsobení se různým prostředím.[9] Ačkoli existují dobře zdokumentované případy transgenerační epigenetické dědičnosti u určitých populací, existují otázky, zda je stejná forma adaptability použitelná pro savce.[9] Přesněji řečeno, je zpochybňováno, zda se to týká lidí.[9] Později většina experimentálních modelů využívajících myši a omezená pozorování u lidí našla pouze epigeneticky zděděné znaky, které jsou škodlivé pro zdraví obou organismů.[9] Tyto škodlivé vlastnosti se pohybují od zvýšeného rizika onemocnění, jako je kardiovaskulární onemocnění, k předčasné smrti.[9] To však může být založeno na předpokladu omezeného zkreslení hlášení, protože je snazší detekovat negativní experimentální účinky, na rozdíl od pozitivních experimentálních účinků.[9] Kromě toho značné epigenetické přeprogramování nezbytné pro evoluční úspěch zárodečných linií a počáteční fáze embryogeneze u savců může být potenciální příčina omezující transgenerační dědičnost chromatinových značek u savců.[9]
Kromě toho může být prospěšná určitá epigenetická variabilita plasticita, aby se určité organismy mohly adaptovat na kolísající podmínky prostředí, ale výměna epigenetických informací mezi generacemi může vést k epigenetickým aberacím, což jsou epigenetické znaky, které se odchylují od normy.[9][71] Proto potomci rodičovské generace může být náchylný ke konkrétním chorobám a snížené plasticitě v důsledku epigenetických aberací.[9][71] Ačkoli schopnost snadno se adaptovat, když se setkáme s novým prostředím u druhů, které se mohou rychle rozmnožovat, může být pro určité populace prospěšné, druhy s dlouhými generačními mezerami nemusí mít z takové schopnosti prospěch.[9][71] Pokud se druh s delší generační mezerou náležitě nepřizpůsobí očekávanému prostředí, pak reprodukční zdatnost potomků tohoto druhu bude sníženo.[9]
Dále vzory epigenetického dědictví a evoluční důsledky epigenetické kódy v živých organismech jsou spojeny s oběma Lamarck a Darwinova evoluční teorie.[71] Například Lamarck předpokládal, že za modifikaci fenotypů jsou odpovědné faktory prostředí dědičně, který podporuje konstrukty, jejichž důsledkem může být vystavení faktorům prostředí v kritických fázích vývoje epimutace v zárodečné linie, čímž se zvyšuje fenotypová odchylka.[71] Naproti tomu Darwinova teorie tvrdila, že přirozený výběr posílil schopnost populace přežít a zůstat reprodukčně fit upřednostňováním populací, které jsou schopné snadno se přizpůsobit.[71] Tato teorie je v souladu s mezigenerační plasticitou a fenotypovou variací vyplývající z dědičné adaptivity.[71]
Životní historie vzory mohou také přispívat k výskytu epigenetické dědičnosti. Přisedlý organizmy, ty s nízkou schopností rozptýlení a ty s jednoduchým chováním, mohou mít největší užitek z předávání informací svým potomkům prostřednictvím epigenetických cest. Mohou se také objevit geografické vzorce, kde vysoce variabilní a vysoce konzervované prostředí může hostit méně druhů s důležitou epigenetickou dědičností.
Kontroverze
Lidé již dlouho vědí, že rysy rodičů jsou často vidět u potomků. Tento pohled vedl k praktické aplikaci selektivního šlechtění rostlin a zvířat, ale neřešil ústřední otázku dědičnosti: jak jsou tyto vlastnosti zachovány mezi generacemi a co způsobuje odchylky? V historii evolučního myšlení bylo zastoupeno několik pozic.
Míchání vs. dědičnost částic
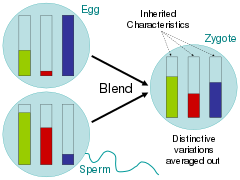
Při řešení těchto souvisejících otázek vědci v době osvícenství do značné míry tvrdili o hypotéze míchání, ve které byly rodičovské rysy u potomků homogenizovány podobně jako kbelíky různých barevných barev, které byly smíchány dohromady.[72] Kritici Charlese Darwina O původu druhů, poukázal na to, že v rámci tohoto schématu dědičnosti bude variace rychle zaplavena většinovým fenotypem.[73] V analogii kbelíku na barvy by to bylo vidět smícháním dvou barev dohromady a následným smícháním výsledné barvy pouze s jednou z nadřazených barev 20krát; vzácná varianta barvy by rychle vybledla.
Neznámý pro většinu evropské vědecké komunity, mnich jménem Gregor Mendel vyřešil otázku, jak jsou zachovány znaky mezi generacemi, pomocí šlechtitelských experimentů s rostlinami hrachu.[74] Charles Darwin tak nevěděl o Mendelově navrhované „částicové dědičnosti“, ve které se vlastnosti nesměšovaly, ale předávaly se potomkům v diskrétních jednotkách, které nyní nazýváme geny. Darwin přišel odmítnout hypotézu spojování, přestože jeho myšlenky a Mendelovy myšlenky nebyly sjednoceny až do 30. let 20. století, období označovaného jako moderní syntéza.
Dědičnost vrozených vs. získaných charakteristik
Ve své knize z roku 1809 Philosophie Zoologique,[75] Jean-Baptiste Lamarck uznal, že každý druh čelí díky své formě a prostředí jedinečnému souboru výzev. Navrhl tedy, aby nejčastěji používané postavy hromadily „nervovou tekutinu“. Takto získané akumulace by se poté přenesly na potomky jednotlivce. V moderních termínech by nervová tekutina přenášená na potomky byla formou epigenetického dědictví.
Lamarckismus jak se toto myšlenkové tělo stalo známým, bylo standardním vysvětlením změny druhu v čase, kdy Charles Darwin a Alfred Russel Wallace společně navrhl teorii evoluce přirozeným výběrem v roce 1859. V reakci na Darwinovu a Wallaceovu teorii, revidované neolamarckismus přilákal malou skupinu biologů,[76] ačkoli Lamarckianova horlivost byla z velké části uhasena kvůli Weismann[77] slavný experiment, ve kterém odřezával ocasy myší během několika po sobě jdoucích generací, aniž by to mělo vliv na délku ocasu. Vznikající shoda, že získané vlastnosti nelze zdědit, se tak stala kánonem.[2]
Revize evoluční teorie
Genetická variace a dědičnost se však ukázaly jako zcela běžné. Souběžně s vývojem 20. století v moderní evoluční syntéza (sjednocení Mendelovy genetiky a přirozeného výběru), C. H. Waddington (1905-1975) pracoval na sjednocení vývojová biologie a genetika. Přitom přijal slovo „epigenetický“[78] reprezentovat uspořádanou diferenciaci embryonálních buněk na funkčně odlišné typy buněk, přestože mají stejnou primární strukturu jejich DNA.[79] Vědci diskutovali o Waddingtonově epigenetice sporadicky - stala se spíše úlovkem pro záhadné negenetické dědičné postavy, spíše než konceptem postupujícím v těle vyšetřování.[80][81] V důsledku toho se definice Waddingtonova slova sama vyvinula a rozšířila se za podmnožinu vývojově signalizované zděděné buněčné specializace.
Někteří vědci se ptali, zda epigenetické dědictví ohrožuje základ moderní syntézy. Popisující centrální dogma molekulární biologie, Francis Crick[82] výstižně řečeno, „DNA je udržována v konfiguraci histonem, takže může působit jako pasivní templát pro simultánní syntézu RNA a proteinu. Žádný podrobných „informací“ je v histonu. “Článek však uzavírá slovy:„ toto schéma vysvětluje většina současných experimentálních výsledků! “Vznik epigenetické dědičnosti (kromě pokroku ve studiu evolučního vývoje, fenotypová plasticita, evolučnost a systémová biologie) napnul současný rámec moderní evoluční syntézy a podnítil přezkoumání dříve odmítnutých evolučních mechanismů.[83]
Bylo toho hodně[vyčíslit ] kritická diskuse o mainstreamové evoluční teorii Edward J Steele, Robyn A Lindley a kolegové,[84][85][86][87][88] Fred Hoyle a N. Chandra Wickramasinghe,[89][90][91] Yongsheng Liu[92][93] Denis Noble,[94][95] John Mattick[96]a další, že logické nekonzistence i účinky Lamarckovské dědičnosti zahrnující přímé modifikace DNA, stejně jako právě popsaný nepřímý, viz. epigenetické, přenosy, výzva konvenčního myšlení v evoluční biologii a přilehlých polích.
Viz také
- Příspěvek epigenetických modifikací k evoluci
- Studie Överkalix
- Holandský hladomor 1944–45 # Legacy
- Dědičnost transgeneračního stresu
Reference
- ^ Bradbury J (prosinec 2003). „Projekt lidského epigenomu - připraven k provozu“. PLOS Biology. 1 (3): E82. doi:10.1371 / journal.pbio.0000082. PMC 300691. PMID 14691553.
- ^ A b C d E F Moore DS (2015). Rozvíjející se genom. Oxford University Press. ISBN 978-0-19-992234-5.[potřebné stránky ]
- ^ A b Heard E, Martienssen RA (2014). „Transgenerační epigenetické dědictví: mýty a mechanismy“. Buňka. 157 (1): 95–109. doi:10.1016 / j.cell.2014.02.045. PMC 4020004. PMID 24679529.CS1 maint: používá parametr autoři (odkaz)
- ^ Jablonka E a MJ Beránek (2010). Transgenerační epigenetická dědičnost. In: M Pigliucci a GB Müller Evolution, rozšířená syntéza
- ^ Zordan RE, Galgoczy DJ, Johnson AD (srpen 2006). „Epigenetické vlastnosti bíle neprůhledného přepínání u Candida albicans jsou založeny na soběstačné transkripční zpětnovazební smyčce“. Sborník Národní akademie věd Spojených států amerických. 103 (34): 12807–12. doi:10.1073 / pnas.0605138103. PMC 1535343. PMID 16899543.
- ^ Beisson J, Sonneborn TM (únor 1965). „Cytoplazmatická dědičnost organizace buněčné kůry v Paramecium Aurelia“. Sborník Národní akademie věd Spojených států amerických. 53 (2): 275–82. Bibcode:1965PNAS ... 53..275B. doi:10.1073 / pnas.53.2.275. PMC 219507. PMID 14294056.
- ^ Soto C, Castilla J (červenec 2004). „Kontroverzní hypotéza šíření prionů založená pouze na proteinu“. Přírodní medicína. 10 Suppl (7): S63–7. doi:10,1038 / nm1069. PMID 15272271.
- ^ Vastenhouw NL, Brunschwig K, Okihara KL, Müller F, Tijsterman M, Plasterk RH (srpen 2006). "Genová exprese: dlouhodobé umlčování genů pomocí RNAi". Příroda. 442 (7105): 882. Bibcode:2006 Natur.442..882V. doi:10.1038 / 442882a. PMID 16929289.
- ^ A b C d E F G h i j k l m n Ó str q r Horsthemke, B. Kritický pohled na transgenerační epigenetické dědictví u lidí. Nat Commun 9, 2973 (2018). https://doi.org/10.1038/s41467-018-05445-5
- ^ A b Bond DM, Finnegan EJ (2007). "Předání zprávy: dědičnost epigenetických znaků". Trendy ve vědě o rostlinách. 12 (5): 211–6. doi:10.1016 / j.tplantts.2007.03.010. PMID 17434332.
- ^ Morison IM, Reeve AE (1998). „Katalog potištěných genů a účinků původce u lidí a zvířat“. Lidská molekulární genetika. 7 (10): 1599–609. doi:10,1093 / hmg / 7.10.1599. PMID 9735381.
- ^ Scott RJ, Spielman M, Bailey J, Dickinson HG (září 1998). "Účinky mateřského původu na vývoj semen v Arabidopsis thaliana". Rozvoj. 125 (17): 3329–41. PMID 9693137.
- ^ Adenot PG, Mercier Y, Renard JP, Thompson EM (1997). „Diferenciální H4 acetylace otcovského a mateřského chromatinu předchází replikaci DNA a diferenciální transkripční aktivitě v pronukleách 1-buněčných myších embryí“ (PDF). Rozvoj. 124 (22): 4615–25. PMID 9409678.
- ^ Santos F, Hendrich B, Reik W, Dean W (2002). "Dynamické přeprogramování methylace DNA v časném embryu myši". Vývojová biologie. 241 (1): 172–82. doi:10.1006 / dbio.2001.0501. PMID 11784103.
- ^ Oswald J, Engemann S, Lane N, Mayer W, Olek A, Fundele R, Dean W, Reik W, Walter J (duben 2000). "Aktivní demetylace otcovského genomu v myší zygote". Aktuální biologie. 10 (8): 475–8. doi:10.1016 / S0960-9822 (00) 00448-6. PMID 10801417.
- ^ Fulka H, Mrazek M, Tepla O, Fulka J (2004). „DNA methylační vzorec u lidských zygotů a vyvíjejících se embryí“. Reprodukce (Cambridge, Anglie). 128 (6): 703–8. doi:10.1530 / rep. 1.00217. PMID 15579587.
- ^ Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (leden 2013). „Dynamika demylace DNA Germline a mazání otisků prostřednictvím 5-hydroxymethylcytosinu“. Věda. 339 (6118): 448–52. Bibcode:2013Sci ... 339..448H. doi:10.1126 / science.1229277. PMC 3847602. PMID 23223451.
- ^ Surani MA, Hajkova P (2010). "Epigenetické přeprogramování zárodečných buněk myší směrem k totipotenci". Cold Spring Harbor Symposia o kvantitativní biologii. 75: 211–8. doi:10.1101 / sqb.2010.75.010. PMID 21139069.
- ^ Zhang Z, Shibahara K, Stillman B (listopad 2000). "PCNA spojuje replikaci DNA s epigenetickou dědičností v kvasinkách". Příroda. 408 (6809): 221–5. Bibcode:2000Natur.408..221Z. doi:10.1038/35041601. PMID 11089978.
- ^ Henderson DS, Banga SS, Grigliatti TA, Boyd JB (1994). "Citlivost mutagenů a potlačení pestrosti pozičního účinku jsou výsledkem mutací v mus209, genu Drosophila kódujícím PCNA". Časopis EMBO. 13 (6): 1450–9. doi:10.1002 / j.1460-2075.1994.tb06399.x. PMC 394963. PMID 7907981.
- ^ Probst AV, Dunleavy E, Almouzni G (2009). "Epigenetická dědičnost během buněčného cyklu". Nature Reviews Molecular Cell Biology. 10 (3): 192–206. doi:10.1038 / nrm2640. PMID 19234478.
- ^ A b Morgan HD, Santos F, Green K, Dean W, Reik W (2005). „Epigenetické přeprogramování u savců“. Lidská molekulární genetika. 14 (Recenze, vydání 1): R47–58. doi:10,1093 / hmg / ddi114. PMID 15809273.
- ^ Santos F, Peters AH, Otte AP, Reik W, Dean W (2005). "Dynamic chromatin modifications characterise the first cell cycle in mouse embryos". Vývojová biologie. 280 (1): 225–36. doi:10.1016/j.ydbio.2005.01.025. PMID 15766761.
- ^ Taguchi YH (2015). "Identification of aberrant gene expression associated with aberrant promoter methylation in primordial germ cells between E13 and E16 rat F3 generation vinclozolin lineage". BMC bioinformatika. 16 Suppl 18: S16. doi:10.1186/1471-2105-16-S18-S16. PMC 4682393. PMID 26677731.
- ^ Richards EJ (2006). "Inherited epigenetic variation--revisiting soft inheritance". Genetika hodnocení přírody. 7 (5): 395–401. doi:10.1038/nrg1834. PMID 16534512.
- ^ Jablonka E, Lamb MJ (1998). "Epigenetic inheritance in evolution". Journal of Evolutionary Biology. 11 (2): 159–183. doi:10.1046/j.1420-9101.1998.11020159.x.
- ^ Bird A, Kirschner M, Gerhart J, Moore T, Wopert L (1998). "Comments on "Epigenetic inheritance in evolution"". Journal of Evolutionary Biology. 11 (2): 185–188, 213–217, 229–232, 239–240. doi:10.1046/j.1420-9101.1998.11020185.x.
- ^ A b C Jablonka E, Raz G (2009). "Transgenerational epigenetic inheritance: prevalence, mechanisms, and implications for the study of heredity and evolution". Čtvrtletní přehled biologie. 84 (2): 131–76. CiteSeerX 10.1.1.617.6333. doi:10.1086/598822. PMID 19606595.
- ^ Rassoulzadegan M, Cuzin F (2015). "Epigenetic heredity: RNA-mediated modes of phenotypic variation". Ann N Y Acad Sci. 1341 (1): 172–5. Bibcode:2015NYASA1341..172R. doi:10.1111/nyas.12694. PMID 25726734.
- ^ Bossdorf O, Richards CL, Pigliucci M (2008). "Epigenetics for ecologists". Ekologie Dopisy. 11 (2): 106–115. doi:10.1111/j.1461-0248.2007.01130.x. PMID 18021243.
- ^ Molinier J, Ries G, Zipfel C, Hohn B (August 2006). "Transgeneration memory of stress in plants". Příroda. 442 (7106): 1046–9. Bibcode:2006Natur.442.1046M. doi:10.1038/nature05022. PMID 16892047.
- ^ A b C d Coe, E. H. (June 1959). "A Regular and Continuing Conversion-Type Phenomenon at the B Locus in Maize". Sborník Národní akademie věd Spojených států amerických. 45 (6): 828–832. Bibcode:1959PNAS...45..828C. doi:10.1073/pnas.45.6.828. ISSN 0027-8424. PMC 222644. PMID 16590451.
- ^ Chandler, Vicki L. (2007-02-23). "Paramutation: From Maize to Mice". Buňka. 128 (4): 641–645. doi:10.1016/j.cell.2007.02.007. ISSN 1097-4172. PMID 17320501.
- ^ A b Stam, Maike; Belele, Christiane; Ramakrishna, Wusirika; Dorweiler, Jane E; Bennetzen, Jeffrey L; Chandler, Vicki L (October 2002). "The regulatory regions required for B' paramutation and expression are located far upstream of the maize b1 transcribed sequences". Genetika. 162 (2): 917–930. ISSN 0016-6731. PMC 1462281. PMID 12399399.
- ^ A b Chandler, Vicki L.; Arteaga-Vazquez, Mario A.; Bader, Rechien; Stam, Maike; Sidorenko, Lyudmila; Belele, Christiane L. (2013-10-17). "Specific Tandem Repeats Are Sufficient for Paramutation-Induced Trans-Generational Silencing". Genetika PLOS. 9 (10): e1003773. doi:10.1371/journal.pgen.1003773. ISSN 1553-7404. PMC 3798267. PMID 24146624.
- ^ A b Arteaga-Vazquez, Mario; Sidorenko, Lyudmila; Rabanal, Fernando A.; Shrivistava, Roli; Nobuta, Kan; Green, Pamela J .; Meyers, Blake C .; Chandler, Vicki L. (2010-07-20). "RNA-mediated trans-communication can establish paramutation at the b1 locus in maize". Sborník Národní akademie věd Spojených států amerických. 107 (29): 12986–12991. Bibcode:2010PNAS..10712986A. doi:10.1073/pnas.1007972107. ISSN 0027-8424. PMC 2919911. PMID 20616013.
- ^ A b Stam, Maike; Laat, Wouter de; Driel, Roel van; Haring, Max; Bader, Rechien; Louwers, Marieke (2009-03-01). "Tissue- and Expression Level–Specific Chromatin Looping at Maize b1 Epialleles". Rostlinná buňka. 21 (3): 832–842. doi:10.1105/tpc.108.064329. ISSN 1532-298X. PMC 2671708. PMID 19336692.
- ^ A b Haring, Max; Bader, Rechien; Louwers, Marieke; Schwabe, Anne; Driel, Roel van; Stam, Maike (2010-08-01). "The role of DNA methylation, nucleosome occupancy and histone modifications in paramutation". The Plant Journal. 63 (3): 366–378. doi:10.1111/j.1365-313X.2010.04245.x. ISSN 1365-313X. PMID 20444233.
- ^ A b Chandler, Vicki L.; Kermicle, Jerry L.; Hollick, Jay B.; Kubo, Kenneth M.; Carey, Charles C.; Dorweiler, Jane E. (2000-11-01). "mediator of paramutation1 Is Required for Establishment and Maintenance of Paramutation at Multiple Maize Loci". Rostlinná buňka. 12 (11): 2101–2118. doi:10.1105/tpc.12.11.2101. ISSN 1532-298X. PMC 150161. PMID 11090212.
- ^ A b C Alleman, Mary; Chandler, Vicki (2008-04-01). "Paramutation: Epigenetic Instructions Passed Across Generations". Genetika. 178 (4): 1839–1844. ISSN 1943-2631. PMC 2323780. PMID 18430919.
- ^ Meyers, Blake C .; Chandler, Vicki L.; Green, Pamela J .; Yen, Yang; Jeong, Dong-Hoon; Sidorenko, Lyudmila; Arteaga-Vazquez, Mario; Accerbi, Monica; Paoli, Emanuele De (2008-09-30). "Distinct size distribution of endogenous siRNAs in maize: Evidence from deep sequencing in the mop1-1 mutant". Sborník Národní akademie věd. 105 (39): 14958–14963. Bibcode:2008PNAS..10514958N. doi:10.1073/pnas.0808066105. ISSN 1091-6490. PMC 2567475. PMID 18815367.
- ^ Chandler, Vicki L.; Sikkink, Kristin; White, Joshua; Dorweiler, Jane E.; Seshadri, Vishwas; McGinnis, Karen; Sidorenko, Lyudmila; Alleman, Mary (July 2006). "An RNA-dependent RNA polymerase is required for paramutation in maize". Příroda. 442 (7100): 295–298. Bibcode:2006Natur.442..295A. doi:10.1038/nature04884. ISSN 1476-4687. PMID 16855589.
- ^ Arteaga-Vazquez, Mario Alberto; Chandler, Vicki Lynn (April 2010). "Paramutation in maize: RNA mediated trans-generational gene silencing". Aktuální názor na genetiku a vývoj. 20 (2): 156–163. doi:10.1016/j.gde.2010.01.008. ISSN 0959-437X. PMC 2859986. PMID 20153628.
- ^ Huang, J .; Lynn, J.S.; Schulte, L.; Vendramin, S.; McGinnis, K. (2017-01-01). Epigenetic Control of Gene Expression in Maize. International Review of Cell and Molecular Biology. 328. s. 25–48. doi:10.1016/bs.ircmb.2016.08.002. ISBN 9780128122204. ISSN 1937-6448. PMID 28069135.
- ^ Chandler, Vicki L. (2010-10-29). "Paramutation's Properties and Puzzles". Věda. 330 (6004): 628–629. Bibcode:2010Sci...330..628C. doi:10.1126/science.1191044. ISSN 1095-9203. PMID 21030647.
- ^ A b C Luo, Lijun; Li, Tiemei; Li, Mingshou; Lou, Qiaojun; Wei, Haibin; Xia, Hui; Chen, Liang; Zheng, Xiaoguo (2017-01-04). "Transgenerational epimutations induced by multi-generation drought imposition mediate rice plant's adaptation to drought condition". Vědecké zprávy. 7: 39843. Bibcode:2017NatSR...739843Z. doi:10.1038/srep39843. ISSN 2045-2322. PMC 5209664. PMID 28051176.
- ^ A b C d Jander, Georg; Felton, Gary W .; Agrawal, Anurag A .; Sun, Joel Y.; Halitschke, Rayko; Tian, Donglan; Casteel, Clare L.; Vos, Martin De; Rasmann, Sergio (2012-02-01). „Bylinná kultura v předchozí generaci připravuje rostliny pro zvýšenou odolnost proti hmyzu“. Fyziologie rostlin. 158 (2): 854–863. doi:10.1104 / pp.111.187831. ISSN 1532-2548. PMC 3271773. PMID 22209873.
- ^ Quadrana, Leandro; Colot, Vincent (2016). "Plant Transgenerational Epigenetics". Výroční přehled genetiky. 50 (1): 467–491. doi:10.1146/annurev-genet-120215-035254. PMID 27732791.
- ^ A b C d E Wei Y, Schatten H, Sun QY (2014). "Environmental epigenetic inheritance through gametes and implications for human reproduction". Aktualizace lidské reprodukce. 21 (2): 194–208. doi:10.1093/humupd/dmu061. PMID 25416302.
- ^ Carl Zimmer (31 Jan 2018). "The Famine Ended 70 Years Ago, but Dutch Genes Still Bear Scars". The New York Times.
- ^ Kate Baggaley (9 Nov 2018). "Civil War study shows father's stress affects son's lifespan".
- ^ Lalande M (1996). "Parental imprinting and human disease". Výroční přehled genetiky. 30: 173–95. doi:10.1146/annurev.genet.30.1.173. PMID 8982453.
- ^ A b C d da Cruz, R. S., Chen, E., Smith, M., Bates, J., & de Assis, S. (2020). Diet and Transgenerational Epigenetic Inheritance of Breast Cancer: The Role of the Paternal Germline. Frontiers in nutrition, 7, 93. https://doi.org/10.3389/fnut.2020.0009
- ^ A b C Fontelles, C., Carney, E., Clarke, J. et al. Paternal overweight is associated with increased breast cancer risk in daughters in a mouse model. Sci Rep 6, 28602 (2016). https://doi.org/10.1038/srep28602
- ^ Weaver IC, Cervoni N, Champagne FA, D'Alessio AC, Sharma S, Seckl JR, Dymov S, Szyf M, Meaney MJ (August 2004). "Epigenetic programming by maternal behavior". Přírodní neurovědy. 7 (8): 847–54. doi:10.1038/nn1276. PMID 15220929.
- ^ McGowan PO, Sasaki A, D'Alessio AC, Dymov S, Labonté B, Szyf M, Turecki G, Meaney MJ (March 2009). „Epigenetická regulace glukokortikoidového receptoru v lidském mozku souvisí se zneužíváním v dětství“. Přírodní neurovědy. 12 (3): 342–8. doi:10.1038 / č. 2270. PMC 2944040. PMID 19234457.
- ^ Meaney MJ, Szyf M (2005). "Environmental programming of stress responses through DNA methylation: life at the interface between a dynamic environment and a fixed genome". Dialogy v klinické neurovědě. 7 (2): 103–23. PMC 3181727. PMID 16262207.
- ^ A b Radtke KM, Ruf M, Gunter HM, Dohrmann K, Schauer M, Meyer A, Elbert T (July 2011). "Transgenerational impact of intimate partner violence on methylation in the promoter of the glucocorticoid receptor". Translační psychiatrie. 1 (July 19): e21. doi:10.1038/tp.2011.21. PMC 3309516. PMID 22832523.
- ^ A b C d Kioumourtzoglou M, Coull BA, O’Reilly ÉJ, Ascherio A, Weisskopf MG. Association of Exposure to Diethylstilbestrol During Pregnancy With Multigenerational Neurodevelopmental Deficits. JAMA Pediatr. 2018;172(7):670–677. doi:10.1001/jamapediatrics.2018.0727
- ^ Jablonka E, Lamb MJ (2005). Epigenetic inheritance and evolution: the Lamarckian dimension (Přetištěno ed.). Oxford: Oxford University Press. ISBN 978-0-19-854063-2.
- ^ Cubas P, Vincent C, Coen E (1999). "An epigenetic mutation responsible for natural variation in floral symmetry". Příroda. 401 (6749): 157–61. Bibcode:1999Natur.401..157C. doi:10.1038/43657. PMID 10490023.
- ^ Dafni A, Kevan PG (1997). "Flower size and shape: implications in pollination". Israeli Journal of Plant Science. 45 (2–3): 201–211. doi:10.1080/07929978.1997.10676684.
- ^ Frazier ML, Xi L, Zong J, Viscofsky N, Rashid A, Wu EF, Lynch PM, Amos CI, Issa JP (August 2003). "Association of the CpG island methylator phenotype with family history of cancer in patients with colorectal cancer". Výzkum rakoviny. 63 (16): 4805–8. PMID 12941799.
- ^ Chan TL, Yuen ST, Kong CK, Chan YW, Chan AS, Ng WF, Tsui WY, Lo MW, Tam WY, Li VS, Leung SY (October 2006). "Heritable germline epimutation of MSH2 in a family with hereditary nonpolyposis colorectal cancer". Genetika přírody. 38 (10): 1178–83. doi:10.1038/ng1866. PMC 7097088. PMID 16951683.
- ^ Bossdorf O, Arcuri D, Richards CL, Pigliucci M (2010). "Experimental alteration of DNA methylation affects the phenotypic plasticity of ecologically relevant traits in Arabidopsis thaliana" (PDF). Evoluční ekologie. 24 (3): 541–553. doi:10.1007/s10682-010-9372-7.
- ^ Whittle CA, Otto SP, Johnston MO, Krochko JE (2009). "Adaptive epigenetic memory of ancestral temperature regime in Arabidopsis thaliana". Botanika. 87 (6): 650–657. doi:10.1139/b09-030.
- ^ Curley, JP, FA Champagne, and P Bateson (2007) Communal nesting induces alternative emotional, social and maternal behavior in offspring. Society for Behavioral Neuroendocrinology 11th Annual Meeting Pacific Grove, CA, USA. Citováno v Branchi I (April 2009). "The mouse communal nest: investigating the epigenetic influences of the early social environment on brain and behavior development". Neurovědy a biobehaviorální recenze. 33 (4): 551–9. doi:10.1016/j.neubiorev.2008.03.011. PMID 18471879.
- ^ Branchi I, D'Andrea I, Fiore M, Di Fausto V, Aloe L, Alleva E (October 2006). "Early social enrichment shapes social behavior and nerve growth factor and brain-derived neurotrophic factor levels in the adult mouse brain". Biologická psychiatrie. 60 (7): 690–6. doi:10.1016/j.biopsych.2006.01.005. PMID 16533499.
- ^ Whitham TG, Slobodchikoff CN (1981). „Evoluce jednotlivci, interakce rostlin a býložravců a mozaiky genetické variability: Adaptivní význam somatických mutací v rostlinách“. Ekologie. 49 (3): 287–292. Bibcode:1981Oecol..49..287W. doi:10.1007 / BF00347587. PMID 28309985.
- ^ Turian G (1979). "Sporogenesis in fungi". Roční přehled fytopatologie. 12: 129–137. doi:10.1146/annurev.py.12.090174.001021.
- ^ A b C d E F G van Otterdijk, S.D. and Michels, K.B. (2016), Transgenerational epigenetic inheritance in mammals: how good is the evidence?. The FASEB Journal, 30: 2457-2465. https://doi.org/10.1096/fj.201500083
- ^ Vorzimmer P (1963). "Charles Darwin and blending inheritance". Isis. 54 (3): 371–390. doi:10.1086/349734.
- ^ Jenkin F (1867). "Recenze Původ druhů". North British Review.
- ^ Mendel G (1866). "Versuche über Plflanzenhybriden. Verhandlungen des naturforschenden Vereines in Brünn" [Experiments in Plant Hybridization] (PDF). Read at the February 8th, and March 8th, 1865, meetings of the Brünn Natural History Society (v němčině).
- ^ Lamarck, JB (1809). Philosophie zoologique: ou Exposition des considérations relative à l'histoire naturelle des animaux. Dentu et L'Auteur, Paris.
- ^ Bowler PJ (1989). Evolution, the history of an idea. Berkeley: University of California Press. ISBN 978-0-520-06386-0.
- ^ Weismann A (1891). Poulton EB, Schönland S, Shipley E (eds.). Essays upon heredity and kindred biological problems. Oxford: Clarendon Press. doi:10.5962/bhl.title.28066.
- ^ {{oed | epigenetický
- ^ Waddington CH (2016) [1939]. "Development as an Epigenetic Process". Introduction to Modern Genetics. Londýn: Allen a Unwin. ISBN 9781317352037.
One of the classical controversies in embryology was that between the preformationists and the epigenisists[sic]. [...] the interaction of these constituents gives rise to new types of tissue and organ which were not present originally, and in so far development must be considered as 'epigenetic.'
- ^ Holliday R (2006). "Epigenetics: a historical overview". Epigenetika. 1 (2): 76–80. doi:10.4161/epi.1.2.2762. PMID 17998809.
- ^ Nanney DL (July 1958). "Epigenetic Control Systems". Sborník Národní akademie věd Spojených států amerických. 44 (7): 712–7. Bibcode:1958PNAS...44..712N. doi:10.1073/pnas.44.7.712. PMC 528649. PMID 16590265.
- ^ Crick FH (1958). „Na syntézu bílkovin“ (PDF). Sympózia Společnosti pro experimentální biologii. 12: 138–63. PMID 13580867.
- ^ Pigliucci M (December 2007). "Do we need an extended evolutionary synthesis?". Vývoj; International Journal of Organic Evolution. 61 (12): 2743–9. doi:10.1111 / j.1558-5646.2007.00246.x. PMID 17924956.
- ^ Steele, E.J. (1979). Somatic selection and adaptive evolution: on the inheritance of acquired characters (1st edit ed.). Toronto: Williams-Wallace.
- ^ Steele, E.J .; Lindley, R.A .; Blanden, R.V. (1998). Davies, Paul (ed.). Lamarck's signature: how retrogenes are changing Darwin's natural selection paradigm. Frontiers of Science. Sydney: Allen & Unwin.
- ^ Lindley, R.A. (2010). The Soma: how our genes really work and how that changes everything!. Piara Waters, CYO Foundation. ISBN 978-1451525649.
- ^ Steele, E.J .; Lloyd, S.S. (2015). "Soma-to-germline feedback is implied by the extreme polymorphism at IGHV relative to MHC". BioEssays. 37 (5): 557–569. doi:10.1002/bies.201400213. PMID 25810320.
- ^ Steele, E.J. (2016). Levin, Michael; Adams, Dany Spencer (eds.). Origin of congenital defects: stable inheritance through the male line via maternal antibodies specific for eye lens antigens inducing autoimmune eye defects in developing rabbits in utero. Ahead of the Curve -Hidden breakthroughs in the biosciences. Bristol, UK: IOP Publishing Ltd. pp. Chapter 3.
- ^ Hoyle, F .; Wickramasinghe, Chandra (1982). Why neo-Darwinism does not work. Cardiff: University College Cardiff Press. ISBN 0-906449-50-2.
- ^ Hoyle, F .; Wickramasinghe, N.C. (1979). Diseases from space. London: J.M.Dent.
- ^ Hoyle, F .; Wickramasinghe, N.C. (1981). Evolution from space. London: J.M.Dent.
- ^ Liu, Y. (2007). "Like father like son. A fresh review of the inheritance of acquired characteristics". Zprávy EMBO. 8 (9): 798–803. doi:10.1038/sj.embor.7401060. PMC 1973965. PMID 17767188.
- ^ Liu, Y .; Li, X. (2016). "Darwin's Pangenesis as a molecular theory of inherited diseases". Gene 2016a. 582 (1): 19–22. doi:10.1016/j.gene.2016.01.051. PMID 26836487.
- ^ Noble, D. (2011). "A theory of biological relativity: no privileged level of causation". Zaměření rozhraní. 2 (1): 55–64. doi:10.1098/rsfs.2011.0067. PMC 3262309. PMID 23386960.
- ^ Noble, D. (2013). "Physiology is rocking the foundations of evolutionary biology". Exp. Physiol. 98 (8): 1235–1243. doi:10.1113/expphysiol.2012.071134. PMID 23585325.
- ^ Mattick, J.S. (2012). "Rocking the foundations of molecular genetics". Proc Natl Acad Sci USA. 109 (41): 16400–16401. Bibcode:2012PNAS..10916400M. doi:10.1073/pnas.1214129109. PMC 3478605. PMID 23019584.
