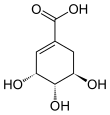
Kyselina shikimová - Shikimic acid
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC (3R,4S,5R) -3,4,5-trihydroxycyklohex-l-en-l-karboxylová kyselina | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.004.850 | ||
| Číslo ES |
| ||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C7H10Ó5 | |||
| Molární hmotnost | 174,15 g / mol | ||
| Bod tání | 185 až 187 ° C (365 až 369 ° F; 458 až 460 K) | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina shikimová, více obyčejně známý jako jeho aniontový formulář shikimate, je cyklohexen, a cyklitol a a cyklohexankarboxylová kyselina. Je to důležitá biochemie metabolit v rostlinách a mikroorganismech. Jeho název pochází z japonské květiny shikimi (シ キ ミ, Japonský badyán, Illicium anisatum), ze kterého byl poprvé izolován v roce 1885 Johan Fredrik Eykman.[1] K objasnění jeho struktury došlo téměř o 50 let později.[2]
Vlastnosti
Objevuje se v seznam karcinogenů skupiny 3 Mezinárodní agentury pro výzkum rakoviny. Skupina 3 znamená, že látka není klasifikovatelná z hlediska karcinogenity pro člověka. Přesto se doporučuje upéct listy vějířů stromů, což je specialita zvaná houslista (zvlněné listy mladé kapradiny v pořadí Cyatheales, sklizené pro použití jako zelenina). Tyto listy jsou jedlé, ale je třeba je nejprve prát, aby se odstranila kyselina shikimová.[3]
Kyselina shikimová je také glykosid část některých hydrolyzovatelné taniny. Kyselina je vysoce rozpustná ve vodě a nerozpustná v nepolárních rozpouštědlech, a proto je kyselina shikimová aktivní pouze proti Grampozitivní bakterie, kvůli vnějšímu buněčná membrána nepropustnost Gramnegativy.[4]
Biosyntéza
Fosfoenolpyruvát a erythrose-4-fosfát reagovat na formu 3-deoxy-D-arabinoheptulosonát-7-fosfát (DAHP), v reakci katalyzované enzymem DAHP syntáza. DAHP se poté transformuje na 3-dehydrochinát (DHQ), v reakci katalyzované DHQ syntáza. I když tato reakce vyžaduje nikotinamid adenin dinukleotid (NAD) jako kofaktoru jej enzymatický mechanismus regeneruje, což vede k čistému použití žádného NAD.
 Biosyntéza 3-dehydrochinátu z fosfoenolpyruvátu a erythrose-4-fosfátu
Biosyntéza 3-dehydrochinátu z fosfoenolpyruvátu a erythrose-4-fosfátu
DHQ je dehydratován na Kyselina 3-dehydrošikimová enzymem 3-dehydrochinát dehydratáza, který je enzymem redukován na kyselinu shikimovou shikimát dehydrogenáza, který používá nikotinamid adenin dinukleotid fosfát (NADPH) jako kofaktor.
 Biosyntéza kyseliny shikimové z 3-dehydrochinátu
Biosyntéza kyseliny shikimové z 3-dehydrochinátu
Shikimate cesta
Biosyntéza aromatických aminokyselin
Cesta shikimate je sedmikroková metabolická cesta, kterou používá bakterie, houby, řasy, paraziti a rostliny pro biosyntézu aromatické aminokyseliny (fenylalanin, tyrosin, a tryptofan ). Tato cesta se nenachází u zvířat; proto představují fenylalanin a tryptofan esenciální aminokyseliny který musí být získán z potravy zvířete (zvířata mohou syntetizovat tyrosin z fenylalaninu, a proto není esenciální aminokyselinou kromě jedinci, kteří nejsou schopni hydroxylovat fenylalanin na tyrosin ).
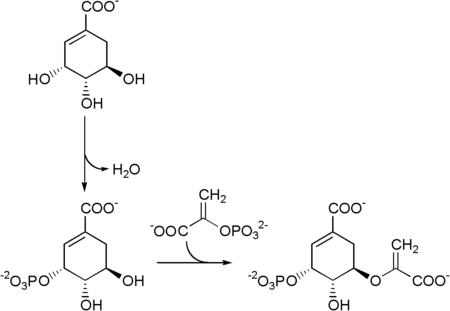
Sedm enzymů zapojených do shikimate dráhy je DAHP syntáza, 3-dehydrochinát syntáza, 3-dehydrochinát dehydratáza, shikimát dehydrogenáza, shikimate kináza, EPSP syntáza, a chorismát syntáza. Cesta začíná dvěma substráty, fosfoenolpyruvát a erythrosa-4-fosfát a končí chorismát, substrát pro tři aromatické aminokyseliny. Pátý enzym zapojen je shikimate kináza, enzym, který katalyzuje ATP -závislý fosforylace z shikimate tvořit shikimate 3-fosfát (zobrazeno na obrázku níže).[5] Shikimate 3-fosfát je poté spojen s fosfoenolpyruvát dát 5-enolpyruvylšikimát-3-fosfát prostřednictvím enzymu 5-enolpyruvylšikimát-3-fosfát (EPSP) syntáza.
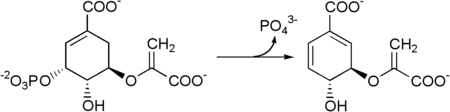
Poté se 5-enolpyruvylshikimate-3-fosfát přemění na chorismát podle a chorismát syntáza.
Kyselina prefenová je poté syntetizován a Claisenův přesmyk z chorismát podle chorismát mutáza.[6][7]
Prefenát je oxidativně dekarboxylovaný se zadržením hydroxyl skupina dát str-hydroxyfenylpyruvát, což je transaminovaný použitím glutamát jako zdroj dusíku tyrosin a α-ketoglutarát.
Výchozí bod v biosyntéze některých fenolik
Fenylalanin a tyrosin jsou prekurzory používané v biosyntéza fenylpropanoidů. Fenylpropanoidy se pak používají k výrobě flavonoidy, kumariny, třísloviny a lignin. První zapojený enzym je fenylalanin amoniak-lyáza (PAL), který převádí L-fenylalanin na trans-kyselina skořicová a amoniak.
Biosyntéza kyseliny gallové
Kyselina gallová je vytvořen z 3-dehydroshikimate působením enzymu shikimát dehydrogenáza k výrobě 3,5-didehydroshikimate. Tato sloučenina spontánně přeskupuje na kyselinu gallovou.[8]
Jiné sloučeniny
Kyselina shikimová je předchůdcem:
- indol, deriváty indolu a aromatická aminokyselina tryptofan a deriváty tryptofanu, jako je psychedelická sloučenina dimethyltryptamin
- mnoho alkaloidy a další aromatické metabolity
Aminokyseliny podobné mykosporinu
Aminokyseliny podobné mykosporinu jsou malé sekundární metabolity produkované organismy, které žijí v prostředích s velkým množstvím slunečního světla, obvykle v mořském prostředí.
Použití
Ve farmaceutickém průmyslu, kyselina shikimová z Číny badyán (Illicium verum) se používá jako základní materiál pro výrobu oseltamivir (Tamiflu ). Ačkoli kyselina shikimová je přítomna ve většině autotrofní organismy, je to biosyntetický meziprodukt a obecně se vyskytuje ve velmi nízkých koncentracích. Nízký výtěžek izolace kyseliny shikimové z čínského badyánu je způsoben nedostatkem oseltamiviru v roce 2005. Kyselinu shikimovou lze také extrahovat ze semen sweetgum (Liquidambar styraciflua ) ovoce,[2] který je hojný v Severní Americe s výnosy kolem 1,5%. Například pro čtrnáct balení Tamiflu jsou potřeba 4 kg semen sweetgum. Pro srovnání se uvádí, že badián poskytuje 3% až 7% kyseliny shikimové. Biosyntetické dráhy v E-coli nedávno byly vylepšeny, aby umožnily organismu hromadit dostatek materiálu pro komerční využití.[9][10][11] Studie z roku 2010 zveřejněná organizací University of Maine ukázal, že kyselinu shikimovou lze snadno získat z jehel několika druhů borovice strom.[12]
Ochrana skupin jsou běžněji používány v laboratorních pracích v malém měřítku a počátečním vývoji než v procesech průmyslové výroby, protože jejich použití zvyšuje proces a další náklady na materiál. Nicméně, dostupnost levné chirální stavební blok může překonat tyto dodatečné náklady, například kyselinu shikimovou pro oseltamivir.
Kyselina aminoshikimová je také alternativou ke kyselině shikimové jako výchozí látce pro syntézu oseltamiviru.
Cíl pro drogy
Shikimate lze použít k syntéze (6S) -6-fluoroshikimová kyselina,[13] antibiotikum, které inhibuje aromatickou biosyntetickou dráhu.[14]
Glyfosát, aktivní složka v herbicidu Zátah, zabíjí rostliny interferencí s shikimate cestou v rostlinách. Přesněji řečeno, glyfosát inhibuje enzym 5-enolpyruvylšikimát-3-fosfát syntáza (EPSPS). „Roundup Ready“ geneticky modifikované plodiny překonat tu inhibici.[Citace je zapotřebí ]
Viz také
- Aminoshikimate cesta, nová variace shikimate dráhy
Reference
- ^ Eykman, J. F. (1881). "Botanické vztahy Illicium religiosum Sieb., Illicium anisatum Lour ". American Journal of Pharmacy. 53 (8).
- ^ A b Enrich, L. B .; Scheuermann, M. L .; Mohadjer, A .; Matthias, K. R .; Eller, C. F .; Newman, M. S .; Fujinaka, M .; Poon, T. (2008). "Liquidambar styraciflua: obnovitelný zdroj kyseliny shikimové ". Čtyřstěn dopisy. 49 (16): 2503–2505. doi:10.1016 / j.tetlet.2008.02.140.
- ^ Evans, I. A .; Osman, M. A. (26. července 1974). "Karcinogenita kapradí a kyseliny shikimové". Příroda. 250 (5464): 348–9. Bibcode:1974Natur.250..348E. doi:10.1038 / 250348a0. PMID 4211848.
- ^ Hai-Jung, Chung (2009). „Hodnocení biologické aktivity extraktů z badyánu“ (PDF). ocean.kisti.re.kr. Citováno 2019-06-18.
- ^ Herrmann, K. M .; Weaver, L. M. (1999). "The Shikimate Pathway". Roční přehled fyziologie rostlin a molekulární biologie rostlin. 50: 473–503. doi:10.1146 / annurev.arplant.50.1.473. PMID 15012217.
- ^ Goerisch, H. (1978). "O mechanismu reakce chorismát mutázy". Biochemie. 17 (18): 3700–3705. doi:10.1021 / bi00611a004. PMID 100134.
- ^ Kast, P .; Tewari, Y. B .; Wiest, O .; Hilvert, D .; Houk, K. N.; Goldberg, Robert N. (1997). „Termodynamika přeměny chorismátu na prefenát: experimentální výsledky a teoretické předpovědi“. Journal of Physical Chemistry B. 101 (50): 10976–10982. doi:10.1021 / jp972501l.
- ^ „Cesta kyseliny gallové“. metacyc.org.
- ^ Bradley, D. (prosinec 2005). „Hvězdná role bakterií při kontrole pandemie chřipky?“. Recenze přírody Objev drog. 4 (12): 945–946. doi:10.1038 / nrd1917. PMID 16370070.
- ^ Krämer, M .; Bongaerts, J .; Bovenberg, R .; Kremer, S .; Müller, U .; Orf, S .; Wubbolts, M .; Raeven, L. (2003). "Metabolické inženýrství pro mikrobiální produkci kyseliny shikimové". Metabolické inženýrství. 5 (4): 277–283. doi:10.1016 / j.ymben.2003.09.001. PMID 14642355.
- ^ Johansson, L .; Lindskog, A .; Silfversparre, G .; Cimander, C .; Nielsen, K. F .; Liden, G. (2005). "Produkce kyseliny shikimové modifikovaným kmenem E-coli (W3110.shik1) za podmínek omezených fosfáty a uhlíkem “. Biotechnologie a bioinženýrství. 92 (5): 541–552. doi:10,1002 / bit. 20546. PMID 16240440.
- ^ „Jehly borové mainské poskytují cenný materiál Tamiflu“. Boston.com. 7. listopadu 2010.
- ^ (PDF) https://web.archive.org/web/20160304001748/http://jiang.tju.edu.cn/pdfs/6flufull.pdf. Archivovány od originál (PDF) dne 4. března 2016. Chybějící nebo prázdný
| název =(Pomoc) - ^ "(6S) -6-Fluoroshikimic Acid, antibakteriální látka působící na aromatickou biosyntetickou dráhu " (PDF).
Knihy
- Haslam, E. (1974). Cesta Shikimate (1. vyd.).
- Haslam, E. (1993). Kyselina shikimová.
externí odkazy
- "Shikimate a chorismate biosyntéza". Department of Chemistry, Queen Mary University of London.