Fluorináza - Fluorinase
| Fluorináza (adenosyl-fluorid syntáza) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.5.1.63 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
The fluorináza enzym (ES 2.5.1.63, také známý jako adenosyl-fluorid syntáza) katalyzuje reakce mezi fluorid iont a kofaktor S-adenosyl-L-methionin vygenerovat L-methionin a 5'-fluor-5'-deoxyadenosin, první spáchaný produkt dráhy biosyntézy fluorometabolitu.[1] Fluorináza byla původně izolována z půdní bakterie Streptomyces cattleya, ale od té doby byly homology identifikovány u řady dalších bakteriálních druhů, včetně Streptomyces sp. MA37, Nocardia brasiliensis a Actinoplanes sp. N902-109.[2] Toto je jediný známý enzym schopný katalyzovat tvorbu uhlík-fluorové vazby, nejsilnější jednoduché vazby v organické chemii.[3]

Homologní chlorináza byl izolován enzym, který katalyzuje stejnou reakci spíše s chloridovým než fluoridovým iontem Salinospora tropicaz biosyntetické dráhy salinosporamid A.[4]
Reaktivita
Fluorináza katalyzuje an SN2 - nukleofilní substituce typu v poloze C-5 'SAM, zatímco L-methionin působí jako neutrální odstupující skupina.[5][6] Odhaduje se, že reakce katalyzovaná fluorinázou je mezi 106[6] do 1015[7] krát rychlejší než nekatalyzovaná reakce, významné zvýšení rychlosti. Navzdory tomu je fluorináza stále považována za pomalý enzym s a číslo obratu (kkočka) 0,06 min−1.[8] Vysoká kinetická bariéra reakce je přičítána silné solvataci fluoridového iontu ve vodě, což má za následek vysokou aktivační energii spojenou s odstraněním solvatujících molekul vody z vodného fluoridového iontu a přeměnou fluoridu na silný nukleofil v aktivním místě.
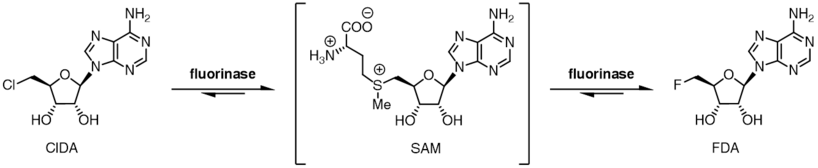
Reakce katalyzovaná fluorinázou je reverzibilní a po inkubaci 5'-fluor-5'-deoxyadenosinu a L-methioninu s fluorinázou se vytvoří SAM a fluoridový ion.[9] Výměna L-methioninu za L-selenomethionin má za následek šestinásobné zvýšení rychlosti reverzní reakce,[9] kvůli zvýšenému nukleofilita centra selenu ve srovnání s centrem síry.
Fluorináza vykazuje stupeň tolerance substrátu pro halogenidový iont a může také místo chloridového iontu použít chloridový ion. Zatímco rovnováha reakce mezi SAM a fluoridovým iontem směřuje k produktům FDA a L-methioninu, rovnovážná poloha je v případě chloridového iontu obrácena. Inkubace SAM a chloridových iontů s fluorinázou nevede k tvorbě 5'-chlor-5'-deoxyadenosinu (ClDA), pokud není použit další enzym, L-aminokyselinová oxidáza, je přidáno. Aminokyselinová oxidáza odstraňuje L-methionin z reakce a převádí jej na odpovídající oxokyselinu.

Preference halogenidů spojená s polohou dvou reakčních rovnováh umožňuje, aby byla enzymem katalyzována síťová transhalogenační reakce.[9] Inkubace 5'-chlor-nukleosidů s enzymem spolu s katalytickým L-selenomethioninem nebo L-methioninem vede k produkci 5-fluor-nukleosidů. Když [18F] fluorid se používá, toto transhalogenační reakce lze použít pro syntézu radiotracerů pro pozitronová emisní tomografie.[10][11]
Strukturální studie
Ke konci roku 2007, 9 struktur byly pro tuto třídu enzymů vyřešeny pomocí PDB přístupové kódy 1RQP, 1RQR, 2C2W, 2C4T, 2C4U, 2C5B, 2C5H, 2CBX, a 2CC2.
Názvy dané enzymu nepocházejí ze struktury, ale z funkce: 5-Fluor-5-deoxyadenosin je molekula syntetizovaná. Struktura je homologní s duf-62 řada enzymů. Enzym je dimer trimerů (2 molekuly, každá se třemi podjednotkami). Aktivní místa jsou umístěna mezi těmito podjednotkami (rozhraní podjednotek), každé se může vázat na jednu molekulu SAM najednou.[12]
Biosyntéza fluorometabolitu
Tato část je prázdná. Můžete pomoci přidávat k tomu. (Listopad 2015) |
Viz také
Reference
- ^ A b O'Hagan D, Schaffrath C, Cobb SL, Hamilton JT, Murphy CD (březen 2002). "Biochemistry: biosyntéza molekuly organofluorinu". Příroda. 416 (6878): 279. doi:10.1038 / 416279a. PMID 11907567.
- ^ Deng H, Ma L, Bandaranayaka N, Qin Z, Mann G, Kyeremeh K, Yu Y, Shepherd T, Naismith JH, O'Hagan D (únor 2014). "Identifikace fluorináz ze Streptomyces sp MA37, Norcardia brasiliensis a Actinoplanes sp N902-109 těžbou genomu". ChemBioChem. 15 (3): 364–8. doi:10.1002 / cbic.201300732. PMID 24449539.
- ^ O'Hagan D (únor 2008). „Porozumění organofluorové chemii. Úvod do vazby CF“. Recenze chemické společnosti. 37 (2): 308–19. doi:10.1039 / b711844a. PMID 18197347.
- ^ Eustáquio AS, Pojer F, Noel JP, Moore BS (leden 2008). „Objev a charakterizace mořské bakteriální SAM-závislé chlorinázy“. Přírodní chemická biologie. 4 (1): 69–74. doi:10.1038 / nchembio.2007.56. PMC 2762381. PMID 18059261.
- ^ Cadicamo CD, Courtieu J, Deng H, Meddour A, O'Hagan D (květen 2004). „Enzymatická fluorace u Streptomyces cattleya probíhá s inverzí konfigurace odpovídající mechanismu reakce SN2“. ChemBioChem. 5 (5): 685–90. doi:10.1002 / cbic.200300839. PMID 15122641.
- ^ A b Senn HM, O'Hagan D, Thiel W (říjen 2005). "Pohled na tvorbu enzymatické vazby CF z výpočtů QM a QM / MM". Journal of the American Chemical Society. 127 (39): 13643–55. doi:10.1021 / ja053875s. PMID 16190730.
- ^ Lohman DC, Edwards DR, Wolfenden R (říjen 2013). „Katalýza desolvatací: katalytická zdatnost halogenovaných alkylačních enzymů závislých na SAM“. Journal of the American Chemical Society. 135 (39): 14473–5. doi:10.1021 / ja406381b. PMID 24041082.
- ^ Zhu X, Robinson DA, McEwan AR, O'Hagan D, Naismith JH (listopad 2007). "Mechanismus enzymatické fluorace u Streptomyces cattleya". Journal of the American Chemical Society. 129 (47): 14597–604. doi:10.1021 / ja0731569. PMC 3326528. PMID 17985882.
- ^ A b C Deng H, Cobb SL, McEwan AR, McGlinchey RP, Naismith JH, O'Hagan D, Robinson DA, Spencer JB (leden 2006). „Fluorináza ze Streptomyces cattleya je také chlorináza“. Angewandte Chemie. 45 (5): 759–62. doi:10.1002 / anie.200503582. PMC 3314195. PMID 16370017.
- ^ Deng H, Cobb SL, Gee AD, Lockhart A, Martarello L, McGlinchey RP, O'Hagan D, Onega M (únor 2006). „Tvorba vazby C- (18) F zprostředkovaná fluorinázou, enzymatický nástroj pro značení PET“. Chemická komunikace. 0 (6): 652–4. doi:10.1039 / b516861a. PMID 16446840.
- ^ Thompson S, Onega M, Ashworth S, Fleming IN, Passchier J, O'Hagan D (září 2015). „Dvoustupňové značení (18) F fluorinázovým peptidem RGD pro pozitronovou emisní tomografii“. Chemická komunikace. 51 (70): 13542–5. doi:10.1039 / c5cc05013h. PMID 26221637.
- ^ Dong C, Huang F, Deng H, Schaffrath C, Spencer JB, O'Hagan D, Naismith JH (únor 2004). "Krystalová struktura a mechanismus bakteriálního fluoračního enzymu". Příroda. 427 (6974): 561–5. doi:10.1038 / nature02280. PMID 14765200.
