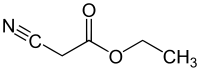
Ethylkyanoacetát - Ethyl cyanoacetate
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.003.009 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
| UN číslo | 3276 2666 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C5H7NÓ2 | |
| Molární hmotnost | 113.116 g · mol−1 |
| -67.3·10−6 cm3/ mol | |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H302, H312, H319, H332 | |
| P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P305 + 351 + 338, P312, P322, P330, P337 + 313, P363, P501 | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Ethylkyanoacetát je organická sloučenina který obsahuje a karboxylátester a a nitril. Je bezbarvý[1] kapalina s příjemným zápachem. Tento materiál je užitečný jako výchozí materiál pro syntézu díky své rozmanitosti funkčních skupin a chemické reaktivitě.
Výroba
Ethylkyanoacetát lze připravit různými způsoby:
- Kolbe nitrilová syntéza použitím ethylchloracetát a kyanid sodný.[2]
- Fischerova esterifikace z kyanoctová kyselina s ethanol v přítomnosti silného minerální kyseliny (např. koncentrovaný kyselina sírová ). Kyselinu kyanooctovou lze připravit Kolbeho nitrilovou syntézou za použití chloracetátu sodného a kyanidu sodného.[2]
- Reakce kyanoacetátu sodného s ethylbromid ve vodno-organickém dvoufázovém systému v přítomnosti a katalyzátor fázového přenosu.[3]
- Oxidace 3-ethoxypropionitrilu, an éter, s kyslíkem pod tlakem v přítomnosti octan kobaltnatý tetrahydrát jako katalyzátor a N-hydroxyftalimid jako radikální generátor.[4]
Vlastnosti
Fyzikální vlastnosti

Ethylkyanoacetát je bezbarvá kapalina, vaří se atmosférický tlak při 209 ° C.[5] Tlak par následuje po Antoinová rovnice log10(P) = A - (B / (T + C)) (P v barech, T v K) s A = 7,46724, B = 3693,663 a C = 16,138 v teplotním rozsahu od 341 do 479 K[6] V pevné fázi dva polymorfní formy může dojít.[7][úplná citace nutná ] Pod -111 ° C je dominantní krystalická forma II.[7] Nad touto teplotou se vytvoří krystalická forma I, která taje při -22 ° C.[5] The tepelná kapacita při 25 ° C je 220,22 J K.−1 mol−1.[7]
Chemické vlastnosti
Se svými třemi různými reaktivními centry - nitril, ester, kyselý methylen site — ethylkyanoacetát je univerzální syntetický stavební blok pro řadu funkčních a farmakologicky aktivních látek. Obsahuje kyselou methylenovou skupinu, lemovanou nitrilem i karbonyl, a lze jej tedy použít při kondenzačních reakcích, jako je Knoevenagelova kondenzace nebo Michael navíc. Tato reaktivita je podobná reaktivitě estery z kyselina mallonová. Jako příklad reaktivity na nitrilu diethyl malonát se získá z ethylesteru kyseliny kyanooctové reakcí s ethanolem v přítomnosti silné kyseliny.[2] Vytápění za přítomnosti ethoxid sodný tvoří dimerní 3-amino-2-kyano-2-pentendiaciddiethylester.[8]
Použití
Kvůli jeho funkčnost kyanoacetát reaguje:
- Na nitrilová skupina různými způsoby:
- Nukleofilní útok na esterová skupina jako součást acylové substituce: reakce s amoniakem vede ke kyanoacetamidu, který lze převést dehydratací pomocí PCl5 nebo POCl3 na malononitril.[10]
- Prostřednictvím kyselého methylenová skupina jako nukleofil
Ethylkyanoacetát je stavebním kamenem pro syntézu heterocykly které se používají například jako léky:
- Alopurinol, používané k léčbě chronické dny, lze syntetizovat počínaje Knoevenagelovou kondenzací s triethylorthoformiát; kondenzační produkt se cyklizuje s hydrazinem za vzniku substituovaného pyrazolu a následně s formamidem k alopurinolu, substituovanému pyrazolo-pyrimidinu.[11]
- Purinové deriváty theofylin, kofein a kyselina močová jsou synteticky přístupné z ethylkyanoacetátu a N, N '-dimetylmočovina.[12]
- The pteridin derivát kyselina listová je přiřazen k komplex vitaminu B.; ethylkyanoacetát a guanidin lze použít jako výchozí materiál ve více fázích konvergentní syntéza.
- The pyrrol ethosuximid se používá k léčbě epilepsie, lze jej získat z ethylkyanoacetátu a butanon v vícestupňové syntéze.
- The pyrimidin derivát trimethoprim se používá jako co-trimoxazol ve fixní kombinaci s sulfamethoxazol používá se jako bakteriostatické činidlo a je syntetizován z ethylkyanoacetátu a 3,4,5-trimethoxybenzaldehyd nebo jeho benzylchlorid.
Také mnoho dalších funkčních heterocyklů je v dobrých výtěžcích dostupných z ethylkyanoacetátu, jako jsou 3-substituované kumarinové deriváty.[13]
Mezi necyklické produkty z tohoto výchozího materiálu patří:
- The antikonvulzivum kyselina valproová
- Ethylkyanoakrylát, používané jako superlepidlo, reakcí s formaldehyd
Ethylkyanoacetát se také používá k přípravě 3,3-difenylpropan-1-aminu, který je prekurzorem použitým při syntéze Prenylamin & Droprenilamin.
Bezpečnost
Ethylkyanoacetát má LD50 2820 mg / kg (orálně, potkan).[14]
Reference
- ^ Vstup na Cyanessigsäureester. na: Römpp online. Georg Thieme Verlag, vyvoláno 2016-06-15.
- ^ A b C J. K. H. Inglis. „Ethylkyanoacetát“. Organické syntézy. doi:10.15227 / orgsyn.008.0074.
- ^ EP přihláška 1028105 „Hanselmann, Paul & Hildebrand, Stefan,„ Proces přípravy kyanooctových esterů “, zveřejněný 16. 8. 2000, přidělen společnosti Lonza AG
- ^ EP patent 1208081 „Hanselmann, Paul & Hildebrand, Stefan,„ Metoda výroby esterů kyseliny kyanooctové “, vydaná 14. 4. 2004, přidělená společnosti Lonza AG
- ^ A b Záznam CAS RN 105-56-6 v databázi látek GESTIS Institut pro bezpečnost a ochranu zdraví při práci, zpřístupněno 3. März 2011.
- ^ Stull, D.R. (1947). „Tlak páry organických sloučenin čistých látek“. Ind. Eng. Chem. 39 (4): 517–540. doi:10.1021 / ie50448a022.
- ^ A b C Khodzhaeva, M.G .; Bugakov, Yu.V .; Ismailov, T.S .: Tepelná kapacita a termodynamické funkce ethylkyanoacetátu v Khim.-Farm. Zhur. 21 (1987) 760-762, DOI: 10,1007 / BF00872889.
- ^ Dorokhov, V. A .; Baranin, S. V .; Dib, A .; Bogdanov, V. S. (1992). "'Programátoři z N- (pyrid-2-yl) amidy a ethylkyanoacetát ". Russ. Chem. Bulletin. 41 (2): 287–291. doi:10.1007 / bf00869516.
- ^ Zheng, Shuyan; Yu, Chunhui; Shen, Zhengwu (2012). „Ethylkyanoacetát: Nové kyanatizační činidlo pro kyanaci arylhalogenidů katalyzovanou palladiem“. Org. Lett. 14 (14): 3644–3647. doi:10.1021 / ol3014914.
- ^ Mary Eagleson: Stručná chemie encyklopedie, Walter de Gruyter, Berlín - New York 1994, ISBN 3-11-011451-8.
- ^ Axel Kleemann „Jürgen Engel:„ Pharmazeutische Wirkstoffe “, 2. Aufl., Georg Thieme, Stuttgart - New York 1982, ISBN 3-13-558402-X.
- ^ Beyer-Walter: „Lehrbuch der Organischen Chemie“, 24. Aufl., S. Hirzel, Stuttgart - Lipsko 2004.
- ^ Avetisyan, A. A .; Vanyan, É. PROTI.; Dangyan, M. T. (1980). "Syntéza funkčně substituovaných kumarinů". Chem. Heterocykl. Sloučeniny. 15 (9): 959–960. doi:10.1007 / BF00473834.
- ^ Harald Strittmatter, Stefan Hildbrand a Peter Pollak „Malonic Acid and Derivatives“ v Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi: 10.1002 / 14356007.a16_063.pub2

