Biomolekulární kondenzát - Biomolecular condensate

Biomolekulární kondenzáty jsou třídoumembrána vázaný organely a subdomény organel. Stejně jako u jiných organel jsou biomolekulární kondenzáty specializované podjednotky buňka. Na rozdíl od mnoha organel však složení biomolekulárního kondenzátu není kontrolováno vazebnou membránou. Místo toho se mohou formovat řadou různých procesů, z nichž nejznámější je fázová separace z bílkoviny, RNA a další biopolymery do obou koloidní emulze, tekuté krystaly, pevný krystaly nebo agregáty uvnitř buněk.
Dějiny
Micelární teorie

Micelární teorie Carl Nägeli byl vyvinut z jeho podrobné studie škrob granule v roce 1858.[1] Amorfní látky, jako je škrob a celulóza, byly navrženy tak, aby sestávaly ze stavebních bloků zabalených do volně krystalického pole, které později označil jako „micely“. Mezi micely mohla pronikat voda a v mezerách mezi starými micelami by se mohly tvořit nové micely. Bobtnání škrobových zrn a jejich růst byl popsán pomocí molekulárně-agregátového modelu, který také aplikoval na celulózu buněčné stěny rostlin. Moderní využití 'micela „odkazuje striktně na lipidy, ale jeho původní použití se jasně rozšířilo na jiné typy biomolekula a toto dědictví se dodnes odráží v popisu mléka, které se skládá z „kasein micely.
Teorie separace koloidních fází
Termín 'koloidní 'vytvořil Wolfgang Ostwald a definováno Thomas Graham v roce 1861 popsat chování určitých biologických makromolekul (škrob, albumin, želatina atd.) a anorganické molekuly jako pomalu se rozptylující složky zataženo kapalný řešení -pozastavení které byly blokovány polopropustnými membránami,[2] zatímco fyzika fázová separace popsal Josiah Willard Gibbs v jeho orientačním článku s názvem O rovnováze heterogenních látek, publikovaná v částech mezi 1875 a 1878.[3] Pod vlivem Willarda Gibbse významně přispěl také Johannes Diderik van der Waals, který v roce 1890 vydal pojednání o Teorie binárních řešení.[4]
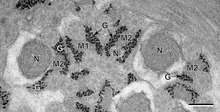
Koncept intracelulární koloidy jako organizační princip pro rozčlenění živých buněk sahá až do konce 19. století, počínaje William Bate Hardy a Edmund Beecher Wilson kdo popsal cytoplazma (pak volal 'protoplazma ') jako koloidní.[5][6] Přibližně ve stejnou dobu Thomas Harrison Montgomery Jr. popsal morfologii jádro, organela v jádru, u které bylo následně prokázáno, že se vytváří intracelulární fázovou separací.[7] WB Hardy spojená tvorba biologických koloidy s fázovou separací ve své studii o globuliny s tím, že: „Globulin je dispergován v rozpouštědle jako částice, které jsou koloidními částicemi a které jsou tak velké, že tvoří vnitřní fázi“,[8] a dále přispěl k základnímu fyzikálnímu popisu oddělení fáze olej-voda.[9]
Koloidní fázová separace jako hnací síla buněčné organizace se silně apelovala na Stephane Leduc, který napsal ve své vlivné knize z roku 1911 Mechanismus života„Z tohoto důvodu může být studium života nejlépe zahájeno studiem těch fyzikálně-chemických jevů, které jsou výsledkem kontaktu dvou různých kapalin. Biologie je tedy pouze větví fyzikálně-chemické kapaliny; zahrnuje studium elektrolytické a koloidní roztoky a molekulární síly vyvolané roztokem, osmózou, difúzí, soudržností a krystalizací. “ [10]
The prvotní polévka teorie původu života, kterou navrhl Alexander Oparin v ruštině v roce 1924 (publikováno v angličtině v roce 1936)[11] a tím J.B.S. Haldane v roce 1929,[12] navrhl, že životu předcházelo vytvoření toho, co Haldane nazval „horkou zředěnou polévkou“ z „koloidní organické látky “, a které Oparin označil jako„koacervuje '(po de Jong [13]) - částice složené ze dvou nebo více koloidy což může být protein, lipid nebo nukleová kyselina. Tyto myšlenky silně ovlivnily následnou práci Sidney W. Fox na proteinoidních mikrosférách.
Molekulární biologie
V roce 1922 Hermann Staudinger rafinoval koloid asociační teorie z Thomas Graham tím, že navrhuje to jisté koloidy byly složeny z vysoké molekulové hmotnosti polymery (řetězy spojené kovalentní vazby ), kterou nazval „makromolekuly „odlišit je od koloidní shluky molekul s nižší molekulovou hmotností. Tak silně držený byl koloidní asociační teorie že dokonce Emil Fischer, který k tomu dospěl bílkoviny jsou polypeptidy tvořil kovalentní vazby mezi aminokyselina jednotky v roce 1906 zpočátku odmítal věřit v existenci polymerů s vysokou molekulovou hmotností. Staudinger nakonec obdržel Nobelovu cenu v roce 1953.[14] Důležité je, že objev makromolekulárních polymerů s vysokou molekulovou hmotností zpochybňuje univerzálnost separace koloidních fází v biologii, a to navzdory skutečnosti, že je stále možné pozorovat, že jednotlivé polymery se sdružují shlukováním a fázová separace tvořit koloidy, tekuté krystaly, pevný krystaly nebo agregáty.[15]
Mnohem větší dopad nastal, když Frederick Sanger určil aminokyselina posloupnost Inzulín[16][17] a Linus Pauling, Robert Corey a Herman Branson správně navrhl alfa šroubovice a beta list jako primární strukturní motivy v proteinu sekundární struktura,[18] zatímco Max Perutz a John Kendrew analyzoval 3D strukturu myoglobin a později hemoglobin. Tyto průlomy v proteinová struktura odhodlání vedlo k obecnému zaměření biologů na atomové měřítko aminokyselina specifické pro sekvenci a 3D konformaci interakce protein-protein a model zámku a klíče typu, obvykle mezi definovaným počtem interagujících podjednotek ve stechiometrickém komplexu. Dohromady s Staudinger Nobelova cena v roce 1953[19] tento nový přístup vedl ke sníženému zájmu o biopolymery tak jako koloidy v biologii, kromě jejich sklonu tvořit pevné látky krystaly pro stanovení struktury pomocí Rentgenová krystalografie.[20][21] Přesto však pole koloidní chemie a polymerní fyzika pokračoval v nezmenšené míře, aby charakterizoval nestechiometrické interakce, ke kterým dochází během koloidní, tekutý krystal a další fáze chování makromolekul polymery, zejména syntetické polymery vyvinuté pro průmyslové aplikace.
Podpora z jiných oborů

Když se buněční biologové do značné míry vzdali koloidní fázová separace, bylo ponecháno na relativní outsidery - zemědělské vědce a fyziky - aby dosáhli dalšího pokroku ve studiu fázově separujících biomolekul v buňkách.
Začátkem sedmdesátých let vyvinul Harold M Farrell Jr. na americkém ministerstvu zemědělství a koloidní fázová separace model pro mléko kasein micely které se tvoří v buňkách mléčné žlázy před vylučováním jako mléko.[22]
Také v 70. letech 20. století fyzici Tanaka a Benedek na MIT identifikovali chování fázové separace gama-krystalických proteinů z epiteliálních buněk čočky a šedý zákal v řešení,[23][24][25][26][27] které Benedek označoval jako „kondenzace bílkovin '.[28]

V 80. a 90. letech Athene Donald je polymerní fyzika laboratoř v Cambridge značně charakterizována fázové přechody / fázová separace z škrob granule z cytoplazma rostlinných buněk, které se chovají jako tekuté krystaly.[29][30][31][32][33][34][35][36]
V roce 1991 Pierre-Gilles de Gennes obdržel Nobelovu cenu za fyziku za vývoj zobecněné teorie fázových přechodů se zvláštními aplikacemi pro popis uspořádání a fázových přechodů v polymerech.[37] Bohužel, de Gennes napsal dovnitř Příroda že polymery by měly být odlišeny od jiných typů koloidy, i když mohou zobrazovat podobné shlukování a fázová separace chování,[38] postoj, který se odráží ve sníženém použití výrazu koloidní popsat chování asociace vyššího řádu biopolymery v moderní buněčné biologii a molekulární samo-sestavení.
Znovu navštíveno oddělení fází
Pokroky v konfokální mikroskopie na konci 20. století identifikován bílkoviny, RNA nebo sacharidy lokalizace do mnoha buněčných oddílů nevázaných na membránu v rámci cytoplazma nebo jádro které byly různě označovány jako „puncta / dots“,[39][40][41][42] 'signalosomy ',[43][44] 'granule ',[45] 'těla ', 'sestavy ',[42] 'paraspeckles ',' purinosomy ',[46] 'inkluze ', 'agregáty 'nebo'továrny '. Během tohoto časového období (1995-2008) byl koncept fázová separace byl znovu zapůjčen od koloidní chemie & polymerní fyzika a navrhl základ obou cytoplazmatický a jaderný rozčlenění.[47][48][49][50][51][52][53][54][55][56]
Od roku 2009 další důkazy o tom, že biomakromolekuly procházejí intracelulárně fázové přechody (fázová separace ) byl pozorován v mnoha různých kontextech, a to jak v buňkách, tak v rekonstituovaných in vitro experimenty.[57][58][59][60][61][62][63]
Nově vytvořený pojem „biomolekulární kondenzát"[64] se týká biologických polymerů (na rozdíl od syntetických polymery ) které procházejí vlastní montáž shlukováním ke zvýšení místní koncentrace montážních komponent a je analogický s fyzickou definicí kondenzace.[65][64]
Ve fyzice kondenzace obvykle označuje plyn-kapalina fázový přechod.
V biologii se termín „kondenzace“ používá mnohem širší a může také odkazovat na kapalinu-kapalinu fázová separace tvořit koloidní emulze nebo tekuté krystaly uvnitř buněk a kapalina-pevná látka fázová separace tvořit gely, sols nebo pozastavení v buňkách i kapalina-tuhá látka fázové přechody jako Kondenzace DNA v době profáze buněčného cyklu nebo kondenzace proteinů krystalinů v šedý zákal.[66] S ohledem na tuto skutečnost byl záměrně zaveden termín „biomolekulární kondenzáty“, aby odrážel tuto šíři (viz níže). Protože biomolekulární kondenzace obecně zahrnuje oligomerní nebo polymerní interakce mezi neurčitým počtem složek, je obecně považována za odlišnou od tvorby menších stechiometrických proteinových komplexů s definovaným počtem podjednotek, jako jsou virové kapsidy nebo proteazom - i když oba jsou příklady spontánních molekulární vlastní montáž nebo sebeorganizace.
Mechanicky se zdá, že multivalentní interakce mezi vnitřně neuspořádané proteiny (včetně křížové beta polymerace),[67] a / nebo proteinové domény které indukují oligomerní nebo polymerní shlukování, mohou hrát roli při fázové separaci proteinů.
Příklady


Mnoho příkladů biomolekulárních kondenzátů bylo charakterizováno v cytoplazma a jádro o kterých se předpokládá, že vznikají buď fázovou separací kapalina-kapalina nebo kapalina-pevná látka.
Cytoplazmatické kondenzáty
- Lewy těla
- Stresová granule
- P-tělo
- Germline P-granule
- Škrobové granule
- Glykogenové granule [68]
- Rohovková čočka formace a šedý zákal[69][70][71][26][72][73]
- jiný cytoplazmatické inkluze jako jsou pigmentové granule nebo cytoplazmatické krystaly
- Purinosomy [46]
- Špatně poskládané agregace proteinů jako amyloidové fibrily nebo mutantní vlákna hemoglobinu S (HbS) v srpkovitá nemoc
- Signalosomy, tak jako supramolekulární sestavy v Wnt signální cesta.[74][75]
- Lze také tvrdit, že cytoskeletální vlákna se tvoří polymeračním procesem podobným fázové separaci, s výjimkou uspořádání do vláknitých sítí místo amorfních kapiček nebo granulí.
- Bakteriální ribonukleoproteinové orgány (BR-těla) - V nedávných studiích bylo prokázáno, že bakteriální RNA degradosomy se mohou shromažďovat do fázově oddělených struktur, nazývaných bakteriální ribonukleoproteinová těla (BR-těla), s mnoha analogickými vlastnostmi jako eukaryotická zpracovatelská těla a stresové granule.[76]
- Granule FLOE1: FLOE1 je prionový protein specifický pro semena, který reguluje klíčení semen rostlin prostřednictvím fázové separace na biomolekulární kondenzáty.[77]
Jaderné kondenzáty
Ostatní jaderné struktury včetně heterochromatin a Kondenzace DNA v kondenzaci mitóza chromozomy se tvoří mechanismy podobnými fázové separaci, lze je tedy také klasifikovat jako biomolekulární kondenzáty.
Kondenzáty spojené s plazmatickou membránou
- Membránový protein nebo protein spojený s membránou, shlukování na neurologické úrovni synapse, buňka-buňka těsné spojení nebo jiné membránové domény.[79]
Vylučované extracelulární kondenzáty
- Tajemství thyroglobulin koloidní a koloidní uzliny z Štítná žláza žláza
- Tajemství kasein „Micely“ mléčné žlázy
- Sérum albumin a globuliny
- Tajemství lysozym[80][52]
Lipidem uzavřené organely a lipoproteiny nejsou považovány za kondenzáty
Typický organely nebo endozomy uzavřeno a lipidová dvojvrstva nejsou považovány za biomolekulární kondenzáty. Navíc, lipidové kapičky jsou obklopeny lipidovou monovrstvou v cytoplazmě nebo v mléko, nebo v slzách,[81] Zdá se tedy, že spadají do kategorie „vázané na membránu“. Nakonec vylučováno LDL a HDL lipoprotein částice jsou také uzavřeny lipidovou monovrstvou. Tvorba těchto struktur zahrnuje fázová separace do od koloidní micely nebo tekutý krystal dvojvrstvy, ale nejsou klasifikovány jako biomolekulární kondenzáty, protože tento termín je vyhrazen pro nemembránově vázané organely.
Oddělení fází kapalina-kapalina (LLPS) v biologii

Kapalné biomolekulární kondenzáty
Kapalina-kapalina fázová separace (LLPS) generuje podtyp koloidní známý jako emulze to může splývají z velkých kapiček v kapalině. Řazení molekul během kapaliny-kapaliny fázová separace může generovat tekuté krystaly spíše než emulze. V buňkách produkuje LLPS kapalnou podtřídu biomolekulárního kondenzátu, který se může chovat buď jako emulze nebo tekutý krystal.
Termín biomolekulární kondenzáty byl představen v kontextu intracelulárních sestav jako pohodlný a nevylučující termín k popisu nestechiometrických sestav biomolekul.[64] Volba jazyka je zde konkrétní a důležitá. Bylo navrženo, že mnoho biomolekulárních kondenzátů tvoří kapalina-kapalina fázová separace (LLPS) k vytvoření koloidní emulze nebo tekuté krystaly v živých organismech, na rozdíl od kapalné pevné látky fázová separace tvořit krystaly /agregáty v gely, sols nebo pozastavení v buňkách nebo extracelulárních sekrecích.[82] Jednoznačně demonstrovat, že buněčné tělo se formuje oddělením fáze kapalina-kapalina, je však náročné,[83][84][85][86] protože různé materiální stavy (kapalina vs. gel vs. pevná látka) nejsou v živých buňkách vždy snadno rozlišitelné.[87][88] Termín „biomolekulární kondenzát“ přímo řeší tuto výzvu tím, že nevytváří žádný předpoklad týkající se buď fyzického mechanismu, kterým je sestava dosažena, ani materiálového stavu výsledné sestavy. V důsledku toho jsou buněčná tělesa, která se tvoří oddělením fází kapalina-kapalina, podmnožinou biomolekulárních kondenzátů, stejně jako těmi, u nichž není znám fyzický původ montáže. Historicky bylo zjištěno, že mnoho buněčných neembránově vázaných oddílů mikroskopicky spadá pod široký deštník biomolekulárních kondenzátů.
Ve fyzice lze fázovou separaci rozdělit do následujících typů koloidní jedním z příkladů jsou biomolekulární kondenzáty:
| Střední / fáze | Rozptýlené fáze | |||
|---|---|---|---|---|
| Plyn | Kapalný | Pevný | ||
| Rozptyl střední | Plyn | Žádné takové koloidy nejsou známy. Je známo, že je to helium a xenon nemísitelný za určitých podmínek.[89][90] | Kapalný aerosol Příklady: mlha, mraky, kondenzace, mlha, spreje na vlasy | Tuhý aerosol Příklady: kouř, ledový mrak, atmosférické částice |
| Kapalný | Pěna Příklad: šlehačka, pěna na holení, Plynové vezikuly | Emulze nebo Tekutý krystal Příklady: mléko, majonéza, krém na ruce, latex, biologické membrány, micely, lipoproteiny, hedvábí, kapalné biomolekulární kondenzáty | Sol nebo suspenze Příklady: pigmentovaný inkoust, usazenina, sráží, agregáty, vlákna / fibrily / vlákna, krystaly, pevné biomolekulární kondenzáty | |
| Pevný | Pevná pěna Příklady: aerogel, polystyren, pemza | Gel Příklady: agar, želatina, želé, gelovité biomolekulární kondenzáty | Pevný sol Příklad: brusinkové sklo | |
V biologii jsou nejdůležitější formy fázová separace jsou buď kapalina-kapalina, nebo kapalina-pevná látka, i když již byly hlášeny případy plynové vezikuly obklopený fázově odděleným proteinovým obalem v cytoplazmě některých mikroorganismů.[91]
Wnt signalizace
Jeden z prvních objevených příkladů vysoce dynamického intracelulárního kapalný biomolekulární kondenzát s jasnou fyziologickou funkcí byly supramolekulární komplexy (Wnt signalosomy) tvořené složkami Wnt signální cesta.[54][92][93] Protein Disheveled (Dsh nebo Dvl) prochází shlukováním v cytoplazmě prostřednictvím své domény DIX, která zprostředkovává shlukování proteinů (polymeraci) a fázovou separaci a je důležitý pro signální transdukci.[39][40][41][42][44][54] Protein Dsh funguje jak v rovině polarity, tak v signalizaci Wnt, kde získává další supramolekulární komplex (komplex Axin) na receptory Wnt na plazmatické membráně. Tvorba těchto kapiček obsahujících rozcuchané a axiny je zachována napříč metazoany, včetně in Drosophila, Xenopus a lidské buňky.
P granule
Dalším příkladem kapalných kapiček v buňkách jsou zárodečné P granule v Caenorhabditis elegans.[82][84] Tyto granule se oddělují od cytoplazmy a vytvářejí kapičky, stejně jako olej z vody. Jak granule, tak okolní cytoplazma jsou kapalné v tom smyslu, že proudí v reakci na síly, a dva z granulí se mohou při kontaktu spojit. Když jsou (některé) molekuly v granulích studovány (přes zotavení fluorescence po fotobělení ), bylo zjištěno, že rychle se mění v kapičkách, což znamená, že molekuly difundují do a ven z granulí, jak se očekávalo v kapalný kapička. Kapičky mohou také narůst na mnoho molekul napříč (mikrometry)[84] Studie kapiček z Caenorhabditis elegans protein LAF-1 in vitro[94] také ukazují chování podobné kapalině, se zjevným viskozita Pa s. To je asi desetkrát více než voda při pokojové teplotě, ale je to dost malé na to, aby kapičky LAF-1 mohly proudit jako kapalina. Síla interakce (afinita )[95] a valence (počet vazebných míst)[63] fázových separačních biomolekul ovlivňuje jejich viskozitu kondenzátu a také jejich celkovou tendenci k separaci fází.
Reference
- ^ Farlow, William G. (1890). „Proceedings of the American Academy of Arts and Sciences“. 26. Americká akademie umění a věd: 376–381. JSTOR 20013496. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Graham T (prosinec 1861). „Difúze kapaliny aplikována na analýzu“. Filozofické transakce královské společnosti. 151: 183–224. doi:10.1098 / rstl.1861.0011.
- ^ Gibbs, J. W. (1961), Vědecké práce, Dover, New York
- ^ Levelt-Sengers JM (2002). „How Fluids Unmix: Discoveries by the School of Van der Waals and Kamerlingh Onnes“. R Nizozemsko akademie umění a sci. Amsterdam.
- ^ Wilson EB (červenec 1899). "Struktura protoplazmy". Věda. 10 (237): 33–45. Bibcode:1899 sci ... 10 ... 33 W.. doi:10.1126 / science.10.237.33. PMID 17829686.
- ^ Hardy WB (květen 1899). „O struktuře buněčné protoplazmy: Část I. Struktura produkovaná v buňce fixační a posmrtnou změnou. Struktura koloidní hmoty a mechanismus tuhnutí a srážení“. The Journal of Physiology. 24 (2): 158–210.1. doi:10.1113 / jphysiol.1899.sp000755. PMC 1516635. PMID 16992486.
- ^ Montgomery T (1898). "Srovnávací cytologické studie, se zvláštním zřetelem na morfologii jádra". Journal of Morphology. 15 (1): 265–582. doi:10.1002 / jmor.1050150204. S2CID 84531494.
- ^ Hardy WB (1905). „Koloidní roztok. Globuliny“. Fyziologický časopis. 33 (4–5): 255–333. doi:10.1113 / jphysiol.1905.sp001126. PMC 1465795. PMID 16992817.
- ^ Hardy WB (1912). „Napětí povrchů kompozitních tekutin a mechanická stabilita filmů tekutin“. Sborník královské společnosti A. 86 (591): 610–635. doi:10.1098 / rspa.1912.0053.
- ^ Leduc, Stephane (1911). "Mechanismus života".
- ^ Oparin, Alexander. "Původ života" (PDF).
- ^ Haldane, John B. S. "Původ života" (PDF).
- ^ Bungenberg de Jong, H. G. a H. R. Kruyt (1929). "Koacervace (částečná mísitelnost v koloidních systémech)". Proc Koninklijke Nederlandse Akademie Wetenschappen 32: 849—856
- ^ Nobelova cena za chemii 1953.
- ^ Jirgensons, Bruno (1958). "Organické koloidy". Amsterdam-Londýn-New York-Princeton: Elsevier. doi:10.1002 / pol.1958.1203312665. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Sanger & Tuppy 1951a; Sanger & Tuppy 1951b; Sanger & Thompson 1953a; Sanger & Thompson 1953b
- ^ Sanger, F. (1958), Nobelova přednáška: Chemie inzulínu (PDF), Nobelprize.org, vyvoláno 18. října 2010. Sangerova Nobelova přednáška byla také publikována ve Vědě: Sanger 1959
- ^ Pauling, L; Corey, RB (1951). „Konfigurace polypeptidových řetězců se zvýhodněnou orientací kolem jednotlivých vazeb: dva nové skládané listy“. Sborník Národní akademie věd Spojených států amerických. 37 (11): 729–40. Bibcode:1951PNAS ... 37..729P. doi:10.1073 / pnas.37.11.729. PMC 1063460. PMID 16578412.
- ^ Nobelova cena za chemii 1953.
- ^ Haas, C .; Drenth, J. (1999). "Pochopení krystalizace proteinu na základě fázového diagramu". Journal of Crystal Growth. 196 (2–4): 388–394. doi:10.1016 / S0022-0248 (98) 00831-8. ISSN 0022-0248.
- ^ Piazza, Roberto (2000). "Interakce a fázové přechody v proteinových roztocích". Aktuální názor na koloidní a rozhraní Science. 5 (1–2): 38–43. doi:10.1016 / S1359-0294 (00) 00034-0. ISSN 1359-0294.
- ^ Farrell HM (1973). "Modely pro tvorbu kaseinové micely". Journal of Dairy Science. 56 (9): 1195–1206. doi:10.3168 / jds.S0022-0302 (73) 85335-4. PMID 4593735.
- ^ Tanaka T, Benedek GB (červen 1975). "Pozorování proteinové difuzivity v neporušených lidských a hovězích čočkách s aplikací na šedý zákal". Investigativní oftalmologie a vizuální věda. 14 (6): 449–56. PMID 1132941.
- ^ Tanaka T, Ishimoto C, Chylack LT (září 1977). "Fázová separace směsi protein-voda ve studené kataraktu v čočce mladé krysy". Věda. 197 (4307): 1010–1012. doi:10.1126 / science.887936. PMID 887936.
- ^ Ishimoto C, Goalwin PW, Sun ST, Nishio I, Tanaka T (září 1979). "Cytoplazmatická fázová separace při tvorbě galaktosemické katarakty v čočkách mladých krys". Sborník Národní akademie věd Spojených států amerických. 76 (9): 4414–4416. doi:10.1073 / pnas.76.9.4414. PMC 411585. PMID 16592709.
- ^ A b Thomson, J. A .; Schurtenberger, P .; Thurston, G. M .; Benedek, G. B. (1987). „Binární separace kapalné fáze a kritické jevy v roztoku protein / voda“. Sborník Národní akademie věd. 84 (20): 7079–7083. doi:10.1073 / pnas.84.20.7079. ISSN 0027-8424. PMC 299233. PMID 3478681.
- ^ Broide ML, Berland CR, Pande J, Ogun OO, Benedek GB (červenec 1991). „Binární-kapalná fázová separace roztoků proteinů čoček“. Sborník Národní akademie věd Spojených států amerických. 88 (13): 5660–4. doi:10.1073 / pnas.88.13.5660. PMC 51937. PMID 2062844.
- ^ Benedek GB (září 1997). „Katarakta jako choroba kondenzující bílkoviny: Proctorova přednáška“. Investigativní oftalmologie a vizuální věda. 38 (10): 1911–21. PMID 9331254.
- ^ Waigh, T. A.; Gidley, M.J .; Komanshek, B.U .; Donald, A.M. (2000). "Fázové transformace ve škrobu během želatinizace: přístup v tekutých krystalů". Výzkum sacharidů. 328 (2): 165–176. doi:10.1016 / s0008-6215 (00) 00098-7. PMID 11028784.
- ^ Jenkins, P.J .; Donald, A.M. (1998). „Želatinace škrobu: kombinovaná studie SAXS / WAXS / DSC a SANS“. Výzkum sacharidů. 308 (1–2): 133. doi:10.1016 / S0008-6215 (98) 00079-2.
- ^ Jenkins, P. J .; Donald, A.M. (1995). "Vliv amylózy na strukturu granulovaného škrobu". International Journal of Biological Makromolecules. 17 (6): 315–21. doi:10.1016/0141-8130(96)81838-1. PMID 8789332.
- ^ Jenkins, P.J .; Cameron, R. E.; Donald, A.M. (1993). „Univerzální prvek ve struktuře škrobových granulí z různých botanických zdrojů“. Škrob - Stärke. 45 (12): 417. doi:10.1002 / hvězda.19930451202.
- ^ Donald, A.M.; Windle, A.H .; Brand, H. R. (1993). "Tekuté krystalické polymery". Fyzika dnes. 46 (11): 87. Bibcode:1993PhT .... 46k..87D. doi:10.1063/1.2809100. hdl:2060/19900017655.
- ^ Windle, A.H .; Donald, A.D. (1992). Kapalné krystalické polymery. Cambridge, Velká Británie: Cambridge University Press. ISBN 978-0-521-30666-9.
- ^ Škrob: struktura a funkčnost. Cambridge, Anglie: Royal Society of Chemistry. 1997. ISBN 978-0-85404-742-0.
- ^ Význam vědy o polymerech pro biologické systémy: University of York. Cambridge, Anglie: Royal Society of Chemistry. Březen 2008. ISBN 978-0-85404-120-6.
- ^ „Tisková zpráva: Nobelova cena za fyziku z roku 1991“. Nobelprize.org. Nobel Media AB 2014. Web. 5. května 2017.
- ^ de Gennes PG (červenec 2001). "Ultradivided matter". Příroda. 385 (6845): 385. doi:10.1038/35086662. PMID 11473291. S2CID 39983702.
- ^ A b Cliffe, Adam; Hamada, Fumihiko; Bienz, Mariann (2003). „Role rozcuchaných v přemístění Axinu do plazmové membrány během bezkřídlé signalizace“. Aktuální biologie. 13 (11): 960–966. doi:10.1016 / S0960-9822 (03) 00370-1. ISSN 0960-9822. PMID 12781135. S2CID 15211115.
- ^ A b Schwarz-Romond, T. (2005). „Signální efektor Wnt Disheveled vytváří spíše dynamické proteinové sestavy než stabilní asociace s cytoplazmatickými váčky“. Journal of Cell Science. 118 (22): 5269–5277. doi:10.1242 / jcs.02646. ISSN 0021-9533. PMID 16263762. S2CID 16988383.
- ^ A b Schwarz-Romond, Thomas; Fiedler, Marc; Shibata, Naoki; Butler, P. Jonathan G; Kikuchi, Akira; Higuchi, Yoshiki; Bienz, Mariann (2007). "DIX doména Disheveled poskytuje Wnt signalizaci dynamickou polymerací". Přírodní strukturní a molekulární biologie. 14 (6): 484–492. doi:10.1038 / nsmb1247. ISSN 1545-9993. PMID 17529994. S2CID 29584068.
- ^ A b C Schwarz-Romond, T .; Metcalfe, C .; Bienz, M. (2007). „Dynamický nábor axinu rozloženými proteinovými sestavami“. Journal of Cell Science. 120 (14): 2402–2412. doi:10.1242 / jcs.002956. ISSN 0021-9533. PMID 17606995. S2CID 23270805.
- ^ Bilic, J .; Huang, Y.-L .; Davidson, G .; Zimmermann, T .; Cruciat, C.-M .; Bienz, M .; Niehrs, C. (2007). „Wnt indukuje LRP6 signalosomy a podporuje rozcuchanou závislou fosforylaci LRP6“. Věda. 316 (5831): 1619–1622. doi:10.1126 / science.1137065. ISSN 0036-8075. PMID 17569865. S2CID 25980578.
- ^ A b Bienz, Mariann (2014). "Signalosomová sestava doménami, které procházejí dynamickou přímou polymerací". Trendy v biochemických vědách. 39 (10): 487–495. doi:10.1016 / j.tibs.2014.08.006. ISSN 0968-0004. PMID 25239056.
- ^ Kedersha, N .; Anderson, P. (2002). „Stresové granule: místa třídění mRNA, která regulují stabilitu a překladatelnost mRNA“. Transakce biochemické společnosti. 30 (6): 963–969. doi:10.1042 / bst0300963. ISSN 0300-5127. PMID 12440955.
- ^ A b An, S .; Kumar, R .; Sheets, E. D .; Benkovic, S. J. (2008). "Reverzibilní kompartmentalizace de Novo purinových biosyntetických komplexů v živých buňkách". Věda. 320 (5872): 103–106. doi:10.1126 / science.1152241. ISSN 0036-8075. PMID 18388293. S2CID 24119538.
- ^ Walter H, Brooks DE (březen 1995). „Fázová separace v cytoplazmě je v důsledku makromolekulárního shlukování základem pro mikrokompartmentaci“. FEBS Dopisy. 361 (2–3): 135–9. doi:10.1016/0014-5793(95)00159-7. PMID 7698310. S2CID 8843457.
- ^ Walter H, Brooks D, Srere P, eds. (Říjen 1999). Mikrokompartmentace a fázová separace v cytoplazmě. 192 (1. vyd.). Akademický tisk.
- ^ Brooks, D.E. (1999). "Může cytoplazma existovat bez podstupování fázové separace?". Mikrokompartmentace a fázová separace v cytoplazmě. International Review of Cytology. 192. 321–330. doi:10.1016 / S0074-7696 (08) 60532-X. ISBN 9780123645968. ISSN 0074-7696. PMID 10610362.
- ^ Walter, Harry (1999). "Důsledky fázové separace v cytoplazmě". Mikrokompartmentace a fázová separace v cytoplazmě. International Review of Cytology. 192. 331–343. doi:10.1016 / S0074-7696 (08) 60533-1. ISBN 9780123645968. ISSN 0074-7696. PMID 10610363.
- ^ Sear, Richard P. (1999). "Fázové chování jednoduchého modelu globulárních proteinů". The Journal of Chemical Physics. 111 (10): 4800–4806. arXiv:cond-mat / 9904426. doi:10.1063/1.479243. ISSN 0021-9606. S2CID 15005765.
- ^ A b Stradner, Anna; Sedgwick, Helen; Cardinaux, Frédéric; Poon, Wilson C. K .; Egelhaaf, Stefan U .; Schurtenberger, Peter (2004). „Vytváření rovnovážných klastrů v koncentrovaných proteinových roztocích a koloidech“ (PDF). Příroda. 432 (7016): 492–495. doi:10.1038 / nature03109. ISSN 0028-0836. PMID 15565151. S2CID 4373710.
- ^ Iborra FJ (duben 2007). „Může viskoelastická fázová separace, makromolekulární shlukování a koloidní fyzika vysvětlit jadernou organizaci?“. Teoretická biologie a lékařské modelování. 4 (15): 15. doi:10.1186/1742-4682-4-15. PMC 1853075. PMID 17430588.
- ^ A b C Sear, Richard P. (2007). "Rozcuchaný: protein, který funguje v živých buňkách fázovým oddělováním". Měkká hmota. 3 (6): 680. doi:10.1039 / b618126k. ISSN 1744-683X. PMID 32900127.
- ^ Sear, Richard P. (2008). "Fázová separace rovnovážných polymerů proteinů v živých buňkách". Faradayovy diskuse. 139: 21–34, diskuse 105–28, 419–20. doi:10.1039 / b713076g. ISSN 1359-6640. PMID 19048988.
- ^ Dumetz AC, Chockla AM, Kaler EW, Lenhoff AM (leden 2008). „Chování proteinové fáze ve vodných roztocích: krystalizace, separace kapalná-kapalná fáze, gely a agregáty“. Biofyzikální deník. 94 (2): 570–83. doi:10.1529 / biophysj.107.116152. PMC 2157236. PMID 18160663.
- ^ Brangwynne CP, Eckmann CR, Courson DS, Rybarska A, Hoege C, Gharakhani J a kol. (Červen 2009). „Granule Germline P jsou kapalné kapičky, které se lokalizují řízeným rozpouštěním / kondenzací“. Věda. 324 (5935): 1729–32. Bibcode:2009Sci ... 324.1729B. doi:10.1126 / science.1172046. PMID 19460965. S2CID 42229928.
- ^ Larson AG, Elnatan D, Keenen MM, Trnka MJ, Johnston JB, Burlingame AL a kol. (Červenec 2017). „Tvorba kapalných kapiček pomocí HP1α naznačuje úlohu fázové separace v heterochromatinu“. Příroda. 547 (7662): 236–240. Bibcode:2017Natur.547..236L. doi:10.1038 / příroda22822. PMC 5606208. PMID 28636604.
- ^ Nott TJ, Petsalaki E, Farber P, Jervis D, Fussner E, Plochowietz A, et al. (Březen 2015). „Fázový přechod neuspořádaného proteinu nuage generuje ekologicky citlivé membránové organely“. Molekulární buňka. 57 (5): 936–947. doi:10.1016 / j.molcel.2015.01.013. PMC 4352761. PMID 25747659.
- ^ Patel A, Lee HO, Jawerth L, Maharana S, Jahnel M, Hein MY a kol. (Srpen 2015). „Přechod fáze ALS Protein FUS z kapaliny na pevnou látku zrychlený mutací nemoci“. Buňka. 162 (5): 1066–77. doi:10.1016 / j.cell.2015.07.047. PMID 26317470.
- ^ Feric M, Vaidya N, Harmon TS, Mitrea DM, Zhu L, Richardson TM a kol. (Červen 2016). „Souběžné kapalné fáze jsou základem nukleolárních dílčích částí“. Buňka. 165 (7): 1686–1697. doi:10.1016 / j.cell.2016.04.047. PMC 5127388. PMID 27212236.
- ^ Riback JA, Zhu L, Ferrolino MC, Tolbert M, Mitrea DM, Sanders DW a kol. (2019-10-22). "Fázová separace závislá na složení je základem směrového toku skrz jádro". bioRxiv: 809210. doi:10.1101/809210.
- ^ A b Li P, Banjade S, Cheng HC, Kim S, Chen B, Guo L a kol. (Březen 2012). „Fázové přechody v sestavě multivalentních signálních proteinů“. Příroda. 483 (7389): 336–40. Bibcode:2012Natur.483..336L. doi:10.1038 / příroda10879. PMC 3343696. PMID 22398450.
- ^ A b C Banani SF, Lee HO, Hyman AA, Rosen MK (květen 2017). „Biomolekulární kondenzáty: organizátoři buněčné biochemie“. Recenze přírody. Molekulární buněčná biologie. 18 (5): 285–298. doi:10.1038 / nrm.2017.7. PMC 7434221. PMID 28225081. S2CID 37694361.
- ^ Wheeler RJ, Hyman AA (květen 2018). "Ovládání rozdělování na membránou nevázané organely". Filozofické transakce Královské společnosti B: Biologické vědy. 373 (1747): 4666–4684. doi:10.1098 / rstb.2017.0193. PMC 5904305. PMID 29632271.
- ^ Benedek GB (září 1997). „Katarakta jako choroba kondenzující bílkoviny: Proctorova přednáška“. Investigativní oftalmologie a vizuální věda. 38 (10): 1911–21. PMID 9331254.
- ^ Kato, Masato; McKnight, Steven L. (2017). „Cross-β polymerace nízko složitých sekvenčních domén“. Perspektivy Cold Spring Harbor v biologii. 9 (3): a023598. doi:10.1101 / cshperspect.a023598. ISSN 1943-0264. PMC 5334260. PMID 27836835.
- ^ Nakano, Akihiro; Trie, Ryozo; Tateishi, Koichi (2014). „Komplexy glykogen – surfaktant: Chování fází v systému voda / fytoglykogen / dodecylsulfát sodný (SDS)“. Bioscience, biotechnologie a biochemie. 61 (12): 2063–2068. doi:10,1271 / bbb.61.2063. ISSN 0916-8451. PMID 27396883.
- ^ Tanaka T, Benedek GB (červen 1975). "Pozorování proteinové difuzivity v neporušených lidských a hovězích čočkách s aplikací na šedý zákal". Investigativní oftalmologie a vizuální věda. 14 (6): 449–56. PMID 1132941.
- ^ Tanaka T, Ishimoto C, Chylack LT (září 1977). "Fázová separace směsi protein-voda ve studené kataraktu v čočce mladé krysy". Věda. 197 (4307): 1010–1012. doi:10.1126 / science.887936. PMID 887936.
- ^ Ishimoto C, Goalwin PW, Sun ST, Nishio I, Tanaka T (září 1979). "Cytoplazmatická fázová separace při tvorbě galaktosemické katarakty v čočkách mladých krys". Sborník Národní akademie věd Spojených států amerických. 76 (9): 4414–4416. doi:10.1073 / pnas.76.9.4414. PMC 411585. PMID 16592709.
- ^ Broide ML, Berland CR, Pande J, Ogun OO, Benedek GB (červenec 1991). „Binární-kapalná fázová separace roztoků proteinů čoček“. Sborník Národní akademie věd Spojených států amerických. 88 (13): 5660–4. doi:10.1073 / pnas.88.13.5660. PMC 51937. PMID 2062844.
- ^ Benedek GB (září 1997). „Katarakta jako choroba kondenzující bílkoviny: Proctorova přednáška“. Investigativní oftalmologie a vizuální věda. 38 (10): 1911–21. PMID 9331254.
- ^ Schaefer KN, Peifer M (únor 2019). „Regulace signalizace Wnt / Beta-katenin a úloha biomolekulárních kondenzátů“. Vývojová buňka. 48 (4): 429–444. doi:10.1016 / j.devcel.2019.01.025. PMC 6386181. PMID 30782412.
- ^ Gammons M, Bienz M (duben 2018). "Multiproteinové komplexy řídící přenos signálu Wnt". Současný názor na buněčnou biologii. 51 (1): 42–49. doi:10.1016 / j.ceb.2017.10.008. PMID 29153704.
- ^ Muthunayake, Nisansala S .; Tomares, D.T; Childers, W. Seth; Schrader, Jared M. (květen 2020). "Fázově oddělená bakteriální ribonukleoproteinová těla organizují rozpad mRNA". DRÁTY RNA. 11 (3): e1599. doi:10,1002 / wrna.1599. PMID 32445438.
- ^ Dorone, Yanniv; Boeynaems, Steven; Jin, Benjamin; Bossi, Flavia; Flores, Eduardo; Lazarus, Elena; Michiels, Emiel; De Decker, Mathias; Baatsen, Pieter; Holehouse, Alex S .; Sukenik, Shahar; Gitler, Aaron D .; Rhee, Seung Y. (srpen 2020). „Hydratačně závislá fázová separace prionového proteinu reguluje klíčení semen při stresu z vody“. bioRxiv. doi:10.1101/2020.08.07.242172. S2CID 221096771.
- ^ Feric M, Vaidya N, Harmon TS, Mitrea DM, Zhu L, Richardson TM a kol. (Červen 2016). „Souběžné kapalné fáze jsou základem nukleolárních dílčích částí“. Buňka. 165 (7): 1686–1697. doi:10.1016 / j.cell.2016.04.047. PMC 5127388. PMID 27212236.
- ^ Case, Lindsay B .; Ditlev, Jonathon A .; Rosen, Michael K. (2019). „Regulace transmembránové signalizace fázovou separací“. Roční přehled biofyziky. 48 (1): 465–494. doi:10.1146 / annurev-biophys-052118-115534. ISSN 1936-122X. PMC 6771929. PMID 30951647.
- ^ Muschol, Martin; Rosenberger, Franz (1997). „Oddělování fází kapalina-kapalina v přesycených roztokech lysozymu a související tvorba / krystalizace sraženiny“. The Journal of Chemical Physics. 107 (6): 1953–1962. doi:10.1063/1.474547. ISSN 0021-9606.
- ^ Patterson, Matthew; Vogel, Hans J .; Prenner, Elmar J. (2016). „Biofyzikální charakterizace monofilmových modelových systémů složených z vybraných fosfolipidů slzného filmu“. Biochimica et Biophysica Acta (BBA) - Biomembrány. 1858 (2): 403–414. doi:10.1016 / j.bbamem.2015.11.025. ISSN 0005-2736. PMID 26657693.
- ^ A b Tang, Lei (únor 2019). "Optogenetické nástroje osvětlují fázovou separaci". Přírodní metody (Papír). 16 (2): 139. doi:10.1038 / s41592-019-0310-5. PMID 30700901. S2CID 59525729.(vyžadováno předplatné)
- ^ Hyman AA, Weber CA, Jülicher F (11.10.2014). „Oddělování fází kapalina-kapalina v biologii“. Roční přehled buněčné a vývojové biologie. 30 (1): 39–58. doi:10,1146 / annurev-cellbio-100913-013325. PMID 25288112.
- ^ A b C Brangwynne CP, Eckmann CR, Courson DS, Rybarska A, Hoege C, Gharakhani J a kol. (Červen 2009). „Granule Germline P jsou kapalné kapičky, které se lokalizují řízeným rozpouštěním / kondenzací“. Věda. 324 (5935): 1729–32. Bibcode:2009Sci ... 324.1729B. doi:10.1126 / science.1172046. PMID 19460965. S2CID 42229928.
- ^ McSwiggen DT, Mir M, Darzacq X, Tjian R (prosinec 2019). „Hodnocení fázové separace v živých buňkách: diagnostika, výhrady a funkční důsledky“. Geny a vývoj. 33 (23–24): 1619–1634. doi:10,1101 / gad.331520.119. PMC 6942051. PMID 31594803.
- ^ Posey AE, Holehouse AS, Pappu RV (2018). "Fázová separace vnitřně narušených proteinů". Metody v enzymologii. Elsevier. 611: 1–30. doi:10.1016 / bs.mie.2018.09.035. ISBN 978-0-12-815649-0. PMID 30471685.
- ^ Woodruff JB, Hyman AA, Boke E (únor 2018). "Organizace a funkce nedynamických biomolekulárních kondenzátů". Trendy v biochemických vědách. 43 (2): 81–94. doi:10.1016 / j.tibs.2017.11.005. PMID 29258725.
- ^ Boeynaems S, Alberti S, Fawzi NL, Mittag T, Polymenidou M, Rousseau F a kol. (Červen 2018). „Separace proteinových fází: nová fáze buněčné biologie“. Trendy v buněčné biologii. 28 (6): 420–435. doi:10.1016 / j.tcb.2018.02.004. PMC 6034118. PMID 29602697.
- ^ de Swaan Arons, J .; Diepen, G. A. M. (2010). „Nemísitelnost plynů. Systém He-Xe: (krátká komunikace)“. Recueil des Travaux Chimiques des Pays-Bas. 82 (8): 806. doi:10.1002 / recl.19630820810. ISSN 0165-0513.
- ^ de Swaan Arons, J .; Diepen, G. A. M. (1966). „Gas - Gas Equilibria“. J. Chem. Phys. 44 (6): 2322. Bibcode:1966JChPh..44.2322D. doi:10.1063/1.1727043.
- ^ Bayro, Marvin J .; Daviso, Eugenio; Belenky, Marina; Griffin, Robert G .; Herzfeld, Judith (2012). „Amyloid Organelle, Solid-state NMR Evidence for Cross-β Assembly of Gas Vesicles“. Journal of Biological Chemistry. 287 (5): 3479–3484. doi:10.1074 / jbc.M111.313049. ISSN 0021-9258. PMC 3271001. PMID 22147705.
- ^ Schaefer KN, Peifer M (únor 2019). „Regulace signalizace Wnt / Beta-katenin a role biomolekulárních kondenzátů“. Vývojová buňka. 48 (4): 429–444. doi:10.1016 / j.devcel.2019.01.025. PMC 6386181. PMID 30782412.
- ^ Gammons M, Bienz M (duben 2018). "Multiproteinové komplexy řídící přenos signálu Wnt". Současný názor na buněčnou biologii. 51 (1): 42–49. doi:10.1016 / j.ceb.2017.10.008. PMID 29153704.
- ^ Elbaum-Garfinkle S, Kim Y, Szczepaniak K, Chen CC, Eckmann CR, Myong S, Brangwynne CP (červen 2015). „Neuspořádaný protein P granule LAF-1 pohání fázovou separaci na kapičky s nastavitelnou viskozitou a dynamikou“. Sborník Národní akademie věd Spojených států amerických. 112 (23): 7189–94. Bibcode:2015PNAS..112.7189E. doi:10.1073 / pnas.1504822112. PMC 4466716. PMID 26015579.
- ^ Heidenreich M; Georgeson JM; Locatelli E; Rovigatti L; Nandi SK; Steinberg A; Nadav Y; Shimoni E; Safran SA; Doye JPK, Jonathan P. K .; Levy ED (2020-07-13). „Designové proteinové sestavy s laditelnými fázovými diagramy v živých buňkách“. Přírodní chemická biologie. 16 (9): 939–945. doi:10.1038 / s41589-020-0576-z. hdl:11573/1435875. ISSN 1552-4469. PMID 32661377. S2CID 220507058.
Další čtení
- Ditlev JA, Case LB, Rosen MK (listopad 2018). „Kdo je uvnitř a kdo má mimo kompoziční kontrolu nad biomolekulárními kondenzáty“. Journal of Molecular Biology. 430 (23): 4666–4684. doi:10.1016 / j.jmb.2018.08.003. PMC 6204295. PMID 30099028.
- Banani SF, Lee HO, Hyman AA, Rosen MK (květen 2017). „Biomolekulární kondenzáty: organizátoři buněčné biochemie“. Recenze přírody. Molekulární buněčná biologie. 18 (5): 285–298. doi:10.1038 / nrm.2017.7. PMC 7434221. PMID 28225081. S2CID 37694361.
- Hyman AA, Weber CA, Jülicher F (2014). „Oddělování fází kapalina-kapalina v biologii“. Roční přehled buněčné a vývojové biologie. 30: 39–58. doi:10,1146 / annurev-cellbio-100913-013325. PMID 25288112.
- Dolgin E (březen 2018). „Co nás lávové lampy a vinaigretta mohou naučit o buněčné biologii“. Příroda. 555 (7696): 300–302. Bibcode:2018Natur.555..300D. doi:10.1038 / d41586-018-03070-2. PMID 29542707.

