Fosforečnan chromitý - Chromium(III) phosphate
 | |
| Jména | |
|---|---|
| Název IUPAC Fosforečnan chromitý | |
| Ostatní jména Fosforečnan chromitý, monofosforečnan chromitý, ortofosforečnan chromitý, fosforečnan chromitý | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.219 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CrPO4 | |
| Molární hmotnost | 146,97 g / mol |
| Hustota | 4,236 g / cm3[1] |
| Bod tání | 1907 ° C (3 465 ° F; 2180 K)[1] |
| Bod varu | 2671 ° C (4840 ° F; 2944 K) |
| nerozpustný, exotermický modrý roztok[1] | |
| Struktura | |
| monoklinický[1] | |
| Nebezpečí | |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | TWA 1 mg / m3[2] |
REL (Doporučeno) | PEL 0,5 mg / m3[2] |
IDLH (Okamžité nebezpečí) | 250 mg / m3[2] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fosforečnan chromitý popisuje anorganické sloučeniny s chemický vzorec CrPO4.(H2Ó)n, kde n = 0, 4 nebo 6. Všechny jsou hluboce zbarvené pevné látky. Bezvodý CrPO4 je zelený. Hexahydrát CrPO4• 6H2O je fialová.
Syntéza
Fosforečnan chromitý se připravuje zpracováním a kyselina fosforečná řešení oxid chromitý s hydrazin.[3]
Hexahydrát fosforečnanu chromitého
Hexahydrát fosforečnanu chromitého, CrPO4• 6H2O se připravuje redukcí oxidu chromitého, CrO3, s ethanolem v přítomnosti kyseliny ortofosforečné, H3PO4, při teplotách od -24 ° C do +80 ° C.[4]
Mezoporézní fáze
Gelovitý fosforečnan chromitý se připravuje redukcí dichromanu amonného (NH4)2Cr2Ó7za použití ethanolu, CH3COOH a kyselina dusičná, HNO3. Tento proces se provádí v přítomnosti dihydrogenfosforečnanu amonného a močoviny při zvýšené teplotě, kde se jako prostředek pro řízení struktury používá tetradecyltrimethylamoniumbromid (TTBr).[5]
Filmy
Příprava strukturovaného fosforečnanu chromitého se provádí smícháním ekvimolárních roztoků vodného dusičnanu chromitého a fosforečnanu amonného v misce umístěné v uzavřené komoře s nízkoteplotním katalyzátorem par amoniaku difundujícím do roztoku konstantní rychlostí. Po 24 hodinách vyrůstá výsledný fialový film z kapaliny hydrolýzou a polykondenzací, ke které dochází v reakčním prostředí na hranici vzduch / kapalina a film / kapalina. Díky povrchovému napětí je film kompaktní, takže je snadné vložit sklíčko mikroskopu a film zvednout zpod povrchu roztoku. Jakmile se roztok získá, promyje se deionizovanou vodou a ethanolem a poté se suší ve vakuu.[6]
Amorfní fáze
Příprava bezvodého fosforečnanu chromitého začíná mletím směsi 75 mol% oxidu chromitého, Cr2Ó3a 25 mol% čistého hydrogenfosforečnanu amonného (NH4)2HPO4. Tato směs se lisuje na pelety a 24 hodin se zahřívá pod tlakem vzduchu na 400 ° C, aby se odstranil amoniak a voda. Poté nastane sekvence ohřevu na 450 ° C (24 h), 700 ° C (3–24 h), 800 ° C (24 h) a 850 ° C (2–24 h). Poté se směs pelet postupně ochladí.[7]
Fyzikální vlastnosti
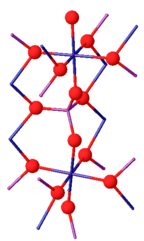
Krystalická struktura
Fosforečnan chromitý může existovat jako dva izomorfy. Jeho β-izoforma je ortorombická s Cmcm prostorová skupina (a = 0,5165, b = 0,7750, c = 0,6131 nm). Struktura se skládá z nekonečných řetězců CrO sdílejících trans edge6 octahedra, které probíhají rovnoběžně s osou c a jsou spojeny PO4 čtyřstěn. Nad 1175 ° C, β-CrPO4 převádí na α-CrPO4. α-CrPO4 je také ortorombický, s Imma prostorová skupina (a = 1,0380, b = 1,2845, c = 0,6278 nm). Struktura se skládá z nekonečné sítě propojených mnohostěnů s osmistěnem CrO6 a čtyřstěnem PO4 sdílejícím společnou hranu. The Cr3+ web tvoří dvojice Cr (2) / Cr (2 ') sdílení hran a sdílí dva rohy se čtyřmi oktaedry Cr (1).[8]
Magnetické vlastnosti
Magnetické vlastnosti β-CrPO4 jsou výsledkem vzdáleností kationtů kationtů podél oktaedrických řetězců, které vedou k silným interakcím přímé výměny a dokonce k vazbě kov-kov. Neutronové difrakční studie ukazují, že spirální momenty v β-CrPO4 jsou kolineární a anti-feromagneticky spojené podél řetězců v rovinách 001, při nízké teplotě (5K, µeff = 2,55µB).[8] Pozorování z difrakční studie ukázaly, že při nízké teplotě (2 K) je α-CrPO4 octahedra CrO6 jednotky vytvářejí nekonečnou trojrozměrnou síť, od které se očekává, že poskytne silné magnetické superexchange vazby Cr-O-Cr s výměnnou cestou přes fosfátovou skupinu. Tyto vazby dodávají struktuře její ant feromagnetickou charakteristiku (Ɵ = -35,1 K, µeff = 3,50 µB), která vede k antiparalelním magnetickým otáčením v rovině, která je kolmá na řetězce oktaedrického CrO6.[9]
Chemické vlastnosti
Výměna iontů
Při vysoké teplotě a pH v rozmezí od 283 do 383 K, respektive pH 4 až 7, byl ekvilibrován roztok KOH / HCl, nerozpustný CrPO.4 pevný a vodný kationtový roztok poskytují sorpční reakci. Studie ukazují, že CrPO4 katalyzuje adsorpci dvojmocných kationtů na svůj amorfní povrch mechanismem kationtové výměny. Mechanismus naznačuje, že ionty H + se uvolňují z pevné fáze do vodné fáze, když se kationy hydrolyzují a adsorbují na povrch katalyzátoru. Snížení pH reakce se tedy používá jako přímý indikátor rychlosti adsorpce v reakci:
Křivka Kurbatovovy rovnice se používá k vztahu uvolňování H+ iont na rovnovážnou konstantu reakce:
kde Kd (l g-1) představuje distribuční koeficient a n je sklon přímky udávající H+/ Mz + stechiometrie výměnné reakce. Za podobných podmínek je selektivita CrPO4 pro dativní kationty následuje pořadí: Pb2+ > Cu2+ > Ni2+ ≅ Cd2+. Zvýšení teploty a pH zvyšuje iontoměničovou reakci.[10]
Fosforečnan chromitý se také používá ke katalyzování kationtové výměny při sorpčních reakcích. Tato katalýza je široce používána při snižování toxicity kovů během čištění životního prostředí. To se uplatnilo při snižování koncentrace olova ve vodním prostředí a v pitné vodě.[10]
aplikace
Antikorozní nátěr
Jako korozivzdorný nátěr kovů se používají barvy obsahující fosforečnan chromitý. Nátěrové hmoty se skládají z vodného kyselého roztoku fosforečnanu chromitého, který se při aplikaci na kovy silně používané při výrobě a použití, jako je zinek, slitiny zinku, hliník a slitiny hliníku, mění na konzistentní film. Aplikační metody zahrnují galvanické pokovení, ponoření nebo nastříkání roztoku na povrch podkladu.[11]
Katalyzátor
Fosforečnan chromitý má v polymerním průmyslu různé aplikace. Kombinovaný fosforečnan hlinitý a chromitý je široce používán jako katalyzátor při alkylaci aromatických uhlovodíků za použití alkoholů, jako je methylace toluenu za použití methanolu. Alkohol je dehydratován na ether, zatímco alkylem substituovaný produkt může být použit jako meziprodukt při výrobě syntetických vláken, jako je poly (ethylen tereftalát).[12]
Polymer
Předúprava fosforečnanem chromitým (III) se také používá jako laminovaná konstrukce k tlumení vibrací a hluku v motoru.[13]
Toxicita
Přestože je fosforečnan chromitý těžko rozpustný ve vodě, nadměrné vystavení této látce prostředí, průmyslovému prostředí a oděrky z kovů na kovových implantátech mohou mít škodlivé účinky. Toxicita fosforečnanu chromitého závisí na délce expozice, koncentraci fosforečnanu chromitého, vstupních cestách přes membránovou bariéru a uvolňování trojmocného chromového iontu z fosforečnanu chromitého. Makrofágové buňky v těle vystavené působení fosforečnanu chromitého pohltí nebo fagocytují sloučeninu do jejího endosomálního a lysozomálního prostředí, které je kyselé. To katalyzuje proteolytickou reakci, která vede k dávkově závislému zvýšení uvolňování chromu (III) v postižených buňkách. The Cr3+ ionty mají toxické účinky na proteiny cytosolu a mitochondrií oxidační úpravou jejich chemických vlastností, čímž znemožňují výkon jejich funkcí. Jsou ovlivněny proteiny s vysokou afinitou ke kovům, jako je enoláza, enzymy katalázy a hemoglobin, molekulární transportéry feritinu. To může nakonec vést k nefrotoxicitě, reprodukční a vývojové toxicitě v důsledku poškození tkání, nekrózy a zánětu.[14]
Další čtení
- Mustafa, S .; Murtaza, S .; Naeem, A .; Farina, K. (2010). "Sorpce iontů na Pb2 + iontech na CrPO4". Environmentální technologie. 26 (4): 353–359. doi:10.1080/09593332608618544. PMID 15906486.
Viz také
- Chrom (III)
- Chrom (IV)
- Fosforečnan hlinitý
- Kyselina chromová
- Chrome kamenec
- Chromanový konverzní povlak
externí odkazy
Reference
- ^ A b C d Brauer, Georg (1965) [1962]. Handbuch Der Präparativen Anorganischen Chemie [Příručka preparativní anorganické chemie] (v němčině). 2. Stuttgart; New York, New York: Ferdinand Enke Verlag; Academic Press, Inc. str. 1341. ISBN 978-0-32316129-9. Citováno 2014-01-10.
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0141". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ F. Hein a S. Herzog (1963). „Chromium ortofosforečnan“. V G. Brauer (ed.). Handbook of Preparative Anorganic Chemistry, 2. vyd. 1. NY, NY: Academic Press. str. 1364–5.CS1 maint: používá parametr autoři (odkaz)
- ^ Vasovic, Dušanka D .; Stojakovic, Djordje R. (2003). "Příprava a vlastnosti některých amorfních fosforečnanů chromitých". Časopis nekrystalických pevných látek. 101 (1): 129–132.
- ^ Tarafdar, A .; Biswas, S .; Pramanik N.K; Pramanik P. "Syntéza fosforečnanu mezoporézního chromu netradičním způsobem sol-gel." Mikroporézní a mezoporézní materiály, 2006, 89, 1-3, str. 204-208.
- ^ Gomm, J.R .; Schwenzer B .; Morse D.E. „Texturované filmy z fosforečnanu chromitého syntetizované katalýzou při nízkoteplotní difúzi par.“ Solid State Sciences, 2007, 9, 5, str. 429-431
- ^ Bosacka, M .; Jakubus, P .; Rychowska-Himmel, I. (2007). "Získání fosforečnanu chromitého (V) v pevném stavu a jejich tepelné stability". Journal of Thermal Analysis and Calorimetry. 88 (1): 133–137. doi:10.1007 / s10973-006-8050-z.
- ^ A b Attfield, J.P .; Battle, P.D .; Anthony, K.C .; Johnson, D.C. (1988). "Magnetické struktury a vlastnosti alfa-CrPO4 a alfa-CrAsO ". Anorganická chemie. 28 (7): 1207–1213. doi:10.1021 / ic00306a004.
- ^ Attfield, J.P .; Battle, P.D .; Anthony, K.C. „Spirálová magnetická struktura β-chromium (III) ortofosforečnanu (β-CrPO4)." Journal of Solid State Chemistry 1985, 57, str. 357-361
- ^ A b Mustafa, S .; Murtaza, S .; Naeem, A .; Farina, K. (2010). „Sorpce iontové výměny Pb2+ Ions On CrPO4". Environmentální technologie. 26 (4): 353–359. doi:10.1080/09593332608618544. PMID 15906486.
- ^ Ludwig, R .; Recker, A. "Vodný, kyselý, vodný, kyselý roztok pro přeměnu chromu (III)." US20070243397 A1, 2007. Columbia Chemical Corporation, Ohio, https://www.google.com/patents/US20070243397 (zpřístupněno 12. dubna 2015)
- ^ Johnson, M. M.; Nowack, G.P. „Fosforečnan chromitý jako katalyzátor alkylace.“ Patent USA 4543436 A, 24. září 1985.https://www.google.com/patents/US4543436 (zpřístupněno 12. dubna 2015)
- ^ Swanson, R .; Hufnagel, A. "Laminovaná viskoelastická tlumicí struktura a způsob jejich výroby." USA 20090252989 A1, 8. října 2009. https://www.google.com/patents/US20090252989?dq=Laminated+viscoelastic+damping+structure&hl=cs&sa=X&ei=u3QqVd0mg6uiBLWzgVA&ved=0CB4Q6AEwAA (zpřístupněno 12. dubna 2015); SciFinder Scholar 2009: 20090252989 A1
- ^ Scharf, B .; Clement, C.C .; Zolla, V .; Perino, G .; Yan, B .; Elci, S.G .; Purdue, E .; Goldring, S .; Macaluso, F .; Cobelli, N; Vachet, R.W; Santambrogio, L. (2015). „Molekulární analýza toxicity související s chromem a kobaltem“. Vědecké zprávy. 2014: 5729. doi:10.1038 / srep05729. PMC 4103093. PMID 25034144.
