Mozkový organoid - Cerebral organoid - Wikipedia
A mozkový organoidnebo mozkový organoid, popisuje uměle pěstovaný, in vitro, miniaturní orgán připomínající mozek. Intelektuální organoidy jsou vytvořeny kultivací pluripotentní kmenové buňky v trojrozměrném rotačním bioreaktor a vyvíjejí se v průběhu měsíců.[1] Mozek je nesmírně složitý systém heterogenních tkání a skládá se z různorodého souboru neurony. Tato složitost způsobila, že studium mozku a pochopení toho, jak funguje obtížný úkol v neurovědě, zejména pokud jde o neurodegenerativní onemocnění. Účel vytvoření in vitro neurologickým modelem je studium těchto onemocnění ve více jednoduchém a variabilním prostoru. Tento 3D model nemá mnoho potenciálu in vivo omezení. Měnící se fyziologie mezi lidskými a jinými savčími modely omezuje rozsah studia neurologických poruch. Mozkové organoidy jsou syntetizované tkáně, které obsahují několik typů nervových buněk a mají anatomické rysy, které rekapitulují oblasti mozkové kůry pozorované v mozku.[2] Mozkové organoidy jsou nejvíce podobné vrstvám neuronů nazývaných kůra a choroidalis plexus. V některých případech struktury podobné sítnice, mozkové pleny a hipokampus může tvořit.[1][3] Kmenové buňky mají potenciál dorůst do mnoha různých typů tkání a jejich osud závisí na mnoha faktorech. Níže je obrázek ukazující některé chemické faktory, které mohou vést kmenové buňky k diferenciaci na různé nervové tkáně; od té doby byla zveřejněna podrobnější tabulka generování specifické organoidní identity.[4] Podobné techniky se používají na kmenových buňkách používaných k pěstování mozkových organoidů.[2]
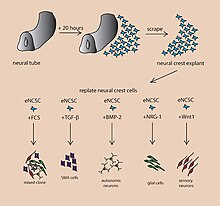
Vývoj modelu
Pomocí člověka pluripotentní kmenové buňky vytvořit in vitro mozkové organoidy umožňují vědcům shrnout současné vývojové mechanismy lidské nervové tkáně a také studovat kořeny lidských neurologických onemocnění. Mozkové organoidy jsou vyšetřovacím nástrojem používaným k pochopení toho, jak funguje patologie nemoci. Tyto organoidy lze použít při současných experimentech in vitro metody jsou příliš jednoduché a zároveň jsou více použitelné pro člověka, než by mohly být modely hlodavců nebo jiných savců. Historicky byly zásadní průlomy v tom, jak mozek funguje, výsledkem studia poranění nebo poruchy funkce lidského mozku, což vedlo k pochopení toho, jak fungují oblasti mozku. An in vitro model lidského mozku by umožnil další vlnu v porozumění lidskému mozku.[1][5]
Kultivační metody
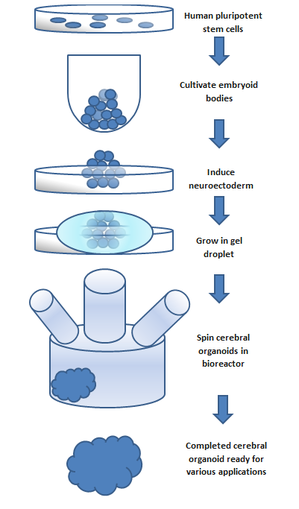
Chcete-li udělat organoid, embryoid (tkáň, která má nějaké embryonální funkce) pěstované z přírodních kmenové buňky se používá. Embrya mají tři vrstvy: endoderm, mezoderm a ektoderm. Každá se mění na různé části těla. The nervový systém roste z ektodermu (což také přispívá zubní sklovina a pokožka ).[5] Ektodermální buňky se umístily do gelových kapiček a rotovaly v živném bujónu bioreaktor, který podporoval růst buněk, aniž by se formoval nádobou. Po deseti dnech se organoid vyvinul neurony. Po 30 dnech se zobrazily oblasti podobné částem mozku. Chybí a dodávka krve mozkové organoidy dosahují průměru asi 4 mm a mohou trvat rok i více.[3] Obecný postup lze rozdělit do 5 kroků. Kultivují se první lidské pluripotentní kmenové buňky. Poté je jim dovoleno kultivovat se do embryoidní tělo. Poté se buněčná kultura indukuje za vzniku a neuroectoderm. The neuroectoderm se pak pěstuje v a matrigel kapička. Matrigel poskytuje živiny a neuroectoderm se začne množit a růst. Je důležité si uvědomit, že zatímco se tyto buňky samy organizují, replikace specifických oblastí mozku v protějšcích mozkových organoidů se dosahuje přidáním extracelulárních signálů do organoidního prostředí během různých fází vývoje; Bylo zjištěno, že tyto signály vytvářejí změny ve vzorcích diferenciace buněk, což vede k rekapitulaci požadované oblasti mozku.[4] Normálně, SMAD inhibice se používá v obvyklých procesech kultivace mozkových organoidů; nedávné studie ukazují, že inhibice tohoto procesu generuje mikroglie v mozkových organoidech.[6] Je důležité si uvědomit, že nedostatek vaskulatury omezuje velikost, kterou může organoid růst. Toto bylo hlavní omezení ve vývoji organoidů; v poslední době však nové metody využívající předení bioreaktor umožnily zvýšení dostupnosti živin pro buňky uvnitř organoidu. Tento poslední krok byl klíčovým průlomem ve vývoji organoidů.[7] Spřádací bioreaktory se stále častěji používají v aplikacích buněčných kultur a růstu tkání. Reaktor je schopen dodávat rychleji doby zdvojnásobení buněk, ve srovnání se staticky kultivovanými buňkami, zvýšená expanze buněk a zvýšené komponenty extracelulární matrice.[8]
Toto byla původní metoda popsaná v Madeline Lancasterová [1] a od té doby byl vyvinut a vylepšen. Novější metody umožňují vývoj cerebrovaskulární organoidy,[9] a mikročerpadla zajišťující cirkulaci skrz ně se vyvíjejí, jak je vysvětleno v tohle video od Dr. George M. Church.
Součásti
Diferenciace
Ukázalo se, že mozkové organoidy pěstované metodou 3D kultivace v rotujícím bioreaktoru se diferencují na různé typy nervových tkání, jako je optický kalíšek, hipokampus, ventrální části teleencefelonu a hřbetní kůra.[10] Nervové kmenové / progenitorové buňky jsou jedinečné, protože se dokáží samy obnovovat a jsou multipotentní. To znamená, že mohou generovat neurony a gliové buňky, které jsou dvěma hlavními složkami nervových systémů. Osud těchto buněk je řízen několika faktory, které ovlivňují proces diferenciace. Prostorové umístění a časové atributy nervových progenitorových buněk mohou ovlivnit, zda buňky tvoří neurony nebo gliové buňky. Další diferenciace je poté řízena extracelulárními podmínkami a buněčnou signalizací.[11] Přesné podmínky a podněty nezbytné k diferenciaci nervových progenitorových buněk na specifické nervové tkáně, jako je hipokampální tkáň, optický nerv, mozková kůra atd., Nejsou známy. Předpokládá se, že mozkové organoidy lze použít ke studiu vývojových mechanismů těchto procesů.[7]
Genový výraz
K testování, zda se nervové progenitorové buňky a kmenové buňky diferencují na specifické nervové tkáně, lze otestovat několik genových markerů. Dva markery, které jsou přítomny během pluripotentních fází, jsou ŘÍJEN 4 a NANOG. Tyto dva markery se během vývoje organoidu zmenšily. Značky neurální identity, které zaznamenávají úspěšnou neurální indukci, SOX1 a PAX6, jsou během vývoje organoidů upregulovány. Tyto změny v expresi podporují argumentaci pro samostatně vedenou diferenciaci mozkových organoidů.[1] Lze testovat také značky pro přední mozek a zadní mozek. Značky předního mozku FOXG1 a SIX3 jsou vysoce exprimovány během vývoje organoidů. Značky zadního mozku EGR2 a ISL1 vykazují časnou přítomnost, ale pokles v pozdějších fázích. Tato nerovnováha směrem k vývoji předního mozku je podobná vývojové expanzi tkáně předního mozku ve vývoji lidského mozku.[1] Chcete-li otestovat, zda se organoidy vyvíjejí ještě dále v regionální specifikaci, genové markery pro mozková kůra a týlní lalok byly testovány. Mnoho oblastí, které mají značku předního mozku FOXG1, označující je jako regiony s morfologií mozkové kůry, byly také pozitivní na marker EMX1, který indikuje dorzální kortikální identitu. Tyto konkrétní oblasti mohou být ještě dále specifikovány značkami AUTS2, TSHZ2, a LMO4 přičemž první představuje mozkovou kůru a dvě poté, co představuje týlní lalok.[1] Genetické markery pro hipokampus, ventrální přední mozek a choroidní plexus jsou také přítomny v mozkových organoidech, avšak celkové struktury těchto oblastí ještě nebyly vytvořeny.
Organizace
Mozkové organoidy také vlastní funkční mozkové kortikální neurony. Tyto neurony se musí tvořit na radiálně uspořádané kortikální desce. Značka TBR1 je přítomen v preplate, předchůdci kortikální destičky, a je přítomen spolu s MAP2, neuronální marker, u 30denních mozkových organoidů. Tyto markery jsou indikativní pro bazální nervovou vrstvu podobnou preplate. Tyto buňky také apikálně sousedí s neutrální zónou a jsou navinout + pozitivní, což naznačuje přítomnost buněk Cajal-Retzius. The Cajal-Retziusovy buňky jsou důležité pro generování kortikální architektury dlahy.[7] Kortikální deska je obvykle generována naruby, takže později narozené neurony migrují do horních povrchových vrstev. Tato organizace je také přítomna v mozkových organoidech na základě testování genetických markerů. Neurony, které se narodily brzy, mají značku CTIP2 a jsou umístěny v sousedství TBR1 vykazující buňky preplate. Pozdní neurony se značkami SATB2 a BRN2 jsou umístěny v povrchové vrstvě, dále od preplate než časně narozené neurony, což naznačuje tvorbu kortikální vrstvy. Navíc po 75 dnech formování vykazují mozkové organoidy rudimentární okrajovou zónu, oblast chudou na buňky. Tvorba vrstvené kortikální destičky je u mozkových organoidů velmi zásadní a naznačuje, že organoidům chybí podněty a faktory, které by vyvolaly vznik organizace vrstvy II-VI.[1] Mozkové organoidní neurony však mohou tvořit axony, jak ukazuje GFP barvení. Ukázalo se, že GFP značené axony mají komplexní větvení a tvorbu růstového kužele. Navíc zobrazování vápenatých barviv ukázalo, že mozkové organoidy mají Ca2+ oscilace a spontánní rázy vápníku v jednotlivých buňkách. Vápníkovou signalizaci lze posílit pomocí glutamát a potlačen skrz tetrodotoxin.[1]
Interakce s prostředím
Není zcela pochopeno, jak jsou jednotlivé lokalizované tkáně tvořené kmenovými buňkami schopné koordinovat se s okolními tkáněmi a vyvinout se do celého orgánu.[12] Ukázalo se však, že většina diferenciace tkání vyžaduje interakce s okolními tkáněmi a závisí na difuzních indukčních faktorech, které buď inhibují nebo podporují různé diferenciace a fyzickou lokalizaci.[12] Diferenciace mozkových organoidů je poněkud lokalizována. Dříve zmíněné markery pro přední mozek a zadní mozek jsou fyzicky lokalizovány a objevují se v klastrech. To naznačuje, že místní podněty se uvolní, jakmile se jedna nebo více buněk diferencuje na konkrétní typ, na rozdíl od náhodné dráhy v tkáni. Značky pro subšpecifikaci kortikálních laloků, prefrontální kůry a týlního laloku jsou také fyzicky lokalizovány. Avšak hipokampus a buňky ventrálního předního mozku nejsou fyzicky lokalizovány a jsou náhodně umístěny přes mozkový organoid.[1] Mozkovým organoidům chybí krevní cévy a jejich velikost je omezena příjmem živin v nejvnitřnějších buňkách. Spřádací bioreaktory a pokročilé techniky lešení 3D jsou schopny zvětšit velikost organoidů, i když je pravděpodobné, že integrace systémů dodávání živin in vitro vyvolá další velký skok ve vývoji mozkových organoidů.[13]
Testy
Mozkové organoidy mají potenciál fungovat jako model, pomocí kterého lze studovat onemocnění a genovou expresi.[14] K vyhodnocení mozkové organoidní tkáně a vytvoření organoidů modelování dané choroby nebo stavu vývoje jsou však zapotřebí diagnostické nástroje.[15] Transkriptomová analýza byl použit jako test k vyšetření patologie mozkových organoidů odvozených od jednotlivých pacientů.[16] Dodatečně, Testy TUNEL byly použity ve studiích jako hodnotící marker apoptózy v mozkových organoidech.[17] Mezi další testy používané k analýze mozkových organoidů patří následující:
Genetické modifikace
Mozkové organoidy lze použít ke studiu genové exprese pomocí genetických modifikací.[14] Míra, v jaké jsou tyto genetické modifikace přítomny v celém organoidu, závisí na tom, v jaké fázi vývoje se mozkový organoid nachází, když jsou tyto genetické modifikace provedeny; čím dříve jsou tyto modifikace provedeny, například když je mozkový organoid ve stádiu jedné buňky, tím je pravděpodobnější, že tyto úpravy ovlivní větší část buněk v mozkovém organoidu.[14] Míra, v jaké jsou tyto genetické modifikace přítomny v mozkovém organoidu, závisí také na procesu, kterým jsou tyto genetické modifikace prováděny. Pokud je genetická informace podávána do genomu jedné mozkové organoidní buňky pomocí strojů, pak genetická modifikace zůstane přítomna v buňkách vzniklých replikací.[14] Crispr / Cas 9 je metoda, kterou lze provést tuto dlouhodobou genetickou modifikaci.[14] Systém zahrnující použití transpozonů byl také navržen jako prostředek pro generování dlouhotrvajících genetických modifikací; avšak míra, do jaké mohou transpozony interagovat s buněčným genomem, se může u jednotlivých buněk lišit, což by vytvářelo variabilní expresivitu mezi mozkovými organoidními buňkami.[14] Pokud se však genetická modifikace provádí vložením „genetického nákladu“ (například skrz Virus spojený s adeno / elektroporace metody) pak bylo zjištěno, že genetická modifikace se stává méně přítomnou při každém kole dělení buněk v mozkových organoidech.[14]
Výpočtové metody
Bylo požadováno použití výpočetních metod jako prostředku ke zlepšení procesu kultivace mozkových organoidů; byl také požadován vývoj výpočetních metod za účelem poskytnutí nezbytných podrobných vykreslení různých složek mozkového organoidu (jako je buněčná konektivita), které současné metody nejsou schopny poskytnout.[15] Programování určené k modelování podrobné morfologie mozkových organoidů dosud neexistuje.[15]
Aplikace
Existuje mnoho potenciálních aplikací pro použití mozkových organoidů, jako např potenciál osudu buněk, buněčná substituční terapie a testy genomu specifické pro buněčný typ.[13] Mozkové organoidy také poskytují jedinečný pohled na načasování vývoje nervových tkání a lze je použít jako nástroj ke studiu rozdílů mezi druhy.[13] Další potenciální aplikace pro mozkové organoidy zahrnují:[13]
Morfogeneze tkáně
Tkáňová morfogeneze s ohledem na mozkové organoidy pokrývá, jak se tvoří nervové orgány obratlovců. Mozkové organoidy mohou sloužit jako in vitro nástroje ke studiu formace, její modulaci a dalšímu porozumění mechanismům, které ji řídí.[13]
Migrační testy
Mozkové organoidy mohou pomoci ke studiu migrace buněk. Nervové gliové buňky pokrývají širokou škálu nervových buněk, z nichž některé se pohybují kolem neuronů. Faktory, které řídí jejich pohyby, stejně jako neurony obecně, lze studovat pomocí mozkových organoidů.[5]
Sledování klonální linie
Klonální stopování je součástí mapování osudu, kde je linie diferencovaných tkání vysledována k pluripotentním předkům. Uvolněné místní podněty a mechanismus diferenciace lze studovat pomocí mozkových organoidů jako modelu.[13] Genetické modifikace v mozkových organoidech by mohly sloužit jako prostředek k dosažení sledování linie.[14]
Transplantace
Mozkové organoidy lze použít k pěstování konkrétních oblastí mozku a jejich transplantaci do oblastí neurodegenerace jako terapeutická léčba.[18][19] Mohou se spojit s hostitelem vaskulatura a buď imunologicky tichý.[20] V některých případech by musely být nejprve upraveny genomy těchto mozkových organoidů.[16] Nedávné studie dokázaly dosáhnout úspěšné transplantace a integrace mozkových organoidů do mozků myší; po transplantaci byl také pozorován vývoj buněčné diferenciace a vaskularity.[21] Mozkové organoidy mohou sloužit jako základ pro transplantaci a přestavbu v lidském mozku kvůli podobnosti struktury.[21]
Testování drog
Mozkové organoidy lze použít jako jednoduché modely složitých mozkových tkání ke studiu účinků léků a jejich screeningu na počáteční bezpečnost a účinnost. Testování nových léků na neurologická onemocnění může také vyplynout z této metody aplikace léku vysokovýkonný screening metody pro mozkové organoidy.[16]
Studie nemocí
Organoidy lze použít ke studiu rozhodujících počátečních stádií vývoje mozku, testování léků, a protože mohou být vyrobeny ze živých buněk, ke studiu jednotlivých pacientů.[3] Kromě toho by mohl být vývoj vaskularizovaných mozkových organoidů použit v budoucnu k vyšetřování terapie mozkové příhody.[22]
Virus Zika
Virus Zika Bylo prokázáno, že má teratogenní účinky způsobující poruchy neurologického vývoje plodu. Mozkové organoidy byly ve studiích použity k pochopení procesu, kterým virus Zika ovlivňuje mozek plodu a v některých případech způsobuje mikrocefalii.[16][17] Bylo zjištěno, že mozkové organoidy infikované virem Zika mají menší velikost než jejich neinfikované protějšky, což je odrazem mikrocefalie plodu.[16][17] Zvýšená apoptóza byla také zjištěna u mozkových organoidů infikovaných virem Zika.[23] Další studie zjistila, že populace neurálních progenitorových buněk (NPC) byla v těchto vzorcích výrazně snížena. Dvěma metodami, kterými byly populace NPC redukovány, byla zvýšená buněčná smrt a snížená buněčná proliferace. TLR3 v těchto infikovaných organoidech byla identifikována upregulace receptoru. Ukázalo se, že inhibice tohoto receptoru TLR3 částečně zastavila některé z účinků vyvolaných přípravkem Zika.[24] Dále bylo zjištěno, že velikost lumenů byla zvýšena u organoidů infikovaných virem Zika.[16][17] Výsledky zjištěné při studiu mozkových organoidů infikovaných virem Zika v různých stádiích zrání naznačují, že časná expozice u vyvíjejících se plodů může způsobit větší pravděpodobnost neurologických vrozených vad souvisejících s virem Zika.[17]
Kokain
Bylo také prokázáno, že kokain má teratogenní účinky na vývoj plodu. Mozkové organoidy byly použity ke studiu, které enzymové izoformy jsou nezbytné pro neurologické poruchy plodu způsobené užíváním kokainu během těhotenství.[16] Byl stanoven jeden z těchto enzymů cytochrom P450 izoforma CYP3A5.[16]
Mikrocefalie
V jednom případě mozkový organoid vyrostl z pacienta s mikrocefalie prokázal související příznaky a odhalil, že zjevnou příčinou je příliš rychlý vývoj, následovaný pomalejším růstem mozku. Mikroencefalie je vývojový stav, při kterém zůstává mozek poddimenzovaný, produkuje poddimenzovanou hlavu a oslabuje. Mikrocefalie není vhodná pro modely myší, které tento stav nereplikují.[3] Předpokládá se, že primární forma onemocnění je způsobena homozygotní mutací v mikrocefalin gen. Toto onemocnění je obtížné reprodukovat na myších modelech, protože u myší chybí vývojová stadia zvětšení mozková kůra které lidé mají. Nemoc, která ovlivňuje tento vývoj, by bylo přirozeně nemožné ukázat na modelu, který to nemá na začátek.[25] Chcete-li použít mozkové organoidy k modelování mikrocefalie člověka, jedna skupina vědců vzala fibroblasty kůže pacientů a přeprogramovala je pomocí čtyř dobře známých faktorů přeprogramování. Tyto zahrnují ŘÍJEN 4, SOX2, MOJE C a KLF4. Přeprogramovaný vzorek bylo možné klonovat do indukovaných pluripotentních kmenových buněk. Buňky byly kultivovány do cerebrálního organoidu postupem popsaným v části vytváření mozkových organoidů níže. Výsledný organoid měl snížený počet nervových progenitorových buněk a menších tkání. Navíc tkáně odvozené od pacienta vykazovaly méně a méně časté neuroepiteliální tkáně vyrobené z progenitorů, snížené radiální gliové kmenové buňky a zvýšené neurony. Tyto výsledky naznačují, že základní mechanismus mikrocefalie je způsoben tím, že se buňky předčasně diferencují na neurony a zanechávají deficit radiálních gliových buněk.[1]
Alzheimerova choroba
Alzheimerova choroba patologie byla také modelována mozkovými organoidy.[26] Pluripotentní kmenové buňky postiženého jedince byly použity ke generování mozkových organoidů a poté porovnány s kontrolními modely syntetizovanými od zdravých jedinců. Bylo zjištěno, že v postižených modelech struktury podobné struktuře plakety zapříčiněno amyloid beta proteiny a neurofibrilární spleti, které způsobují příznaky choroby.[27] Předchozí pokusy modelovat to tak přesně byly neúspěšné, protože léky byly vyvíjeny na základě účinnosti v předklinických modelech, jako jsou myši, které neměly žádný účinek v lidských studiích.[28]
Onemocnění autistického spektra
Mozkové organoidy lze také použít ke studiu poruch autistického spektra.[29] V jedné studii byly mozkové organoidy kultivovány z buněk odvozených od pacientů s makrocefalií s ASD.[29] Bylo zjištěno, že tyto mozkové organoidy odrážejí charakteristiky typické pro ASC související makrocefalický fenotyp nalezený u pacientů.[29] Kultivací mozkových organoidů od pacientů s ASD s makrocefalií bylo možné navázat spojení mezi určitými genovými mutacemi a fenotypovou expresí.[29] Autismus byl také studován porovnáním zdravých veršů ovlivněných syntetizovaných mozkových organoidů.[30] Pozorování těchto dvou modelů ukázalo nadměrnou expresi transkripčního faktoru FOXG1 který produkoval větší množství GABAergický inhibiční neurony v postižených modelech. Význam tohoto použití mozkových organoidů spočívá v tom, že přidal velkou podporu hypotéze excitační / inhibiční nerovnováhy[31] který, pokud se prokáže jako pravdivý, by mohl pomoci identifikovat cíle pro léky, aby bylo možné nemoc léčit.
Pole epigenetika a jak Methylace DNA může ovlivnit vývoj ASD byl v posledních letech také zajímavý. Tradiční metoda studia posmrtných nervových vzorků od jedinců s ASD představuje mnoho výzev, proto byly navrženy mozkové organoidy jako alternativní metoda studia potenciálního účinku, který mohou mít epigenetické mechanismy na vývoj autismu. Toto použití modelu mozkových organoidů ke zkoumání ASD a epigenetických vzorců může poskytnout pohled na epigenetické vývojové časové osy. Je však důležité si uvědomit, že podmínky, ve kterých jsou mozkové organoidy pěstovány, mohou ovlivnit genovou expresi a následně ovlivnit pozorování prováděná pomocí tohoto modelu. Kromě toho existují obavy ohledně variability v mozkových organoidech kultivovaných ze stejného vzorku.[32] Je rovněž nutný další výzkum rozsahu a přesnosti, kterou mozkové organoidy rekapitulují epigenetické vzorce nalezené v primárních vzorcích.[32]
Předčasná hypoxie / ischemie
Předčasné hypoxické poškození je i nadále obtížné studovat z důvodu omezené dostupnosti mozkových tkání lidského plodu a nedostatečných zvířecích modelů ke studiu lidské kortikogeneze. Mozkový organoid lze použít k modelování prenatální patofyziologie a k porovnání citlivosti různých typů nervových buněk na hypoxii během kortikogeneze. Zdá se, že meziproduktové progenitory jsou obzvláště ovlivněny kvůli rozvinuté cestě proteinové odpovědi.[33] Rovněž bylo pozorováno, že hypoxie vedla k apoptóze v mozkových organoidech, přičemž byly zvláště ovlivněny vnější radiální glia a neuroblasty / nezralé neurony.[34]
Glioblastomy
Tradiční způsob studia glioblastomy přijít s omezeními. Jedním příkladem takových omezení by byla omezená dostupnost vzorku. Kvůli těmto výzvám, které přicházejí s použitím tradičnějšího přístupu, byly mozkové organoidy použity jako alternativní prostředek k modelování vývoje rakoviny mozku. V jedné studii byly pomocí CRISPR CAS-9 simulovány mozkové organoidy, aby odrážely vlastnosti podobné nádoru. U těchto geneticky pozměněných modelů bylo pozorováno zvýšené dělení buněk. Mozkové organoidy byly také použity ke studiu na myších modelech tumorigeneze a invazivnost. Současně je růst nádorů mozku ovlivňován faktory prostředí, které dosud nejsou replikovatelné v modelech mozkových organoidů. Ukázalo se, že mozkové organoidy poskytují pohled na dysregulaci genů odpovědných za vývoj nádoru.[35]
Omezení
Mozkové organoidy jsou upřednostňovány před jejich protějšky 2D buněčných kultur, protože mohou lépe odrážet strukturu lidského mozku a protože do určité míry mohou odrážet vývoj neokortexu plodu po delší dobu. I když mozkové organoidy mají velký potenciál, jejich kultivace a vývoj přichází s omezeními a oblastmi pro zlepšení.[36] Například vytvoření jednoho mozkového organoidu trvá několik měsíců a metody použité k jejich analýze jsou také časově náročné.[21] Mozkové organoidy navíc nemají struktury typické pro lidský mozek, jako je hematoencefalická bariéra.[36] To omezuje typy nemocí, které lze studovat. Mezi další omezení patří:
Nekrotická centra
Až donedávna bylo zjištěno, že centrální část organoidů je nekrotický kvůli kyslíku a živinám, které nejsou schopny dosáhnout této nejvnitřnější oblasti.[22][15] To ukládá omezení fyziologické použitelnosti mozkových organoidů.[15] Kvůli tomuto nedostatku kyslíku a živin mají nervové progenitorové buňky omezený růst.[37] Nedávná zjištění však naznačují, že v procesu kultivace cerebrálního organoidu lze nekrotickému centru zabránit použitím fluidních zařízení ke zvýšení expozice organoidů médiím.[15]
Spolehlivost v generaci
Bylo zjištěno, že struktura mozkových organoidů napříč různými kulturami je proměnlivá; standardizační postup zajišťující jednotnost se dosud nestal běžnou praxí.[22] Budoucí kroky v revizi produkce mozkových organoidů by zahrnovaly vytvoření metod k zajištění standardizace generace mozkových organoidů.[22] Jeden takový navrhovaný krok zahrnuje regulaci složení a tloušťky gelu, ve kterém jsou kultivovány mozkové organoidy; to by mohlo přispět k větší spolehlivosti produkce mozkových organoidů.[15] Navíc je zavedena variabilita v generování mozkových organoidů kvůli rozdílům v použitých kmenových buňkách.[16] Tyto rozdíly mohou vzniknout z různých výrobních metod nebo rozdílů hostitele.[16] Zvýšený metabolický stres byl také nalezen v organoidech. Bylo zjištěno, že tento metabolický stres omezuje specificitu organoidů.[6] Další kroky ke zefektivnění kultivace organoidů zahrnují analýzu více než jednoho vzorku najednou.[21]
Splatnost
V současné době je vývoj zralých synapsí v mozkových organoidech omezený kvůli použitým médiím.[22] Navíc, zatímco bylo prokázáno, že se v mozkových organoidech vyvíjejí některé elektrofyziologické vlastnosti, bylo prokázáno, že kultivace samostatných a odlišných organoidních oblastí omezuje zrání těchto elektrofyziologických vlastností. Modelování elektrofyziologických neurodevelopmentálních procesů typických pro vývoj později v neurodeveopmentální časové ose, jako např. synaptogeneze, dosud není doporučeno v modelech mozkových organoidů.[6] Vzhledem k tomu, že mozkové organoidy odrážejí to, co se děje během vývoje plodu, existuje obava z toho, jak se u nich projevují nemoci s pozdním nástupem. Budoucí vylepšení zahrnují vývoj způsobu rekapitulace neurodegenerativních onemocnění v mozkových organoidech.[21]
Etika
Byly vzneseny etické obavy při používání mozkových organoidů jako modelu nemoci kvůli jejich potenciálu prožívat pocity, jako je bolest nebo schopnost vyvinout vědomí.[38] V současné době je nepravděpodobné, vzhledem k jednoduchosti syntetizovaných modelů ve srovnání se složitostí lidského mozku, nicméně se ukázalo, že modely reagují na světelnou stimulaci,[39] současné modely tedy v současnosti mají určitý rozsah reakce na některé podněty. Pokud by bylo možné dokázat, že takové vjemy existují u některého z modelů, byla by etika jejich používání sporná.
Podnikají se kroky k vyřešení šedé oblasti, jako je sympozium v roce 2018 na Oxfordské univerzitě, kde se setkali odborníci v oboru, filozofové a právníci, aby se pokusili vyjasnit etické obavy s novou technologií.[40] Podobně projekty jako Brainstorm z Case Western University mají za cíl sledovat pokrok v oboru monitorováním laboratoří pracujících s mozkovými organoidy, aby se pokusily zahájit „budování filozofického rámce“, na kterém by mohly být stavěny budoucí směrnice a právní předpisy.[41] Kromě toho byla „humanizace“ zvířecích modelů vznesena jako téma zájmu při transplantaci organoidů odvozených z lidského SC do jiných zvířecích modelů.[37]
Viz také
Reference
- ^ A b C d E F G h i j k Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME a kol. (Září 2013). „Mozkové organoidy modelují vývoj lidského mozku a mikrocefalii“. Příroda. 501 (7467): 373–9. Bibcode:2013Natur.501..373L. doi:10.1038 / příroda12517. PMC 3817409. PMID 23995685.
- ^ A b Di Lullo, Elizabeth; Kriegstein, Arnold R. (09.09.2017). „Využití organoidů v mozku k vyšetřování nervového vývoje a nemocí“. Recenze přírody Neurovědy. 18 (10): 573–584. doi:10.1038 / nrn.2017.107. ISSN 1471-003X.
- ^ A b C d „Rostoucí modelové mozky: embryonální nápad“. Ekonom. 2013-08-31. Citováno 2013-09-07.
- ^ A b Di Lullo E, Kriegstein AR (říjen 2017). „Využití mozkových organoidů k vyšetřování nervového vývoje a nemocí“. Recenze přírody. Neurovědy. 18 (10): 573–584. doi:10.1038 / nrn.2017.107. PMC 5667942. PMID 28878372.
Tabulka 1: Protokoly pro generování mozkových organoidů
- ^ A b C Purves D, Augustine GJ, Fitzpatrick D, Hall WC, LaMantia AS, White LE, eds. (2007). Neurovědy (4. vydání). New York: W. H. Freeman. ISBN 978-0-87893-697-7.
- ^ A b C Chan WK, Griffiths R, Price DJ, Mason JO (červenec 2020). „Mozkové organoidy jako nástroje k identifikaci vývojových kořenů autismu“. Molekulární autismus. 11 (1): 58. doi:10.1186 / s13229-020-00360-3. PMC 7359249. PMID 32660622.
- ^ A b C Vogel G (srpen 2013). „Neurozvoj. Laboratoř připravuje mini mozky“. Věda. 341 (6149): 946–7. doi:10.1126 / science.341.6149.946. PMID 23990534.
- ^ Reichardt A, Polchow B, Shakibaei M, Henrich W, Hetzer R, Lueders C (14. června 2013). „Rozsáhlá expanze buněk lidské pupečníkové šňůry v bioreaktoru systému s rotujícím ložem pro aplikace kardiovaskulárního tkáňového inženýrství“. Otevřený deník biomedicínského inženýrství. 7 (1): 50–61. doi:10.2174/1874120701307010050. PMC 3706833. PMID 23847691.
- ^ Kostel G. „Budoucnost genetických kódů a kódů BRAIN“. Youtube. NIHvcast. Citováno 10. února 2017.
- ^ Bershteyn M, Kriegstein AR (září 2013). "Mozkové organoidy v misce: pokrok a vyhlídky". Buňka. 155 (1): 19–20. doi:10.1016 / j.cell.2013.09.010. PMC 5127703. PMID 24074857.
- ^ Sakayori N, Kikkawa T, Osumi N (říjen 2012). „Snížená proliferace a nadměrná astrogeneze heterozygotních nervových kmenových / progenitorových buněk Pax6“. Neurovědecký výzkum. 74 (2): 116–21. doi:10.1016 / j.neures.2012.08.004. PMID 22944581.
- ^ A b Eiraku M, Takata N, Ishibashi H, Kawada M, Sakakura E, Okuda S a kol. (Duben 2011). „Samoorganizující se morfogeneze optického kalíšku v trojrozměrné kultuře“. Příroda. 472 (7341): 51–6. Bibcode:2011 Natur.472 ... 51E. doi:10.1038 / nature09941. PMID 21475194.
- ^ A b C d E F Chambers SM, Tchieu J, Studer L (říjen 2013). "Build-a-brain". Buňková kmenová buňka. 13 (4): 377–8. doi:10.1016 / j.stem.2013.09.010. PMID 24094317.
- ^ A b C d E F G h Fischer J, Heide M, Huttner WB (2019-12-17). "Genetická modifikace mozkových organoidů". Hranice v buněčné neurovědě. 13: 558. doi:10.3389 / fncel.2019.00558. PMC 6928125. PMID 31920558.
- ^ A b C d E F G Poli D, Magliaro C, Ahluwalia A (2019). „Experimentální a výpočetní metody pro studium mozkových organoidů: přehled“. Frontiers in Neuroscience. 13: 162. doi:10,3389 / fnins.2019.00162. PMC 6411764. PMID 30890910.
- ^ A b C d E F G h i j Lee CT, Bendriem RM, Wu WW, Shen RF (srpen 2017). „3D mozkové organoidy odvozené z pluripotentních kmenových buněk: slibné experimentální modely pro vývoj mozku a neurodegenerativní poruchy“. Journal of Biomedical Science. 24 (1): 59. doi:10.1186 / s12929-017-0362-8. PMC 5563385. PMID 28822354.
- ^ A b C d E Sutarjono B (únor 2019). „Můžeme lépe porozumět tomu, jak Zika vede k mikrocefalii? Systematický přehled účinků viru Zika na lidské mozkové organoidy“. The Journal of Infectious Diseases. 219 (5): 734–745. doi:10.1093 / infdis / jiy572. PMID 30256965.
- ^ Mansour AA, Gonçalves JT, Bloyd CW, Li H, Fernandes S, Quang D a kol. (Červen 2018). „In vivo model funkčních a vaskularizovaných organoidů lidského mozku“. Přírodní biotechnologie. 36 (5): 432–441. doi:10,1038 / nbt.4127. PMC 6331203. PMID 29658944.
- ^ Daviaud N, Friedel RH, Zou H (listopad 2018). „Vaskularizace a štěp transplantovaných lidských mozkových organoidů v mozkové kůře“. eNeuro. 5 (6): ENEURO.0219–18.2018. doi:10.1523 / ENEURO.0219-18.2018. PMC 6243198. PMID 30460331.
- ^ Lelkes PI, Unsworth BR (2002). "Neuroektodermální buněčná kultura: endokrinní buňky". V Atala A, Lanza R (eds.). Metody tkáňového inženýrství (1. vyd.). San Diego, CA: Academic Press. p. 381. ISBN 978-0-12-436636-7.
- ^ A b C d E Chen HI, Song H, Ming GL (leden 2019). „Aplikace organoidů z lidského mozku na klinické problémy“. Dynamika vývoje. 248 (1): 53–64. doi:10.1002 / dvdy.24662. PMC 6312736. PMID 30091290.
- ^ A b C d E Kelava I, Lancaster MA (prosinec 2016). „Vyřazení mini mozků: Současný pokrok a budoucí vyhlídky ve výzkumu mozkových organoidů“. Vývojová biologie. 420 (2): 199–209. doi:10.1016 / j.ydbio.2016.06.037. PMC 5161139. PMID 27402594.
- ^ Amin, Neal D .; Paşca, Sergiu P. (říjen 2018). „Vytváření modelů poruch mozku pomocí trojrozměrných organoidů“. Neuron. 100 (2): 389–405. doi:10.1016 / j.neuron.2018.10.007. ISSN 0896-6273.
- ^ Qian, Xuyu; Nguyen, Ha Nam; Jacob, Fadi; Song, Hongjun; Ming, Guo-li (2017-03-15). „Používání mozkových organoidů k pochopení mikrocefalie vyvolané virem Zika“. Rozvoj. 144 (6): 952–957. doi:10.1242 / dev.140707. ISSN 0950-1991. PMC 5358105. PMID 28292840.
- ^ Opitz JM, Holt MC (1990). "Mikrocefalie: obecné úvahy a pomůcky pro nosologii". Journal of Craniofacial Genetics and Developmental Biology. 10 (2): 175–204. PMID 2211965.
- ^ Gonzalez C, Armijo E, Bravo-Alegria J, Becerra-Calixto A, Mays CE, Soto C (prosinec 2018). „Modelování amyloidu beta a tau v lidských mozkových organoidech“. Molekulární psychiatrie. 23 (12): 2363–2374. doi:10.1038 / s41380-018-0229-8. PMC 6594704. PMID 30171212.
- ^ Swerdlow RH (září 2007). „Patogeneze Alzheimerovy choroby“. Klinické intervence při stárnutí. 2 (3): 347–59. PMC 2685260. PMID 18044185.
- ^ Laurijssens B, Aujard F, Rahman A (září 2013). "Zvířecí modely Alzheimerovy choroby a vývoje léků". Objev drog dnes. Technologie. 10 (3): e319-27. doi:10.1016 / j.ddtec.2012.04.001. PMID 24050129.
- ^ A b C d „Objev drog v psychofarmakologii: od 2D modelů k mozkovým organoidům“. Dialogy v klinické neurovědě. doi:10.31887 / dcns.2019.21.2 / jladewig. PMC 6787544. PMID 31636494. Citováno 2020-10-04.
- ^ Wang H (08.06.2018). „Modelování neurologických onemocnění pomocí organoidů lidského mozku“. Hranice v synaptické neurovědě. 10: 15. doi:10.3389 / fnsyn.2018.00015. PMC 6002496. PMID 29937727.
- ^ Rubenstein JL (duben 2010). „Tři hypotézy o vývojových vadách, které mohou být základem některých forem poruchy autistického spektra“. Aktuální názor v neurologii. 23 (2): 118–23. doi:10.1097 / WCO.0b013e328336eb13. PMID 20087182.
- ^ A b Forsberg SL, Ilieva M, Maria Michel T (leden 2018). „Epigenetika a mozkové organoidy: slibné směry poruch autistického spektra“. Translační psychiatrie. 8 (1): 14. doi:10.1038/s41398-017-0062-x. PMC 5802583. PMID 29317608.
- ^ Pașca AM, Park JY, Shin HW, Qi Q, Revah O, Krasnoff R, et al. (Květen 2019). "Human 3D cellular model of hypoxic brain injury of prematurity". Přírodní medicína. 25 (5): 784–791. doi:10.1038/s41591-019-0436-0. PMC 7020938. PMID 31061540.
- ^ Daviaud N, Chevalier C, Friedel RH, Zou H (2019). "Distinct Vulnerability and Resilience of Human Neuroprogenitor Subtypes in Cerebral Organoid Model of Prenatal Hypoxic Injury". Hranice v buněčné neurovědě. 13: 336. doi:10.3389/fncel.2019.00336. PMC 6682705. PMID 31417360.
- ^ Amin, Neal D.; Paşca, Sergiu P. (October 2018). "Building Models of Brain Disorders with Three-Dimensional Organoids". Neuron. 100 (2): 389–405. doi:10.1016/j.neuron.2018.10.007. ISSN 0896-6273.
- ^ A b Amin, Neal D.; Paşca, Sergiu P. (October 2018). "Building Models of Brain Disorders with Three-Dimensional Organoids". Neuron. 100 (2): 389–405. doi:10.1016/j.neuron.2018.10.007. ISSN 0896-6273.
- ^ A b Chen HI, Wolf JA, Blue R, Song MM, Moreno JD, Ming GL, Song H (October 2019). "Transplantation of Human Brain Organoids: Revisiting the Science and Ethics of Brain Chimeras". Buňková kmenová buňka. 25 (4): 462–472. doi:10.1016/j.stem.2019.09.002. PMC 7180006. PMID 31585092.
- ^ Lavazza A, Massimini M (September 2018). "Cerebral organoids: ethical issues and consciousness assessment". Journal of Medical Ethics. 44 (9): 606–610. doi:10.1136/medethics-2017-104555. PMID 29491041.
- ^ Quadrato G, Nguyen T, Macosko EZ, Sherwood JL, Min Yang S, Berger DR, et al. (Květen 2017). "Cell diversity and network dynamics in photosensitive human brain organoids". Příroda. 545 (7652): 48–53. Bibcode:2017Natur.545...48Q. doi:10.1038/nature22047. PMC 5659341. PMID 28445462.
- ^ "Human Brain Organoids: the Science, the Ethics". Mezinárodní neuroetická společnost. Červen 2018.
- ^ Gogol A (October 2018). "A human brain model in a petri dish?". EurekAlert!.
