Katechol 1,2-dioxygenáza - Catechol 1,2-dioxygenase
| Katechol 1,2-dioxygenáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.13.11.1 | ||||||||
| Číslo CAS | 9027-16-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Katechol 1,2-dioxygenáza (ES 1.13.11.1, 1,2-CTD, katechol-kyslík 1,2-oxidoreduktáza, 1,2-pyrokatecháza, katecháza, katechol 1,2-oxygenáza, katechol dioxygenáza, pyrokatecháza, pyrokatechol 1,2-dioxygenáza, CD I, CD II)[1][2][3][4] je enzym který katalyzuje štěpení oxidačního kruhu katechol tvořit cis, ciskyselina jablečná:[5]

Přesněji řečeno, 1,2-CTD je intradiol dioxygenáza, rodina katechol dioxygenáz, která štěpí vazbu mezi fenolovými hydroxylovými skupinami katecholu za použití Fe3+ kofaktor.
Dosud bylo pozorováno, že 1,2-CTD existuje u následujících druhů půdních bakterií a hub: Pseudomonas sp.,[6] Pseudomonas fluorescens,[7] Aspergillus niger,[8] Brevibacterium fuscum,[9][10] Acinetobacter calcoaceticus,[11] Trichosporon cutaneum,[12] Rhodococcus erythropolis,[13] Frateuria sp.,[14] Rhizobium trifolii,[15] Pseudomonas putida,[16] Candida tropicalis,[17] Candida maltóza,[18] Rhizobium leguminosarum,[19] a Nocardia sp..[20] Tyto bakterie následně používají 1,2-CTD v posledním kroku degradace aromatických sloučenin na alifatické produkty.[21]
Dějiny
Osamu Hayaishi a Kizo Hashimoto objevili v roce 1950 dvě rodiny dioxygenáz: katechol 1,2-dioxygenázu a katechol 2,3-dioxygenáza (2,3-CTD).[22] Bylo zjištěno, že tyto dva enzymy jsou součástí dvou samostatných rodin katechol dioxygenázy: 1,2-CTD byl klasifikován jako intradiol dioxygenáza, zatímco 2,3-CTD byl klasifikován jako extradiol dioxygenáza. Tyto dva enzymy lze rozlišit na základě jejich reakčních produktů a kofaktorů. 1,2-CTD používá Fe3+ jako kofaktor pro štěpení vazby uhlík-uhlík mezi fenolovými hydroxylovými skupinami katecholu, čímž se získá kyselina mukonová jako produkt. Naproti tomu 2,3-CTD využívá Fe2+ jako kofaktor pro štěpení vazby uhlík-uhlík sousedící s fenolovými hydroxylovými skupinami katecholu, čímž se získá 2-hydroxymukonaldehyd jako produkt.[23]
Struktura enzymu
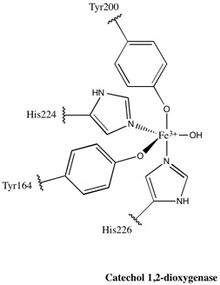
Téměř všichni členové rodiny 1,2-CTD jsou homodimery; enzym 1,2-CTD produkovaný Pseudomonas arvilla je výjimka z tohoto pravidla, která obsahuje dvě vysoce homologní podjednotky, které mohou tvořit buď homo- nebo heterodimer.[24]Enzym se tvarem podobá bumerangu, a lze jej proto jasně rozdělit do tří domén: dvou katalytických domén na každém konci „bumerangu“ a linkerové domény ve středu.
Každá katalytická doména se skládá ze dvou skládaných smíšených topologií β listy a několik náhodné cívky. Tyto desky a cívky následně obklopují aktivní místo: komplex nehemového železa (III). Bez hemu musí být železo ligován až čtyři aminokyselinové zbytky (Tyr200, His226, Tyr164, His224) pro udržení je katalyticky aktivní konformace. S Tyr200 a His226 působícími jako axiální ligandy a Tyr164, His224 a molekulou vody rozpouštědla působící jako rovníkové ligandy, Fe3+ komplexní displeje trigonální bipyramidální geometrie. Vzhledem k tomu, že aktivní místa každé katalytické domény jsou oddělena ve vzdálenosti 40 Á, nelze předpokládat, že by se navzájem alostericky ovlivňovaly.
Naproti tomu doména linkeru se skládá z α šroubovice dodávané dvěma katalytickými doménami: každá doména přispívá pěti šroubovicemi ze svých N konců a jedna ze spirály, která překlenuje jak katalytickou doménu, tak doménu linkeru. Ve středu linkerové domény je umístěn hydrofobní tunel 8 x 35 Á se dvěma fosfolipidy vázanými na každém konci. Hlava každého fosfolipidu směřuje ven k roztoku, zatímco ocasy jsou zality v enzymu. Funkce tohoto hydrofobního tunelu není známa, i když byly postulovány dvě hypotézy týkající se jeho užitečnosti. Prvním je to, že vazba terminálních fosfolipidů mění konformaci aktivních míst, což znamená, že tunel funguje jako efektor a umožňuje pouze aktivní enzym v určitých oblastech buňky. Druhá hypotéza předpokládá, že tunel reguluje tuhost lipidové membrány prostřednictvím degradace fenolických uhlovodíků a schopnosti vázat se na jiné lipidy. Studie prokázaly, že fenolové uhlovodíky ovlivňují funkční a strukturní vlastnosti buněčných membrán.[25] 1,2-CTD degraduje fenolové uhlovodíky klíčem k syntéze lipidových membrán. Proto se 1,2-CTD může vázat na buněčnou lipidovou membránu prostřednictvím svých koncových fosfolipidů a mít tak lepší přístup k fenolickým uhlovodíkům životně důležitým ve struktuře lipidové membrány.[26]
Enzymový mechanismus

Katalytický mechanismus katechol 1,2-dioxygenázy byl objasněn pomocí kombinace O18 etiketovací experimenty a krystalografie.[27][28][29] Po vstupu do aktivního místa se hydroxylová skupina na čtvrtém uhlíku (C4) katecholu váže na Fe3+; tato vazba je usnadněna hydroxidovým ligandem, který deprotonuje hydroxylovou skupinu C4. Druhá hydroxylová skupina katecholu na uhlíku 3 (C3) je koordinována s Fe3+ po jeho deprotonaci ligandem Tyr200. V procesu deprotonace hydroxylové skupiny C3 se Tyr200 disociuje z katalytického komplexu.
Kyslík je k substrátu vázán řadou trans vlivy a stabilizace vodíkové vazby mezi substrátem a jinými aminokyselinovými zbytky na aktivním místě. His226 přijímá elektronovou hustotu ze substrátu, což následně snižuje vazbu mezi Fe3+ a C4 hydroxyl. Současně vazba mezi hydroxylovou skupinou C3 a Fe3+ se zvyšuje v důsledku účinků Tyr164 na přitahování elektronů. Tato zkreslení spojená s vodíkovou vazbou mezi Arg221 a C3 hydroxylovou skupinou indukují hydroxylovou skupinu C3 ke ketonizaci a zvyšují karbaniontový charakter C4. Nově vytvořený karbanion C4 útočí na O2, čímž se váže na substrát.
Další trans vliv sleduje výše uvedený krok, který vede ke štěpení O2 a následné vložení jedné z molekul kyslíku mezi C3 a C4. Po této reakci následuje rychlá hydrolýza, která poskytuje aktivované aktivní místo a produkt.
Reference
- ^ Hayaishi O, Lardy H, Myrbäck K (1963). "Přímé okysličení O2, oxygenase ". In Boyer PD (ed.). Enzymy. 8 (2. vyd.). New York: Academic Press. str. 353–371.
- ^ Hayaishi O, Katagiri M, Rothberg S (prosinec 1957). "Studie na oxygenázách; pyrokatechase". The Journal of Biological Chemistry. 229 (2): 905–20. PMID 13502352.
- ^ Sistrom WR, Stanier RY (říjen 1954). "Mechanismus tvorby kyseliny beta-ketoadipové bakteriemi". The Journal of Biological Chemistry. 210 (2): 821–36. PMID 13211620.
- ^ Zeyer J, Kocher HP, Timmis KN (srpen 1986). "Vliv para-substituentů na oxidační metabolismus o-nitrofenolů Pseudomonas putida B2". Aplikovaná a environmentální mikrobiologie. 52 (2): 334–9. doi:10.1128 / AEM.52.2.334-339.1986. PMC 203526. PMID 3752997.
- ^ Schomburg D, Schomburg I (2006). „Katechol 1,2-dioxygenáza“. Oxidoreduktázy třídy I X. Springer Handbook of Enzymes. 25 (2. vyd.). Springer Berlin Heidelberg. 382–394. doi:10.1007/3-540-37704-2_47. ISBN 978-3-540-37704-7.
- ^ Dorn E, Knackmuss HJ (červenec 1978). "Chemická struktura a biologická odbouratelnost halogenovaných aromatických sloučenin. Dvě katechol 1,2-dioxygenázy z pseudomonády pěstované na 3-chlorbenzoátu". The Biochemical Journal. 174 (1): 73–84. doi:10.1042 / bj1740073. PMC 1185887. PMID 697765.
- ^ Hayaishi S, Katagiri M, Rothberg S (1957). „Průkopník v oboru oxygenáz studiem metabolismu tryptofanu: dílo Osamu Hayaishi“ (PDF). J. Biol. Chem. 229: 905–920.
- ^ Ninnekar H, Vaidyanathan C (1981). „Katechol 1,2-dioxygenáza z Aspergillus niger: Čištění a vlastnosti ". J. Indian Inst. Sci. 63C: 131–136.
- ^ Nakazawa H, Inoue H, Takeda Y (1963). "Vlastnosti katechol oxygenázy z Brevibacterium fuscum". J. Biochem. 54 (1): 65–74. doi:10.1093 / oxfordjournals.jbchem.a127748. PMID 14056355.
- ^ Hou CT, Patel R, Lillard MO (březen 1977). „Extradiolové štěpení 3-methylkatecholu katechol 1,2-dioxygenázou z různých mikroorganismů“. Aplikovaná a environmentální mikrobiologie. 33 (3): 725–7. doi:10.1128 / AEM.33.3.725-727.1977. PMC 170750. PMID 16345232.
- ^ Patel RN, Hou CT, Felix A, Lillard MO (červenec 1976). "Katechol 1,2-dioxygenáza z Acinetobacter calcoaceticus: čištění a vlastnosti". Journal of Bacteriology. 127 (1): 536–44. doi:10.1128 / JB.127.1.536-544.1976. PMC 233087. PMID 58860.
- ^ Itoh, M (1981). "Vlastnosti nové katechol-1,2-oxygenázy z Trichosporon cutaneum WY2-2 ". Agric. Biol. Chem. 45 (1): 2787–2796.
- ^ Aoki K, Konohana T, Shinke R, Nishira H (1984). „Klasifikace rodiny katechol 1,2-dioxygenázy: sekvenční analýza genu pro katechol 1,2-dioxygenázu vykazující vysokou specificitu pro methylkatecholy z asimilující Gram + anilin Rhodococcus erythropolis AN-13 ". Agric. Biol. Chem. 48 (1): 2087–2095. doi:10.1016 / S0378-1119 (96) 00629-4. PMID 9034312.
- ^ Aoki K, Konohana T, Shinke R, Nishira H (1984). „Dvě katechol 1,2-dioxygenázy z bakterie asimilující anilin, Frateria druh ANA-18 ". Agric. Biol. Chem. 48 (1): 2097–2104.
- ^ Chen Y, Glenn A, Dilworth M (1985). "Aromatický metabolismus v Rhizobium trifolii-katechol 1,2-dioxygenáza ". Oblouk. Microbiol. 141 (1): 225–228. doi:10.1007 / BF00408063.
- ^ Pascal RA, Huang DS (červenec 1986). "Reakce 3-ethylkatecholu a 3- (methylthio) katecholu s katechol dioxygenázami". Archivy biochemie a biofyziky. 248 (1): 130–7. doi:10.1016/0003-9861(86)90409-1. PMID 3015028.
- ^ Krug M, Straube G (1986). „Degradace fenolických sloučenin kvasinkami Candida tropicalis HP 15. II. Některé vlastnosti prvních dvou enzymů degradační dráhy“. Journal of Basic Microbiology. 26 (5): 271–81. doi:10,1002 / zakázka. 3620260505. PMID 3783431.
- ^ Gomi K, Horiguchi (1988). „Čištění a charakterizace pyrokatecházy z kvasinek asimilujících katechol Candida maltóza". Agric. Biol. Chem. 52 (2): 585–587. doi:10,1271 / bbb1961,52,585.
- ^ Chen YP, Lovell CR (červen 1990). „Čištění a vlastnosti katechol 1,2-dioxygenázy z Rhizobium leguminosarum biovar viceae USDA 2370“. Aplikovaná a environmentální mikrobiologie. 56 (6): 1971–3. doi:10.1128 / AEM.56.6.1971-1973.1990. PMC 184541. PMID 16348234.
- ^ Smith M, Ratledge C, Crook S (1990). „Vlastnosti aktivovaného bromkyanu, katechol-1,2-dioxygenázy imobilizované na agaróze z lyofilizovaných extraktů Nocardia sp. NCIB 10503 ". Enzymový mikrob. Technol. 12 (12): 945–949. doi:10.1016/0141-0229(90)90114-6.
- ^ Que L, Ho RY (listopad 1996). „Dioxygen Activation by Enzymes with Mononuclear Non-Heme Iron Active Sites“. Chemické recenze. 96 (7): 2607–2624. doi:10.1021 / cr960039f. PMID 11848838.
- ^ Hayaishi O, Hashimoto K (1950). „Pyrokatecase - nový enzym katalizující oxidační rozklad pyrokatechinu“ (PDF). J. Biochem. 37 (3): 371–374. doi:10.1093 / oxfordjournals.jbchem.a126205.
- ^ Bugg, Timothy (2003). "Enzymy dioxygenázy: katalytické mechanismy a chemické modely". Čtyřstěn. 59 (36): 7075–7101. doi:10.1016 / S0040-4020 (03) 00944-X.
- ^ Nakai C, Kagamiyama H, Saeki Y, Nozaki M (červen 1979). "Neidentické podjednotky pyrokatecházy z Pseudomonas arvilla C-1". Archivy biochemie a biofyziky. 195 (1): 12–22. doi:10.1016/0003-9861(79)90322-9. hdl:2433/222081. PMID 475379.
- ^ Sikkema J, de Bont JA, Poolman B (březen 1994). „Interakce cyklických uhlovodíků s biologickými membránami“ (PDF). The Journal of Biological Chemistry. 269 (11): 8022–8. PMID 8132524.[trvalý mrtvý odkaz ]
- ^ Vetting MW, Ohlendorf DH (duben 2000). „Krystalová struktura katechol 1,2-dioxygenázy 1,8 A odhaluje nový hydrofobní šroubovicový zip jako spojovací podjednotku“. Struktura. 8 (4): 429–40. doi:10.1016 / S0969-2126 (00) 00122-2. PMID 10801478.
- ^ Hayaishi O, Hashimoto K (1950). „Pyrokatecase - nový enzym katalizující oxidační rozklad pyrokatechinu“ (PDF). J. Biochem. 37 (3): 371–374. doi:10.1093 / oxfordjournals.jbchem.a126205.
- ^ Orville AM, Lipscomb JD, Ohlendorf DH (srpen 1997). „Krystalové struktury substrátu a komplexů analogů substrátu protocatechuát 3,4-dioxygenázy: vytěsňování endogenního ligandu Fe3 + v reakci na vazbu substrátu“. Biochemie. 36 (33): 10052–66. doi:10.1021 / bi970469f. PMID 9254600.
- ^ Lipscomb J, Orville A (1992). Kovové ionty v biologických systémech. 28. Marcel Dekker, Inc., str. 243–298.
externí odkazy
- Katechol + 1,2-dioxygenáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
