Threonin amoniak-lyáza - Threonine ammonia-lyase
| L-threonin amoniak-lyáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D kreslené zobrazení tetrameru threonin-deaminázy | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.3.1.19 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Threonin amoniak-lyáza, také běžně označované jako threonin deamináza nebo threonin dehydratáza, je enzym zodpovědný za katalyzující přeměna L-threonin do alfa-ketobutyrát a amoniak. Alfa-ketobutyrát lze převést na L-isoleucin, takže threonin amoniak-lyáza funguje jako klíčový enzym BCAA syntéza.[1] Zaměstnává a pyridoxal-5'-fosfát kofaktor, podobný mnoha enzymům zapojeným do aminokyselina metabolismus. Nachází se v bakterie, droždí, a rostliny, ačkoli většina dosavadního výzkumu se zaměřuje na formy enzymu v bakteriích. Tento enzym byl jedním z prvních, ve kterém negativní zpětná vazba inhibice konečným produktem a metabolická cesta byl přímo pozorován a studován.[2] Enzym slouží jako vynikající příklad regulačních strategií používaných v aminokyselinách homeostáza.
Struktura
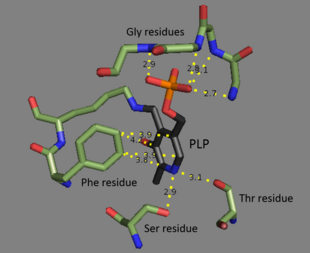
Threonin amoniak-lyáza je a tetramer stejných podjednotky, a je uspořádán jako a dimer dimerů. Každá podjednotka má dvě domén: doména obsahující katalyticky aktivní místo a doména s alosterický regulační weby. Ukázalo se, že se jedná o odlišné oblasti,[3] ale regulační místo jedné podjednotky ve skutečnosti interaguje s katalytickým místem jiné podjednotky.[4] Obě domény obsahují opakující se strukturní motiv beta listy obklopen alfa helixy.[5] I když threoninové vazebné místo není zcela objasněno, strukturální studie ukazují, jak je vázán kofaktor pyridoxal fosfátu.[4] Kofaktor PLP je navázán na a lysin zbytek pomocí a Schiffova základna a fosfát skupinu PLP drží na místě amin skupiny odvozené z opakující se sekvence glycin zbytky. The aromatický prsten je vázán na fenylalanin a dusík na kruhu je vodíkovou vazbou na hydroxyl zbytky obsahující skupinu.[6]
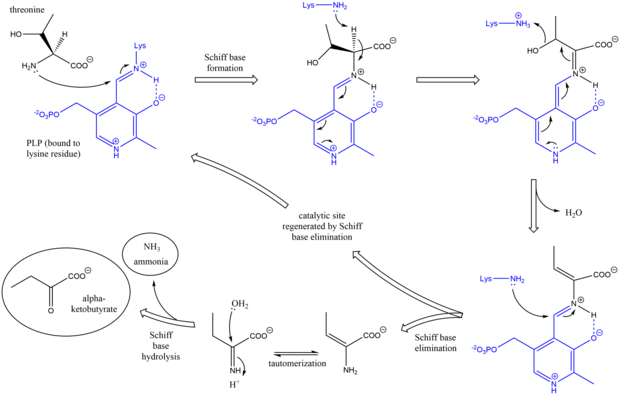
Mechanismus
Mechanismus působení threonin amoniak-lyázy je analogický s jinými deaminujícími enzymy PLP při použití Schiffovy báze meziprodukty.[7] Zpočátku aminová skupina threoninu napadá lysin / PLP Schiffovu bázi a vytěsňuje lysin. Po deprotonace aminokyseliny alfa uhlík a následující dehydratace (odtud běžný název threonin dehydratáza), je vytvořena nová základna Schiff. Tato Schiffova báze je nahrazena lysinovým útokem, reformou katalyticky aktivní PLP a uvolněním iniciály alken -obsahující produkt. Tento výrobek tautomerizuje a poté hydrolýza základny Schiff jsou generovány konečné produkty.[8][9] Poté, co se vytvoří finální produkt alfa-ketobutyrátu, se isoleucin syntetizuje postupem meziprodukty alfa-acetohydroxybutyrát na alfa-beta-dihydroxy-beta-methylvalerát a poté na alfa-keto-beta-methylvalerát.[10]
Nařízení
Ukázalo se, že threonin amoniak-lyáza nebude následovat Kinetika Michaelis-Menten, spíše podléhá komplexní alosterické kontrole.[11] Enzym je potlačeno isoleucinem, produktem cesty, které se účastní, a je aktivován valin, produkt paralelní dráhy.[1] Zvýšení koncentrace isoleucinu tedy zastaví jeho produkci a zvýšení koncentrace valinu odkloní výchozí materiál (Hydroxyethyl-TPP ) mimo produkci valinu. Enzym má dvě vazebná místa pro isoleucin; jeden má vysokou afinita pro isoleucin a druhý má nízkou afinitu.[12] Vazba isoleucinu na místo s vysokou afinitou zvyšuje vazebnou afinitu místa s nízkou afinitou a k enzymové deaktivaci dochází, když se isoleucin váže na místo s nízkou afinitou. Valin podporuje aktivitu enzymů kompetitivní vazbou na místo s vysokou afinitou a brání tomu, aby měl isoleucin inhibiční účinek.[12] Kombinace těchto dvou metod zpětné vazby vyvažuje koncentraci BCAA.

Isoformy a další funkce
Násobek formuláře threonin amoniak-lyázy byly pozorovány u různých druh organismu. v Escherichia coli, systém, ve kterém byl enzym rozsáhle studován, lze nalézt dvě různé formy enzymu. Jedním z nich je biosyntetický a podobá se zde uváděným charakteristikám enzymu, zatímco druhá je degradativní a funkce pro generování uhlíkových fragmentů pro výroba energie.[2] Dvojice izoforem byla také pozorována u jiných bakterií. V mnoha bakteriích je biodegradativní izoforma enzymu exprimována v anaerobní podmínek a je propagován tábor a threonin, zatímco biosyntetická izoforma je exprimována v aerobní podmínky.[13] To umožňuje bakterii vyrovnávat zásoby energie a inhibovat energeticky náročné syntetické dráhy, když energie není dostatek.
V rostlinách je threonin amoniak-lyáza důležitá v obranných mechanismech proti býložravci a je upregulován v reakci na abiotický stres.[14] Upravená izoforma enzymu s jedinečnými vlastnostmi, které odradí býložravce, je exprimována v listech rostlin. Katalytická doména této izoformy je extrémně rezistentní proteolýza, zatímco regulační doména se snadno degraduje, takže po požití jiným organismem zůstávají schopnosti enzymu deaminovat threonin nekontrolovány. To degraduje threonin dříve, než ho býložravec může absorbovat, a hladověje tak býložravce esenciální aminokyselina.[15] Studie threonin amoniak-lyázy v rostlinách také nabídly nové strategie ve vývoji GMO se zvýšenou nutriční hodnotou zvýšením obsahu esenciálních aminokyselin.[14]
Byly nalezeny další exotičtější formy enzymu, které jsou extrémně malé, ale přesto si zachovávají všechny katalytické a regulační funkce.[4]
Vývoj
Existuje pět hlavních typů skládání pro enzymy závislé na PLP. Threonin amoniak-lyáza je členem rodiny Fold Type II, také známé jako tryptofan syntáza rodina.[7] Ačkoli threonin amoniak-lyáza nemá tunelování substrátu stejně jako tryptofan syntáza obsahuje mnohem konzervovanější homologie. Threonin amoniak-lyáza je nejblíže příbuzná serin dehydratáza a oba mají stejný obecný katalytický mechanismus.[9] Ve skutečnosti bylo prokázáno, že threonin amoniak-lyáza vykazuje určitou specificitu vůči serin a může přeměnit serin na pyruvát.[2] Regulační doména threonin amoniak-lyázy je velmi podobná regulační doméně fosfoglycerátdehydrogenáza.[4] Všechny tyto vztahy ukazují, že threonin-amoniak-lyáza má blízko evoluční vazby na tyto enzymy. Vzhledem ke stupni konzervování struktura a sekvence v enzymech, které rozpoznávají aminokyseliny, je pravděpodobné, že evoluční rozmanitost těchto enzymů vznikla spojením různých regulačních a katalytických domén různými způsoby.[1]
Relevance pro člověka
Threonin amoniak-lyáza se u lidí nenachází. Toto je tedy jeden příklad, proč lidé nemohou syntetizovat všech 20 proteinogenní aminokyseliny; v tomto konkrétním případě lidé nemohou přeměnit threonin na isoleucin a musí konzumovat isoleucin ve stravě.[1] Enzym byl také v minulosti studován jako možný činidlo potlačující nádor z dříve popsaných důvodů tím, že zbavuje nádorové buňky esenciální aminokyseliny a zabíjí je,[16] ale tato léčba nebyla využita.
Reference
- ^ A b C d E Berg JM, Tymoczko JL, Stryer L (2012). Biochemie (7. vydání). New York: W.H. Freeman a společnost. ISBN 978-1-4292-7635-1.
- ^ A b C Deštník HE, Brown B (leden 1957). „Deaminace threoninu v Escherichia coli. II. Důkazy o dvou L-threonin deaminázách“. Journal of Bacteriology. 73 (1): 105–12. doi:10.1128 / jb.73.1.105-112.1957. PMC 289754. PMID 13405870.
- ^ Changeux J (1963). "Allosterické interakce na biosyntetické L-threonin deamináze z E. coli K12". Cold Spring Harbor Symposia o kvantitativní biologii. 28: 497–504. doi:10.1101 / SQB.1963.028.01.066.
- ^ A b C d Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eisenstein E (duben 1998). "Struktura a řízení alosterické threonindeaminázy závislé na pyridoxal fosfátu". Struktura. 6 (4): 465–75. doi:10.1016 / s0969-2126 (98) 00048-3. PMID 9562556.
- ^ Schneider G, Käck H, Lindqvist Y (leden 2000). "Rozdělovač enzymů závislých na vitaminu B6". Struktura. 8 (1): R1-6. doi:10.1016 / S0969-2126 (00) 00085-X. PMID 10673430.
- ^ A b Goto M (2005). "Krystalová struktura T. th. HB8 threonin deaminázy". doi:10,2210 / pdb1ve5 / pdb. Citovat deník vyžaduje
| deník =(Pomoc) - ^ A b Eliot AC, Kirsch JF (2004). "Pyridoxal fosfátové enzymy: mechanistické, strukturální a evoluční úvahy". Roční přehled biochemie. 73 (1): 383–415. doi:10.1146 / annurev.biochem.73.011303.074021. PMID 15189147.
- ^ A b Umbarger HE (2009). "Threonin deaminázy". In Meister A (ed.). Pokroky v enzymologii a souvisejících oblastech molekulární biologie. Pokroky v enzymologii a souvisejících oblastech molekulární biologie. 37. John Wiley & Sons. str. 349–95. doi:10.1002 / 9780470122822.ch6. ISBN 978-0-471-59172-6. PMID 4570068.
- ^ A b C Jin J, Hanefeld U (březen 2011). „Selektivní přidání vody k vazbám C = C; nejlepší chemici jsou enzymy.“ Chemická komunikace. 47 (9): 2502–10. doi:10.1039 / c0cc04153j. PMID 21243161.
- ^ Squires CH, Levinthal M, De Felice M (listopad 1981). „Role threonindeaminázy v regulaci biosyntézy alfa-acetolaktátu v Escherichia coli K12“. Journal of General Microbiology. 127 (1): 19–25. doi:10.1099/00221287-127-1-19. PMID 7040602.
- ^ Changeux JP (1961). „Mechanismy zpětné vazby biosyntetické L-threonin deaminázy L-isoleucinem“. Cold Spring Harbor Symposia o kvantitativní biologii. 26: 313–8. doi:10.1101 / SQB.1961.026.01.037. PMID 13878122.
- ^ A b Wessel PM, Graciet E, Douce R, Dumas R (prosinec 2000). „Důkazy o dvou odlišných vazebných místech pro efektor v threonindeamináze místně řízenou mutagenezí, kinetikou a vazebnými experimenty“ (PDF). Biochemie. 39 (49): 15136–43. doi:10.1021 / bi001625c. PMID 11106492.
- ^ Luginbuhl GH, Hofler JG, Decedue CJ, Burns RO (říjen 1974). „Biodegradative L-threonine deaminase of Salmonella typhimurium“. Journal of Bacteriology. 120 (1): 559–61. doi:10.1128 / jb.120.1.559-561.1974. PMC 245803. PMID 4370904.
- ^ A b Joshi V, Joung JG, Fei Z, Jander G (říjen 2010). „Vzájemná závislost metabolismu threoninu, methioninu a isoleucinu v rostlinách: akumulace a regulace transkripce při abiotickém stresu“. Aminokyseliny. 39 (4): 933–47. doi:10.1007 / s00726-010-0505-7. PMID 20186554.
- ^ Gonzales-Vigil E, Bianchetti CM, Phillips GN, Howe GA (duben 2011). „Adaptivní vývoj threonindeaminázy v obraně rostlin proti hmyzožravým býložravcům“. Sborník Národní akademie věd Spojených států amerických. 108 (14): 5897–902. doi:10.1073 / pnas.1016157108. PMC 3078374. PMID 21436043.
- ^ Greenfield RS, Wellner D (srpen 1977). "Účinky threonindeaminázy na růst a životaschopnost savčích buněk v tkáňové kultuře a její selektivní cytotoxicita vůči leukemickým buňkám". Výzkum rakoviny. 37 (8 Pt 1): 2523–9. PMID 559542.