Regulátor glykolýzy a apoptózy indukovaný TP53 - TP53-inducible glycolysis and apoptosis regulator
The Regulátor glykolýzy a apoptózy indukovaný TP53 (TIGAR) také známý jako fruktóza-2,6-bisfosfatáza TIGAR je enzym že u lidí je kódován C12orf5 gen.[5][6][7]
TIGAR je nedávno objevený enzym, který primárně funguje jako regulátor glukóza rozpad v člověku buňky. Kromě své role v řízení degradace glukózy může aktivita TIGAR umožnit buňce provádět DNA oprava a degradace jeho vlastní organely. A konečně, TIGAR může chránit buňku před smrtí. Od svého objevu v roce 2005 Kuang-Yu Jenem a Vivianem G. Cheungem se TIGAR stal předmětem zájmu vědecké komunity díky své aktivní roli v mnoha rakoviny. Normálně je výroba TIGARu tělem aktivována p53 supresor nádoru protein poté, co buňka zaznamenala nízkou hladinu Poškození DNA nebo stres. U některých typů rakoviny spadal přípravek TIGAR pod kontrolu jiných proteinů. Doufáme, že budoucí výzkum přípravku TIGAR poskytne náhled na nové způsoby léčby rakoviny.[8][9][10]
Tento gen je regulován jako součást p53 supresor nádoru a kóduje protein se sekvenční podobností s bisfosfát doména glykolytický enzym, který degraduje fruktóza-2,6-bisfosfát. Protein funguje tak, že blokuje glykolýzu a směruje cestu do pentosový fosfátový zkrat. Exprese tohoto proteinu také chrání buňky před poškozením DNA reaktivní formy kyslíku a poskytuje určitou ochranu před poškozením DNA apoptóza. Oblast 12p13.32, která zahrnuje tento gen, je paralogní k oblasti 11q13.3.[7]
Gen
U lidí TIGAR gen, známý jako C12orf5, se nachází na chromozom 12p 13-3 a skládá se z 6 exony.[9] C12orf5 mRNA je 8237 základní páry v délce.[11]
Objev
Jen a Cheung poprvé objevili gen c12orf5, zatímco pomocí počítačového hledání našli nové geny regulované p53, které byly zapnuty v reakci na ionizující radiace. Publikovali svůj výzkum v Cancer Research v roce 2005.[8]
Později byla v Cell od Karima Bensaada et al. Publikována studie zaměřená výhradně na strukturu a funkci genu c12orf5, ve které byl c12orf5 na počest své zjevné funkce pojmenován TIGAR.[9]
Výraz
TIGAR transkripce je rychle aktivován p53 supresor nádoru protein v reakci na nízkou hladinu buněčného stresu, jako je ten způsobený expozicí nízkým dávkám UV.[12] Při vysokých úrovních buněčného stresu však exprese TIGAR klesá.[12] P53, a transkripční faktor se může vázat na dvě místa v lidském genu TIGAR k aktivaci exprese.[9][13] Jeden web se nachází v prvním intron a váže p53 s vysokou afinitou.[9][13] Druhý se nachází těsně před prvním exonem, váže p53 s nízkou afinitou,[9][13] a je konzervován mezi myšmi a lidmi.[9]Exprese TIGAR může být regulována jinými mechanismy než p53 v linií nádorových buněk.[9]
Struktura
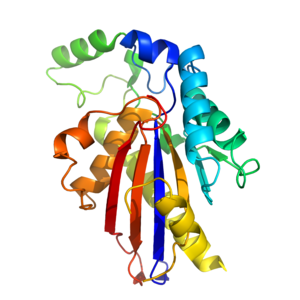
TIGAR je přibližně 30 kDa [9] a má terciární struktura to je podobné jako histidin fosfatáza složit.[14] Jádro TIGAR je tvořeno sendvičem α-β-α, který se skládá ze šesti řetězců β list obklopen 4 α šroubovice.[14] Další a helixy a dlouhá smyčka jsou postaveny kolem jádra, aby poskytly plný enzym.[14] TIGAR má Aktivní stránky která je strukturálně podobná jako u PhoE (bakteriální fosfatázový enzym) a funkčně podobná jako u fruktóza-2,6-bisfosfatáza.
Bisfosfatázové aktivní místo TIGAR je kladně nabité a katalýzy odstranění fosfát skupiny z jiných molekul.[9][14] Na rozdíl od fruktózy-2,6-bisfosfatázy je aktivní místo TIGAR otevřené a přístupné jako místo PhoE.[14] Stránka obsahuje 3 zásadní aminokyseliny (2 histidiny a 1 kyselina glutamová [9]), které jsou zapojeny do fosfatáza reakce. Tyto 3 zbytky jsou souhrnně označovány jako a katalytická triáda,[9] a nacházejí se ve všech enzymech patřících do fosfoglyceromutáza větev nadrodiny histidin fosfatázy.[9][14] Jedním ze zbytků histidinu je elektrostaticky vázán na záporně nabitý fosfát. Druhý fosfát je vázán na jiném místě aktivního místa.[14]
Funkce
Aktivita TIGAR může mít několik buněčných účinků. TIGAR působí jako přímý regulátor pro fruktóza-2,6-bisfosfát úrovně a hexokináza 2 a to může nepřímo vést k mnoha změnám v buňce v řetězci biochemických událostí. TIGAR je bisfosfatáza fruktózy, která aktivuje p53, což vede k inhibici exprese transportéru glukózy a také k regulaci exprese hexokinázy a fosfoglycerát mutázy. TIGAR také inhibuje fosfofruktruktokinázu (PFK) snížením hladiny fruktózy-2,6, bisfosfátu, proto je inhibována glykolýza a je podporována pentózo-fosfátová cesta.[15]
Regulace fruktózy-2,6-bisfosfátu
TIGAR snižuje hladinu buněčných fruktóza-2,6-bisfosfátů.[9][13] Katalyzuje odstranění fosfátové skupiny z fruktóza-2,6-bisfosfátu (F-2,6-BP):[9][13]Fruktóza-2,6-bisfosfát-> Fruktóza-6-fosfát (F-6-P) + fosfát
F-2,6-BP je alosterický regulátor buněk metabolismus glukózy cesty. F-2,6-BP se obvykle váže na a zvyšuje aktivitu fosfofruktokináza 1. Fosfofruktokináza-1 katalyzuje přidání fosfátu k F-6-P za vzniku fruktózy-1,6-bisfosfátu (F-1,6-BP). Jedná se o zásadní krok v glykolýza cesta, která tvoří první část aerobní dýchání v savci.F-2,6-BP se také váže na aktivitu fruktóza-1,6-bisfosfatázy a snižuje její aktivitu.[9] Fruktóza-1,6-bisfosfatáza katalyzuje odstranění fosfátu z F-1,6-BP za vzniku F-6-P. Tato reakce je součástí glukoneogeneze cesta, která syntetizuje glukóza, a je opakem glykolýzy.[16] Když TIGAR snižuje hladinu F-2,6-BP, fosfofruktokináza se stává méně aktivní, zatímco aktivita fruktóza-1,6-bisfosfatázy se zvyšuje.[9][13] Zvyšují se hladiny fruktosa-6-fosfátu,[9][13] který má uvnitř buňky několik efektů:
- Rychlost glykolýzy klesá[9][13]
- Rychlost glukoneogeneze se zvyšuje[9]
- Přebytek fruktóza-6-fosfátu se převede na glukóza-6-fosfát v an izomerizace reakce [9]
- Přebytek glukóza-6-fosfátu vstupuje do pentóza fosfátová cesta. To nakonec vede k odstranění reaktivní formy kyslíku (ROS) v buňce[9][13]
- Odstranění ROS pomáhá zabránit apoptóza (sebevražda buněk) a může také snížit hromadění Poškození DNA přesčas.[9][13]
Odpověď na poškození DNA a zastavení buněčného cyklu
TIGAR může působit tak, že brání buňce postupovat ve fázích jejího růstového a dělícího cyklu snížením počtu buněk ATP úrovně.[12] Toto je známé jako buněčný cyklus zatknout.[12] Tato funkce TIGAR je součástí zprostředkovaného p53 Poškození DNA reakce, při které za nízké úrovně buněčného stresu iniciuje p53 zástava buněčného cyklu umožnit buňce čas na opravu.[13][17][18] Při vysokých úrovních buněčného stresu místo toho p53 iniciuje apoptózu.[13][17][18]
V klidových buňkách se buněčný cyklus skládá z fází G0 -> G1 -> S -> G2 -> M a je pevně regulován v kontrolních bodech mezi fázemi.[19] Pokud buňka prošla stresem, jsou exprimovány určité proteiny, které zabrání specifické sekvenci makromolekulární interakce v kontrolním bodě potřebné pro postup do další fáze.[17][18][19]
Aktivita TIGAR může zabránit buňkám postupovat do S fáze přes kontrolní bod známý u lidí jako bod omezení. Na samém začátku Fáze G1, protein zvaný retinoblastom (Rb) existuje v nefosforylovaném stavu. V tomto stavu se Rb váže na proteinový transkripční faktor E2F a brání E2F v aktivaci transkripce proteinů nezbytných pro S-fáze. Během normálního buněčného cyklu, jak G1 postupuje, bude Rb fosforylován ve specifické sadě postupných kroků proteiny zvanými cyklin dependentní kinázy (cdks) vázáno na cyklin bílkoviny. Specifické komplexy, které fosforylují Rb jsou cyklin D -cdk4 a cyklin E -cdk2.[20]
Když byl Rb mnohokrát fosforylován, disociuje se od E2F. E2F může aktivovat expresi genů S-fáze.[20] TIGAR může nepřímo zabránit průchodu buňky restrikčním bodem tím, že udržuje Rb nefosforylovaný.[12]
Když je exprimován, TIGAR snižuje hladiny buněčného ATP prostřednictvím své aktivity fosfatázy.[12] Pro fosforylaci Rb je k dispozici méně ATP, takže Rb zůstává nefosforylovaný a váže se na E2F, který nemůže aktivovat geny S fáze.[12] Exprese cyklinu D, ckd4, cyklinu E a cdk2 klesá, když je aktivní TIGAR, kvůli nedostatku ATP nezbytného pro jejich transkripci a překlad.[12] Tato aktivita TIGAR slouží k zastavení buněk v G1.[12]
Aktivita hexokinázy 2
Za podmínek s nízkým obsahem kyslíku známých jako hypoxie, malé množství TIGAR cestuje do mitochondrie a zvyšuje aktivitu hexokinázy 2 (HK2) vazbou na ni[21]
Během hypoxie se nazývala bílkovina Hif1α je aktivován a způsobí, že se TIGAR znovu lokalizuje z cytoplazma na vnější mitochondriální membrána.[21] Zde je HK2 vázán na anion kanál ve vnější mitochondriální membráně s názvem VDAC.[22] TIGAR váže hexokinázu 2 a zvyšuje její aktivitu dosud neznámým mechanismem.[21]
Hexokináza 2 (HK2) provádí následující reakci:
Glukóza + ATP -> Glukóza-6-fosfát + ADP [21][22][23]
Předpokládá se, že HK2 udržuje mitochondriální membránový potenciál udržováním vysokých úrovní ADP.[23] Rovněž předchází apoptóze několika způsoby: snižuje mitochondriální hladiny ROS,[21][23] a brání proteinu způsobující apoptózu Bax od vytvoření kanálu pomocí VDAC.[22] To se zastaví cytochrom C. protein procházející přes VDAC do cytoplazmy, kde spouští apoptózu prostřednictvím a kaspáza proteinová kaskáda.[22]
TIGAR se nerealokuje na mitochondrie a neváže HK2 za normálních buněčných podmínek,[21] nebo pokud buňka nemá dostatek glukózy.[21] Přemístění do mitochondrií nevyžaduje doménu fosfatázy TIGAR.[21] Místo toho 4 aminokyseliny na C-terminál konec TIGAR jsou zásadní.[21]
Ochrana před apoptózou
Zvýšená exprese TIGAR chrání buňky před apoptózou vyvolanou oxidačním stresem [24] snížením úrovní ROS.[9] TIGAR může nepřímo snížit ROS dvěma odlišnými způsoby. The intracelulární prostředí buňky určí, který z těchto dvou režimů působení TIGARU v buňce najednou převládá.[9][21]
Aktivita TIGARu fruktóza-2,6-bisfosfatázy snižuje ROS zvýšením aktivity fosfátové dráhy pentózy (PPP).[9] Glukóza-6-fosfát se hromadí v důsledku defosforylace F-2,6-BP pomocí TIGAR a vstupuje do PPP.[9] To způsobí, že PPP generuje více nikotinamid adenin dinukleotid (NADPH ).[9][25] NADPH je přepravcem elektrony který je buňkou používán jako a redukční činidlo v mnoha anabolické reakce. NADPH produkovaný PPP předává elektrony do oxidovaný glutathion molekuly (GSSG) za vzniku redukovaného glutathionu (GSH).[9][25]
GSH se stává redukční činidlo, a předává elektrony ROS peroxid vodíku za vzniku neškodné vody při reakci:
GSH + H202 -> H20 + GSSG [9][25]
Pokles H202 v důsledku aktivity TIGAR chrání před apoptózou.[9][25]
TIGAR také snižuje ROS zvýšením aktivity HK2. HK2 nepřímo udržuje hladinu ROS udržováním ADP hladiny na vnější mitochondriální membráně vysoké. Pokud hladiny ADP klesnou, rychlost dýchání se sníží a způsobí elektronový transportní řetězec aby se nadměrně snížil nadbytkem elektronů. Tyto přebytečné elektrony přecházejí na kyslík a tvoří ROS.[21]
Působení komplexu TIGAR / HK2 chrání buňky pouze před apoptózou za podmínek s nízkým obsahem kyslíku. Za normálních podmínek nebo za podmínek nedostatku cukru pochází ochrana zprostředkovaná TIGAR před apoptózou pouze z její aktivity bis-fosfatázy.[21]
TIGAR nemůže zabránit apoptóze cestou smrti, která je nezávislá na ROS a p53.[9] V některých buňkách může exprese TIGAR tlačit buňky dále k apoptóze.[9]
Interleukin 3 (IL-3) je a růstový faktor které se mohou vázat receptory na povrchu buňky a říká jí, aby přežila a rostla.[26] Když jsou buněčné linie závislé na IL-3 zbaveny IL-3, umírají[26] kvůli sníženému vychytávání a metabolismu glukózy.[26] Když je TIGAR nadměrně exprimován v buňkách zbavených IL-3, rychlost glykolýzy dále klesá, což zvyšuje rychlost apoptózy.[9]
Autofagie
Autofagie je, když buňka štěpí některé své vlastní organely lysozomální degradací. Autofagie se používá k odstranění poškozených organel nebo za podmínek hladu k poskytnutí dalších živin. Za normálních okolností dochází k autofagii cestou TSC-Mtor, ale může být indukována ROS. TIGAR, i při velmi nízkých hladinách, inhibuje autofagii snížením hladin ROS. Mechanismus, kterým to TIGAR dělá, je nezávislý na dráze Mtor, ale přesné podrobnosti nejsou známy.[27]
Možné role v rakovině
TIGAR může podporovat vývoj nebo inhibici několika rakoviny v závislosti na celulárním kontextu.[13][28][29][30] TIGAR může mít určitý účinek na tři charakteristiky rakoviny; schopnost nekontrolovaně se vyhnout apoptóze buněčné dělení a změnil metabolismus.[13][28][29][30][31] Mnoho rakovinných buněk změnilo metabolismus, kde rychlost glykolýzy a anaerobní dýchání jsou velmi vysoké oxidační dýchání je nízký, kterému se říká Warburgův efekt (nebo aerobní glykolýza ).[31] To umožňuje rakovinovým buňkám přežít za podmínek s nízkým obsahem kyslíku a pomocí molekul z dýchacích cest syntetizovat aminokyseliny a nukleové kyseliny k udržení rychlého růstu.[31]
v Gliom, typ rakoviny mozku, může být TIGAR nadměrně exprimován tam, kde má onkogenní - podobné účinky.[28] V tomto případě působí TIGAR na udržení energetické hladiny pro zvýšený růst zvýšením dýchání (udělením změněného metabolismu) a také chrání gliomové buňky před hypoxií vyvolanou apoptózou snížením ROS (způsobující únik apoptózy).[28] Přípravek TIGAR je nadměrně exprimován také u některých typů rakoviny prsu.[30]
v mnohočetný myelom, TIGAR exprese je spojena s aktivitou MUC-1. MUC-1 je onkoprotein který je nadměrně exprimován v mnohočetném myelomu a chrání tyto buňky před apoptózou vyvolanou ROS udržováním aktivity TIGAR. Když je aktivita MUC-1 odstraněna, hladiny TIGAR klesají a buňky procházejí apoptózou vyvolanou ROS.[29]
U typu rakoviny hlavy a krku známého jako nazofaryngeální rakovina, onkoprotein kináza c-Met udržuje TIGAR výraz. TIGAR zvyšuje rychlost glykolýzy a hladiny NADPH, což umožňuje rakovinným buňkám udržovat rychlý růst.[32]
TIGAR však může mít také inhibiční účinek na vývoj rakoviny tím, že brání buněčné proliferaci prostřednictvím své role při zastavení buněčného cyklu zprostředkovaného p53.[13]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000078237 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000038028 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Jen KY, Cheung VG (září 2005). "Identifikace nových cílových genů p53 v reakci ionizujícího záření". Cancer Res. 65 (17): 7666–73. doi:10.1158 / 0008-5472.CAN-05-1039. PMID 16140933.
- ^ Bensaad K, Tsuruta A, Selak MA, Vidal MN, Nakano K, Bartrons R, Gottlieb E, Vousden KH (červenec 2006). "TIGAR, p53-indukovatelný regulátor glykolýzy a apoptózy". Buňka. 126 (1): 107–20. doi:10.1016 / j.cell.2006.05.036. PMID 16839880. S2CID 15006256.
- ^ A b „Entrez Gene: C12orf5 chromozom 12 otevřený čtecí rámec 5“.
- ^ A b Jen KY, Cheung VG (září 2005). "Identifikace nových cílových genů p53 v reakci ionizujícího záření". Cancer Res. 65 (17): 7666–73. doi:10.1158 / 0008-5472.CAN-05-1039. PMID 16140933.
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti w X y z aa ab ac inzerát ae af ag ah Bensaad K, Tsuruta A, Selak MA, Vidal MN, Nakano K, Bartrons R, Gottlieb E, Vousden KH (červenec 2006). "TIGAR, p53-indukovatelný regulátor glykolýzy a apoptózy". Buňka. 126 (1): 107–20. doi:10.1016 / j.cell.2006.05.036. PMID 16839880. S2CID 15006256.
- ^ Zelená DR, Chipuk JE (červenec 2006). „p53 a metabolismus: Uvnitř TIGARU“. Buňka. 126 (1): 30–2. doi:10.1016 / j.cell.2006.06.032. PMID 16839873.
- ^ „Souhrn NCBI C12orf5 chromozom 12 otevřený čtecí rámec 5“.
- ^ A b C d E F G h i Madan E, Gogna R, Kuppusamy P, Bhatt M, Pati U, Mahdi AA (červenec 2012). „TIGAR indukuje zástavu buněčného cyklu zprostředkovanou p53 regulací komplexu RB-E2F1“. Br. J. Cancer. 107 (3): 516–26. doi:10.1038 / bjc.2012.260. PMC 3405207. PMID 22782351.
- ^ A b C d E F G h i j k l m n Ó Madan E, Gogna R, Bhatt M, Pati U, Kuppusamy P, Mahdi AA (prosinec 2011). „Regulace metabolismu glukózy p53: objevující se nové role supresoru nádoru“. Cílový cíl. 2 (12): 948–57. doi:10,18632 / oncotarget.389. PMC 3282098. PMID 22248668.
- ^ A b C d E F G Li H, Jogl G (leden 2009). "Strukturální a biochemické studie TIGAR (TP53-indukovaná glykolýza a regulátor apoptózy)". J. Biol. Chem. 284 (3): 1748–54. doi:10,1074 / jbc.M807821200. PMC 2615519. PMID 19015259.
- ^ Garrett, Reginald (2016). Biochemie. Stamford, CT: Cengage Learning. p. 631. ISBN 978-1305577206.
- ^ Voet JG, Voet D (2004). Biochemie (3. vyd.). New York: J. Wiley & Sons. ISBN 0-471-19350-X.
- ^ A b C Vousden KH, Lu X (srpen 2002). „Live or let die: the cell's response to p53“. Nat. Rev. Rakovina. 2 (8): 594–604. doi:10.1038 / nrc864. PMID 12154352. S2CID 6412605.
- ^ A b C Jackson SP, Bartek J (říjen 2009). „Reakce na poškození DNA v biologii a nemoci člověka“. Příroda. 461 (7267): 1071–8. Bibcode:2009Natur.461.1071J. doi:10.1038 / nature08467. PMC 2906700. PMID 19847258.
- ^ A b Elledge SJ (prosinec 1996). Msgstr "Kontrolní body buněčného cyklu: prevence krize identity". Věda. 274 (5293): 1664–72. Bibcode:1996Sci ... 274.1664E. doi:10.1126 / science.274.5293.1664. PMID 8939848. S2CID 39235426.
- ^ A b Henley SA, Dick FA (2012). „Rodina proteinů retinoblastomu a jejich regulační funkce v cyklu buněčného dělení savců“. Cell Div. 7 (1): 10. doi:10.1186/1747-1028-7-10. PMC 3325851. PMID 22417103.
- ^ A b C d E F G h i j k l Cheung EC, Ludwig RL, Vousden KH (prosinec 2012). „Mitochondriální lokalizace TIGAR pod hypoxií stimuluje HK2 a snižuje ROS a buněčnou smrt“. Proc. Natl. Acad. Sci. USA. 109 (50): 20491–6. Bibcode:2012PNAS..10920491C. doi:10.1073 / pnas.1206530109. PMC 3528527. PMID 23185017.
- ^ A b C d Pastorino JG, Shulga N, Hoek JB (březen 2002). „Mitochondriální vazba hexokinázy II inhibuje uvolňování a apoptózu vyvolané Bax indukovaným cytochromem c“. J. Biol. Chem. 277 (9): 7610–8. doi:10,1074 / jbc.M109950200. PMID 11751859.
- ^ A b C da-Silva WS, Gómez-Puyou A, de Gómez-Puyou MT, Moreno-Sanchez R, De Felice FG, de Meis L, Oliveira MF, Galina A (září 2004). „Aktivita mitokondriální vázané hexokinázy jako preventivní antioxidační obrana: tvorba ADP v ustáleném stavu jako regulační mechanismus membránového potenciálu a generování reaktivních forem kyslíku v mitochondriích“. J. Biol. Chem. 279 (38): 39846–55. doi:10,1074 / jbc.M403835200. PMID 15247300.
- ^ Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J (2007). "Volné radikály a antioxidanty při normálních fyziologických funkcích a lidských onemocněních". Int. J. Biochem. Cell Biol. 39 (1): 44–84. doi:10.1016 / j.biocel.2006.07.001. PMID 16978905.
- ^ A b C d Fico A, Paglialunga F, Cigliano L, Abrescia P, Verde P, Martini G, Iaccarino I, Filosa S (srpen 2004). „Glukóza-6-fosfátdehydrogenáza hraje klíčovou roli při ochraně před apoptózou vyvolanou oxidačně-redukčním stresem“. Smrt buňky se liší. 11 (8): 823–31. doi:10.1038 / sj.cdd.4401420. PMID 15044966.
- ^ A b C Vander Heiden MG, Plas DR, Rathmell JC, Fox CJ, Harris MH, Thompson CB (září 2001). „Růstové faktory mohou ovlivnit růst a přežití buněk prostřednictvím účinků na metabolismus glukózy“. Mol. Buňka. Biol. 21 (17): 5899–912. doi:10.1128 / MCB.21.17.5899-5912.2001. PMC 87309. PMID 11486029.
- ^ Bensaad K, Cheung EC, Vousden KH (říjen 2009). "Modulace intracelulárních hladin ROS pomocí TIGAR řídí autofagii". EMBO J.. 28 (19): 3015–26. doi:10.1038 / emboj.2009.242. PMC 2736014. PMID 19713938.
- ^ A b C d Wanka C, Steinbach JP, Rieger J (září 2012). „Regulátor glykolýzy a apoptózy indukovaný Tp53 (TIGAR) chrání gliomové buňky před smrtí buněk vyvolanou hladem up-regulací dýchání a zlepšením redoxní homeostázy buněk“. J. Biol. Chem. 287 (40): 33436–46. doi:10.1074 / jbc.M112.384578. PMC 3460445. PMID 22887998.
- ^ A b C Yin L, Kosugi M, Kufe D (leden 2012). „Inhibice onkoproteinu MUC1-C indukuje smrt buněk mnohočetného myelomu snížením regulace exprese TIGAR a vyčerpáním NADPH“. Krev. 119 (3): 810–6. doi:10.1182 / krev-2011-07-369686. PMC 3265204. PMID 22117045.
- ^ A b C Vyhrál KY, Lim SJ, Kim GY, Kim YW, Han SA, Song JY, Lee DK (únor 2012). "Regulační role p53 v metabolismu rakoviny prostřednictvím SCO2 a TIGAR u lidské rakoviny prsu". Hučení. Pathol. 43 (2): 221–8. doi:10.1016 / j.humpath.2011.04.021. PMID 21820150.
- ^ A b C Hanahan D, Weinberg RA (březen 2011). „Charakteristické znaky rakoviny: příští generace“. Buňka. 144 (5): 646–74. doi:10.1016 / j.cell.2011.02.013. PMID 21376230.
- ^ Lui VW, Wong EY, Ho K, Ng PK, Lau CP, Tsui SK, Tsang CM, Tsao SW, Cheng SH, Ng MH, Ng YK, Lam EK, Hong B, Lo KW, Mok TS, Chan AT, Mills GB (Březen 2011). „Inhibice c-Met down-reguluje expresi TIGAR a snižuje produkci NADPH vedoucí k buněčné smrti“. Onkogen. 30 (9): 1127–34. doi:10.1038 / dne 2010.490. PMC 3428712. PMID 21057531.
Další čtení
- Zelená DR, Chipuk JE (červenec 2006). „p53 a metabolismus: Uvnitř TIGARU“. Buňka. 126 (1): 30–2. doi:10.1016 / j.cell.2006.06.032. PMID 16839873.
- White, Kenneth E .; Evans, Wayne E .; O'Riordan, Jeffery L.H .; Speer, Marcy C .; Econs, Michael J .; Lorenz-Depiereux, Bettina; Grabowski, Monika; Meitinger, Thomas; Strom, Tim M. (listopad 2000). „Autosomálně dominantní hypofosfatemická křivice je spojena s mutacemi v FGF23“. Nat. Genet. 26 (3): 345–8. doi:10.1038/81664. PMID 11062477. S2CID 38870810.
- Hartley JL, Temple GF, Brasch MA (listopad 2000). „Klonování DNA pomocí in vitro místně specifické rekombinace“. Genome Res. 10 (11): 1788–95. doi:10,1101 / gr. 143000. PMC 310948. PMID 11076863.
- Katoh Y, Katoh M (srpen 2005). "Srovnávací genomika na savčím lokusu Fgf6-Fgf23". Int. J. Mol. Med. 16 (2): 355–8. doi:10,3892 / ijmm.16.2.355. PMID 16012775.





