Kvartérní amonný kation - Quaternary ammonium cation
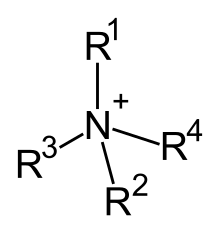
Kvartérní amonné kationty, také známý jako quats, jsou kladně účtovány polyatomové ionty struktury NR+
4, R je alkyl skupina nebo aryl skupina.[1] Na rozdíl od amonný ion (NH+
4) a primární, sekundární nebo terciární amonium kationty, kvartérní amonné kationty jsou trvale nabité, nezávisle na pH jejich řešení. Kvartérní amonné soli nebo kvartérní amoniové sloučeniny (volala kvartérní aminy v ropné pole řeč) soli kvartérních amoniových kationtů. Polyquaty jsou různé inženýrství polymer formy, které poskytují více quat molekul ve větší molekule.


Syntéza
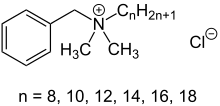
Kvartérní amoniové sloučeniny se připravují alkylace z terciární aminy s halogenovaný uhlovodík.[3] Ve starší literatuře se tomu často říká a Menshutkinova reakce, nicméně moderní chemici to obvykle označují jednoduše jako kvarternizace.[4] Reakci lze použít k výrobě sloučeniny s nestejnou délkou alkylového řetězce; například při výrobě kationtové povrchově aktivní látky jedna z alkylových skupin na aminu je obvykle delší než ostatní.[5] Typická syntéza je pro benzalkoniumchlorid z alkyldimethylaminu s dlouhým řetězcem a benzylchlorid:
- CH3(CH2)nN (CH3)2 + ClCH2C6H5 → [CH3(CH2)nN (CH3)2CH2C6H5]+Cl−
Reakce
Kvartérní amoniové kationty jsou nereaktivní vůči ještě silným elektrofily, oxidanty, a kyseliny. Jsou také stabilní vůči většině nukleofily. To je indikováno stabilitou hydroxid soli jako tetramethylamonium hydroxid a tetrabutylamonium hydroxid. Kvůli jejich odolnosti bylo izolováno mnoho neobvyklých aniontů jako kvartérních amonných solí. Mezi příklady patří tetramethylamonium pentafluoroxenát, obsahující vysoce reaktivní pentafluoroxenát (XeF−
5) ion. Manganistan lze solubilizovat v organický rozpouštědla, pokud jsou nasazeny jako NBu+
4 sůl.[6][7]
S výjimečně silnými bázemi dochází k degradaci quat kationtů. Podstupují Sommelet – Hauserův přesmyk[8] a Stevensův přesmyk,[9] stejně jako dealkylace za drsných podmínek nebo v přítomnosti silných nukleofilů, jako jsou thioláty. Kvartérní amoniové kationty obsahující jednotky N – C – C – H mohou také podstoupit Hofmannova eliminace a Emde degradace.
Aplikace
Kvartérní amonné soli se používají jako dezinfekční prostředky, povrchově aktivní látky, aviváže, a jako antistatické látky (např. v šampony ). v kapalný aviváže, chlorid soli se často používají. v sušička antický proužky, síran soli se často používají. Starší hliník elektrolytické kondenzátory a spermicidní želé také obsahují kvartérní amonné soli.
Jako antimikrobiální látky
Bylo také prokázáno, že kvartérní amoniové sloučeniny mají antimikrobiální aktivitu.[11] Určité kvartérní amoniové sloučeniny, zejména ty, které obsahují dlouhé alkylové řetězce, se používají jako antimikrobiální látky a dezinfekční prostředky. Příklady jsou benzalkoniumchlorid, benzethonium chlorid, methylbenzethoniumchlorid, cetalkoniumchlorid, cetylpyridiniumchlorid, cetrimonium, cetrimid chlorid dofaničitý, tetraethylamoniumbromid, didecyldimethylamoniumchlorid a domifen bromid. Také dobrý proti houby, améby, a obaleno viry,[12] Předpokládá se, že kvartérní amoniové sloučeniny působí rozrušením buněčná membrána nebo virová obálka.[13] Kvartérní amonné sloučeniny jsou smrtelné pro širokou škálu organismů kromě endospory, Mycobacterium tuberculosis a neobalené viry.
Kvartérní amoniové sloučeniny jsou kationtové čistící prostředky, stejně jako dezinfekční prostředky, a jako takové mohou být použity k odstranění organického materiálu. Jsou velmi efektivní v kombinaci s fenoly. Kvartérní amoniové sloučeniny jsou deaktivovány aniontovými detergenty (včetně běžných mýdel). Také fungují nejlépe měkké vody.[Citace je zapotřebí ] Efektivní úrovně jsou 200 ppm. Jsou účinné při teplotách do 100 ° C (212 ° F).
Kvartérní amonné soli se běžně používají v stravovací služba jako dezinfekční prostředky.
Katalyzátory fázového přenosu
V organické chemii se kvartérní amonné soli používají jako katalyzátory fázového přenosu (PTC). Takové katalyzátory urychlují reakce mezi činidly rozpuštěnými v nemísitelných rozpouštědlech. Vysoce reaktivní činidlo dichlorkarbenu je generován prostřednictvím PTC reakcí chloroform a vodné hydroxid sodný.

Aviváže a vlasové kondicionéry
V padesátých letech distearyldimethylamoniumchlorid (DHTDMAC), byl představen jako aviváž. Tato sloučenina byla přerušena, protože kation se biodegraduje příliš pomalu. Současná změkčovadla tkanin jsou založena na solích kvartérních amoniových kationtů, kde je mastná kyselina spojena s kvartérním centrem prostřednictvím esterových vazeb; tito jsou obyčejně odkazoval se na jako betain -estery nebo ester-kvaty a jsou náchylné k degradaci, např hydrolýza.[14] Charakteristické je, že kationty obsahují jeden nebo dva dlouhé alkyl řetězce odvozené od mastných kyselin navázané na ethoxylovaný amonná sůl.[15] Mohou být odvozeny další kationtové sloučeniny imidazolium, guanidinium, substituované aminové soli nebo kvartérní alkoxy amonné soli.[16]
- Kationtové povrchově aktivní látky používané jako změkčovadla tkanin
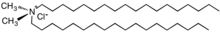
Distearyldimethylamoniumchlorid, raná generace aviváž s nízkou biologickou rozložitelností, která byla vyřazena.
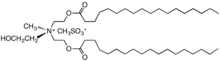
Další diesterquat, moderní aviváž.

Diethylester dimethylamoniumchlorid používaný jako aviváž.
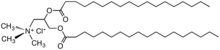
Další diesterquat používaný jako aviváž.
Díky antistatickým vlastnostem, díky nimž jsou kvartérní amonné soli užitečné jako změkčovače textilií, jsou také užitečné vlasové kondicionéry a šampony.[17] Tato myšlenka byla průkopníkem Henkel s patentem z roku 1984.[18] Mezi příklady patří cetrimonium chlorid a behentrimoniumchlorid.[19]
Zpomalovače růstu rostlin
Cycocel (chlormequat chlorid) snižuje výšku rostlin tím, že inhibuje produkci gibereliny, primární rostlinné hormony odpovědné za prodloužení buněk. Proto jsou jejich účinky primárně na tkáně stonku, řapíku a květu. Menší účinky jsou patrné ve snížení expanze listů, což má za následek silnější listy s tmavší zelenou barvou.[20]
Přirozený výskyt
Glycin betain, nalezen v osmolyty, stabilizuje osmotický tlak v buňkách.[21]


Cholin je předchůdcem neurotransmiteru acetylcholin. Cholin je také složkou lecitin, který je přítomen v mnoha rostlinách a zvířecích orgánech.[22] Nachází se v fosfolipidy. Například, fosfatidylcholiny, hlavní složka biologické membrány, jsou členy lecitin skupina tukových látek v živočišných a rostlinných tkáních.[23]
Karnitin podílí se na beta-oxidace mastných kyselin.

Zdravé efekty
Kvartérní amoniové sloučeniny mohou vykazovat řadu zdravotních účinků, mezi něž patří mírné podráždění kůže a dýchacích cest [24] až po těžké poleptání žíraviny na pokožce a gastrointestinální stěna (v závislosti na koncentraci), gastrointestinální příznaky (např. nevolnost a zvracení), kóma, křeče, hypotenze a smrt.[25]
Oni jsou považováni za chemickou skupinu zodpovědnou za anafylaktické reakce které se vyskytují při použití neuromuskulární blokátory v době celková anestézie v chirurgická operace.[26] Quaternium-15 je nejčastější příčinou alergie kontaktní dermatitida rukou (16,5% v 959 případech)[27]
Možné reprodukční účinky u laboratorních zvířat
Kvartérní dezinfekční prostředky na bázi amonia (Virex a Quatricide) byly předběžně identifikovány jako nejpravděpodobnější příčina skoků vrozených vad a problémů s plodností laboratorních myší v klecích. Mezi účinné látky v dezinfekčních prostředcích patří alkyl dimethyl benzyl amonium chlorid (ADBAC) a didecyldimethylamoniumchlorid (DDAC).[28][29] Podobný odkaz byl předběžně identifikován u zdravotních sester.[30] Studie jsou v rozporu s dřívějšími toxikologickými údaji přezkoumávanými Agenturou pro ochranu životního prostředí USA (US EPA) a Evropskou komisí.[31]
Kvantifikace
Kvantifikace kvartérní amoniové sloučeniny V prostředí a biologických vzorcích je použití konvenčních chromatografických technik problematické, protože sloučeniny jsou vysoce rozpustné ve vodě. Při jejich analýze pomocí kapalinová chromatografie spojená tandemová hmotnostní spektrometrie bylo zjištěno, že se řídí pravidlem výjimky. Pod standardem ionizace elektrosprejem (ESI) podmínky, mono- a di-kvartérní amoniové sloučeniny tvoří molekulární ionty se vzorcem mq/zq spíše než m + z/z.[je zapotřebí objasnění ] Vznik mq/2 je pozorován u dvojkvartérních amoniových sloučenin (jako diquat ) jako prekurzorový ion a mq/1 jako produktový ion v důsledku ztráty jednoho z kvartérního náboje během CID. U dvojkvarterních amoniových sloučenin může tento proces také vést k tvorbě fragmentových iontů s vyšší hmotností ve srovnání s jejich prekurzorovým iontem. Hydrofilní interakce kapalinová chromatografie Bylo popsáno, že separace prokazuje úspěšnou separaci kvartérních amoniových sloučenin pro jejich kvantifikaci v ESI-MS / MS s vyšší přesností.[32]
Viz také
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “kvartérní amoniové sloučeniny ". doi:10,1351 / zlatá kniha.Q05003
- ^ A b Kern, Axel; Näther, Christian; Studt, Felix; Tuczek, Felix (2004). „Aplikace univerzálního silového pole na smíšené klastry Fe / Mo − S / Se kubanů a heterokubanů. 1. Substituce síry selenem v sérii [Fe4X4 (YCH3) 4] 2-; X = S / Se a y = S / Se † ". Anorganická chemie. 43 (16): 5003–5010. doi:10.1021 / ic030347d. PMID 15285677.
- ^ Brasen, W. R .; Hauser, C. R. (1954). „o-methylbenzylalkohol“. Organické syntézy. 34: 58. doi:10.15227 / orgsyn.034.0058.
- ^ Smith, Michael B .; March, Jerry (2001), Pokročilá organická chemie: reakce, mechanismy a struktura (5. vydání), New York, NY: Wiley-Interscience, ISBN 0-471-58589-0
- ^ Kosswig, K. "Surfaktanty". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a25_747.
- ^ Herriott, Arthur W. (1977). "Fialový benzen: Solubilizace aniontů v organických rozpouštědlech". Journal of Chemical Education. 54 (4): 229. Bibcode:1977JChEd..54Q.229H. doi:10.1021 / ed054p229.1.
- ^ Doheny, Anthony J., Jr.; Ganem, Bruce (1980). „Purple benzene revisited“. Journal of Chemical Education. 57 (4): 308. Bibcode:1980JChEd..57..308D. doi:10.1021 / ed057p308.1.
- ^ Brasen, W. R .; Hauser, C. R. (1963). „2-methylbenzyldimethylamin“. Organické syntézy.; Kolektivní objem, 4, str. 585
- ^ Pine, Stanley H. (2011). „Přezkumy kvartérních amonných solí podporované základnou“. Organické reakce. 403–464. doi:10.1002 / 0471264180.nebo018.04. ISBN 978-0471264187.
- ^ Lackner, Maximilian; Guggenbichler, Josef Peter (2013). "Antimikrobiální povrchy". Ullmann's Encyclopedia of Industrial Chemistry. s. 1–13. doi:10.1002 / 14356007.q03_q01. ISBN 9783527306732.
- ^ Jia, Zhishen; Shen, Dongfeng; Xu, Weiliang (2001). "Syntéza a antibakteriální aktivity kvartérní amonné soli chitosanu". Výzkum sacharidů. 333 (1): 1–6. doi:10.1016 / S0008-6215 (01) 00112-4. PMID 11423105.
- ^ Abedon, Stephen T. „Specifické antimikrobiální látky“. Ohio State University. Archivovány od originál dne 15. 10. 2008. Citováno 2020-02-14.
- ^ Cocco, Alexandra; Wellington Luiz de Oliveira da Rosa; Adriana Fernandes da Silva; Rafael Guerra Lund; Evandro Piva (2015). "Systematický přehled o antibakteriálních monomerech používaných v dentálních adhezivních systémech, současný stav a další vyhlídky". Journal of Dental Material. 31: 1345–1362. doi:10.1016 / j.dental.2015.08.155.
- ^ Hellberg, Per-Erik; Bergström, Karin; Holmberg, Krister (leden 2000). "Štěpitelné povrchově aktivní látky". Journal of Surfactants and Detergents. 3 (1): 81–91. doi:10.1007 / s11743-000-0118-z.
- ^ „Informace pro zákazníky Henkel“. Henkelconsumerinfo.com. Archivovány od originál dne 2019-10-18. Citováno 2009-06-04.
- ^ Smulders, E .; Sung, E. "Prací prostředky, 2. Složky a výrobky". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.o15_013.
- ^ Záznam v databázi výrobků pro domácnost z NLM
- ^ "Kondicionéry na vlasy s kvartérním amonným složením US4744977". Patenty Google. 14. listopadu 1985.
- ^ Co je to cetrimoniumchlorid? Archivováno 04.03.2012 na Wayback Machine na naturalcurly.com
- ^ „Archivovaná kopie“. Archivovány od originál dne 25. září 2011. Citováno 19. července 2012.CS1 maint: archivovaná kopie jako titul (odkaz) Wageningenská zemědělská univerzita, Nizozemsko
- ^ Sleator, Roy D .; Wouters, Jeroen; Gahan, Cormac G. M .; Abee, Tjakko; Hill, Colin (2001). „Analýza role OpuC, systému transportu osmolytu, v toleranci solí a virulenci Listeria monocytogenes“. Aplikovaná a environmentální mikrobiologie. 67 (6): 2692–2698. doi:10.1128 / AEM.67.6.2692-2698.2001. PMC 92926. PMID 11375182.
- ^ Zeisel, S. H.; da Costa, K. A. (listopad 2009). „Cholin: základní živina pro veřejné zdraví“. Recenze výživy. 67 (11): 615–23. doi:10.1111 / j.1753-4887.2009.00246.x. PMC 2782876. PMID 19906248.
- ^ Jackowski, Suzanne; Cronan, jr., John E .; Rock, Charles O. (1991). „Kapitola 2: Metabolismus lipidů v prokaryotech“. In Vance, Dennis E .; Vance, J. (eds.). Biochemie lipidů, lipoproteinů a membrán. Elsevier. str.80–81. ISBN 0-444-89321-0.
- ^ Bello, Anila; Quinn, Margaret M .; Perry, Melissa J .; Milton, Donald K. (2009). „Charakterizace pracovních expozic čisticím prostředkům používaným pro běžné úklidové úkoly - pilotní studie nemocničních čističů“. Environmentální zdraví. 8: 11. doi:10.1186 / 1476-069X-8-11. PMC 2678109. PMID 19327131.
- ^ Kvartérní amonium (PIM G022)
- ^ Harper, N. J. N .; et al. (2009). „Podezření na anafylaktické reakce spojené s anestezií“. Anestézie. 64 (2): 199–211. doi:10.1111 / j.1365-2044.2008.05733.x. PMC 3082210. PMID 19143700.
- ^ Warshaw, E. M .; et al. (2007). „Kontaktní dermatitida rukou: Průřezové analýzy dat skupiny North American Contact Dermatitis Group, 1994-2004“. Journal of the American Academy of Dermatology. 57 (2): 301–314. doi:10.1016 / j.jaad.2007.04.016. PMID 17553593.
- ^ Hunt, P (červen 2008). „Laboratorní dezinfekční prostředek poškozuje plodnost myší. Patricia Huntová, rozhovor s Brendanem Maherem“. Příroda. 453 (7198): 964. doi:10.1038 / 453964a. PMID 18563110.
- ^ Melin VE, Potineni H, Hunt P, Griswold J, Siems B, Werre SR, Hrubec TC (2014). „Vystavení běžným kvartérním amonným dezinfekčním prostředkům snižuje plodnost u myší“. Reprodukční toxikologie. 50: 163–70. doi:10.1016 / j.reprotox.2014.07.071. PMC 4260154. PMID 25483128.
- ^ Gaskins, Audrey (2017). „Pracovní použití dezinfekčních prostředků na vysoké úrovni a plodnost mezi sestrami“. Scand J Work Environ Health. 43 (2): 171–180. doi:10,5271 / sjweh.3623. PMC 5840865. PMID 28125764.
- ^ Úřad pro prevenci, pesticidy a toxické látky, US EPA (srpen 2006). „Rozhodnutí o opětovné registraci pro alifatické alkylové kvartéry (DDAC)“. EPA739-R-06-008.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Velpandiana, Thirumurthy; Nirmala, Jayabalan; Aroraa, krása; Ravia, Alok Kumar; Kotnalaa, Ankita (říjen 2012). „Porozumění problémům s náboji v mono a di-kvartérních amonných sloučeninách pro jejich stanovení pomocí LC / ESI-MS / MS“. Analytické dopisy. 45 (16): 2367–2376. doi:10.1080/00032719.2012.693140.
externí odkazy
- Toxicita kvartérního amonia
- Zhang, Chang; Cui, Fang; Zeng, Guang-ming; Jiang, Min; Yang, Zhong-zhu; Yu, Zhi-gang; Zhu, Meng-ying; Shen, Liu-qing (15. června 2015). „Kvartérní amoniové sloučeniny (QAC): přehled o výskytu, osudu a toxicitě v životním prostředí“. Věda o celkovém prostředí. 518–519: 352–362. Bibcode:2015ScTEn.518..352Z. doi:10.1016 / j.scitotenv.2015.03.007. PMID 25770948.



