Efflux (mikrobiologie) - Efflux (microbiology)
tento článek potřebuje další citace pro ověření. (Leden 2007) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
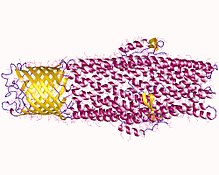

Všechny mikroorganismy, až na několik výjimek, mají ve svém genomu vysoce konzervované sekvence DNA, které jsou přepsány a přeloženy do efluxních pump. Efluxní pumpy jsou schopné přemisťovat různé toxické sloučeniny buňky, jako antibiotika, těžké kovy, organické znečišťující látky, rostlinné sloučeniny, signály snímající kvora, bakteriální metabolity a neurotransmitery přes aktivní výtok, což je zásadní součást xenobiotický metabolismus. Tento aktivní efluxní mechanismus je zodpovědný za různé typy rezistence na bakteriální patogeny v bakteriálních druzích - nejvíce se jedná o rezistenci na antibiotika, protože mikroorganismy mohou přizpůsobit efluxní pumpy k odvádění toxinů z cytoplazmy a do extracelulárního média.[1]
Efluxní systémy fungují prostřednictvím energeticky závislého mechanismu (aktivní transport ) k odčerpání nežádoucích toxických látek pomocí specifických výtokových čerpadel. Některé efluxní systémy jsou specifické pro léčiva, zatímco jiné mohou pojmout více léčiv s malými transportéry pro více léků (SMR).[2][3]
Efflux čerpadla jsou bílkovinné transportéry lokalizované v cytoplazmatická membrána všech druhů buněk. Oni jsou aktivní transportéry, což znamená, že k výkonu své funkce potřebují zdroj chemické energie. Někteří jsou primární aktivní transportéry s využitím adenosintrifosfát hydrolýza jako zdroj energie, zatímco jiné ano sekundární aktivní transportéry (uniporters, sympatizanti nebo antiportery ), ve kterém je doprava spojena s rozdíl elektrochemického potenciálu vytvořeno čerpáním vodík nebo sodík ionty do cely.
Bakteriální
Transportéry bakteriálních efluxů jsou rozděleny do pěti hlavních superrodin, na základě jejich aminokyselina sekvence a zdroj energie použitý k vývozu jejich substrátů:
- The hlavní pomocná rodina (MFS)[4]
- The Kazeta vázající ATP nadčeleď (ABC)[4]
- Malá skupina více léčivých přípravků (SMR)[4]
- The nadrodina odpor-nodulace-buněčné dělení (RND)[4]
- The multi antimikrobiální vytlačovací protein rodina (MATE).[4]
Z nich je primárními transportéry pouze nadrodina ABC, zbytek je sekundární transportéry s využitím proton nebo sodík spád jako zdroj energie. Zatímco MFS dominuje v Grampozitivní bakterie, rodina RND byla kdysi považována za jedinečnou pro gramnegativní bakterie. Od té doby byly nalezeny ve všech hlavních království.[5]
Struktura
Effluxní pumpy obecně sestávají z proteinu vnější membrány, středního periplazmatického proteinu, proteinu vnitřní membrány a transmembránového kanálu. Transmembránový kanál je umístěn ve vnější membráně buňky. Potrubí je také vázáno na dva další proteiny: protein periplazmatické membrány a integrální membránový transportér. Periplazmatický membránový protein a protein vnitřní membrány systému jsou spojeny pro ovládání otevírání a zavírání kanálu (kanálu). Když se toxin váže na tento protein vnitřní membrány, proteiny vnitřní membrány vedou k biochemické kaskádě, která přenáší signály do periplazmatického membránového proteinu a proteinu vnější membrány, aby otevřel kanál a přesunul toxin z buňky. Tento mechanismus využívá energeticky závislou interakci protein-protein, která je generována přenosem toxinu pro iont H + transportérem vnitřní membrány.[6]
Funkce
Přestože antibiotika jsou klinicky nejdůležitějšími substráty efluxních systémů, je pravděpodobné, že většina efluxních pump má jiné přirozené fyziologické funkce. Mezi příklady patří:
- The E-coli AcrAB efluxní systém, který má fyziologickou úlohu odčerpávat žlučové kyseliny a mastné kyseliny, aby snížil jejich toxicitu.[7]
- Čerpadlo řady Ptr řady MFS Streptomyces pristinaespiralis se zdá být autoimunita pumpa pro tento organismus, když zapne produkci pristinamycinů I a II.[8]
- Systém AcrAB – TolC v E-coli je podezření, že hraje roli v transportu složek vápníkového kanálu v E-coli membrána.[9]
- Systém MtrCDE hraje ochrannou roli tím, že poskytuje rezistenci vůči fekálním lipidům v rektálních izolátech Neisseria gonorrhoeae.[10]
- Odtokový systém AcrAB z Erwinia amylovora je pro tento organismus důležitý virulence kolonizace rostlin (hostitelů) a odolnost vůči rostlinným toxinům.[11]
- Složka MexXY víceúčelového efluxního systému MexXY-OprM společnosti P. aeruginosa je indukovatelný antibiotiky, které cílí na ribozomy prostřednictvím produktu genu PA5471.[12]
Schopnost efluxních systémů rozpoznávat velké množství jiných látek než jejich přirozených substrátů je pravděpodobně proto, že rozpoznávání substrátů je založeno na fyzikálně-chemické vlastnosti, jako např hydrofobicita, aromatičnost a ionizovatelný spíše než na definovaných chemických vlastnostech, jako v klasickém enzym -Podklad nebo ligand -receptor uznání. Protože většina antibiotik je amfifilní molekuly - které mají hydrofilní i hydrofobní charakter - jsou snadno rozpoznatelné mnoha efluxními pumpami.[Citace je zapotřebí ]
Dopad na antimikrobiální rezistenci
Dopad efluxních mechanismů na antimikrobiální rezistence je velký; obvykle se to připisuje následujícímu:
- The genetický mohou být kódovány prvky kódující efluxní pumpy chromozomy a / nebo plazmidy, což přispívá jak k vnitřní (přirozené), tak k získané rezistenci. Jako vnitřní mechanismus rezistence mohou geny efluxní pumpy přežít nepřátelské prostředí (například v přítomnosti antibiotik), které umožňuje výběr mutanti to přes-vyjádřit tyto geny. Nachází se na přenosných genetických prvcích jako plazmidy nebo transpozice je také výhodný pro mikroorganismy, protože umožňuje snadné šíření efluxních genů mezi vzdálenými druhy.[13]
- Antibiotika mohou působit jako induktory a regulátory výraz některých efluxních čerpadel.[12]
- Exprese několika efluxních pump v daném bakteriálním druhu může vést k širokému spektru rezistence při zvažování sdílených substrátů některých efluxních pump s více léčivy, kde jedna efluxní pumpa může propůjčit rezistenci vůči širokému spektru antimikrobiálních látek.[14]
Eukaryotický
V eukaryotických buňkách je existence efluxních pump známá od objevu P-glykoprotein v roce 1976 Juliano a Ling.[15] Efluxní pumpy jsou jednou z hlavních příčin rezistence proti rakovině v eukaryotických buňkách. Zahrnují monokarboxylátové transportéry (MCT), rezistence na více léků proteiny (MDR) - označované také jako P-glykoprotein, proteiny spojené s multirezistencí (MRP), transportéry peptidů (PEPT) a transportéry Na + fosfátů (NPT). Tyto transportéry jsou distribuovány po určitých částech renálního proximálního tubulu, střeva, jater, hematoencefalické bariéry a dalších částech mozku.
Inhibitory
V současné době probíhá několik studií zaměřených na vývoj léků, které lze současně podávat s antibiotiky, aby působily jako inhibitory vytlačování antibiotik pomocí efluxu. Dosud nebyl pro terapeutické použití schválen žádný efluxní inhibitor, ale některé se používají ke stanovení prevalence efluxních pump u klinických izolátů a u buněčná biologie výzkum. Verapamil například slouží k blokování P-glykoprotein zprostředkovaný odtok vazby DNA fluorofory, čímž usnadňuje třídění fluorescenčních buněk podle obsahu DNA. Rozličný přírodní produkty Bylo prokázáno, že inhibují bakteriální efluxní pumpy včetně karotenoidů kapsanthin a kapsorubin,[16] flavonoidy rotenon a chrysin,[16] a alkaloid lysergol.[17] Nějaký nanočástice, například oxid zinečnatý, také inhibují bakteriální efluxní pumpy.[18]
Viz také
Reference
- ^ Blanco P, Hernando-Amado S, Reales-Calderon JA, Corona F, Lira F, Alcalde-Rico M a kol. (Únor 2016). „Bakteriální víceúčelová efluxní čerpadla: mnohem více než determinanty rezistence na antibiotika“. Mikroorganismy. 4 (1): 14. doi:10,3390 / mikroorganismy4010014. PMC 5029519. PMID 27681908.
- ^ Bay DC, Turner RJ (2016). Malá víceúčelová odtoková čerpadla odolná vůči více lékům. Švýcarsko: Springer International Publishing. p. 45. ISBN 978-3-319-39658-3.
- ^ Sun J, Deng Z, Yan A (říjen 2014). „Bakteriální efluxní pumpy na více léčiv: mechanismy, fyziologie a farmakologické využití“. Sdělení o biochemickém a biofyzikálním výzkumu. 453 (2): 254–67. doi:10.1016 / j.bbrc.2014.05.090. PMID 24878531.
- ^ A b C d E Delmar JA, Su CC, Yu EW (2014). "Bakteriální multidrogové efluxní transportéry". Roční přehled biofyziky. 43: 93–117. doi:10.1146 / annurev-biophys-051013-022855. PMC 4769028. PMID 24702006.
- ^ Lubelski J, Konings WN, Driessen AJ (září 2007). „Distribuce a fyziologie transportérů typu ABC přispívající k multirezistenci bakterií“. Recenze mikrobiologie a molekulární biologie. 71 (3): 463–76. doi:10.1128 / MMBR.00001-07. PMC 2168643. PMID 17804667.
- ^ Ughachukwu P, Unekwe P (červenec 2012). „Odtok zprostředkovaný efluxní pumpou v chemoterapii“. Annals of Medical and Health Sciences Research. 2 (2): 191–8. doi:10.4103/2141-9248.105671. PMC 3573517. PMID 23439914.
- ^ Okusu H, Ma D, Nikaido H (leden 1996). „AcrAB efluxní pumpa hraje hlavní roli ve fenotypu rezistence na antibiotika mutantů Escherichia coli s více rezistencí na antibiotika (Mar)“. Journal of Bacteriology. 178 (1): 306–8. doi:10.1128 / jb.178.1.306-308.1996. PMC 177656. PMID 8550435.
- ^ Vecchione JJ, Alexander B, Sello JK (listopad 2009). „Dvě zřetelné hlavní efluxní pumpy nadrodiny hlavních zprostředkovatelů zprostředkovávají rezistenci na chloramfenikol v Streptomyces coelicolor“. Antimikrobiální látky a chemoterapie. 53 (11): 4673–7. doi:10.1128 / AAC.00853-09. PMC 2772354. PMID 19687245.
- ^ Du D, Wang Z, James NR, Voss JE, Klimont E, Ohene-Agyei T a kol. (Květen 2014). "Struktura víceúčelové efluxní pumpy AcrAB-TolC". Příroda. 509 (7501): 512–5. Bibcode:2014Natur.509..512D. doi:10.1038 / příroda13205. PMC 4361902. PMID 24747401.
- ^ Rouquette C, Harmon JB, Shafer WM (srpen 1999). „Indukce systému efluxní pumpy kódované mtrCDE Neisseria gonorrhoeae vyžaduje MtrA, protein podobný AraC“. Molekulární mikrobiologie. 33 (3): 651–8. doi:10.1046 / j.1365-2958.1999.01517.x. PMID 10417654.
- ^ Pletzer D, Weingart H (leden 2014). „Charakterizace AcrD, multidrogové efluxní pumpy typu rezistence-nodulační buněčné dělení z patogenu požární plíseň Erwinia amylovora. Mikrobiologie BMC. 14: 13. doi:10.1186/1471-2180-14-13. PMC 3915751. PMID 24443882.
- ^ A b Morita Y, Sobel ML, Poole K (březen 2006). „Antibiotická indukovatelnost víceúčelového efluxního systému MexXY Pseudomonas aeruginosa: účast antibiotického indukovatelného produktu genu PA5471“. Journal of Bacteriology. 188 (5): 1847–55. doi:10.1128 / JB.188.5.1847-1855.2006. PMC 1426571. PMID 16484195.
- ^ Li XZ, Plésiat P, Nikaido H (duben 2015). „Výzva efluxní rezistence vůči antibiotikům u gramnegativních bakterií“. Recenze klinické mikrobiologie. 28 (2): 337–418. doi:10.1128 / CMR.00117-14. PMC 4402952. PMID 25788514.
- ^ Blanco P, Hernando-Amado S, Reales-Calderon JA, Corona F, Lira F, Alcalde-Rico M a kol. (Únor 2016). „Bakteriální víceúčelová efluxní čerpadla: mnohem více než determinanty rezistence na antibiotika“. Mikroorganismy. 4 (1): 14. doi:10,3390 / mikroorganismy4010014. PMC 5029519. PMID 27681908.
- ^ Juliano RL, Ling V (listopad 1976). "Povrchový glykoprotein modulující permeabilitu léčiva u mutantů vaječníků čínského křečka". Biochimica et Biophysica Acta (BBA) - biomembrány. 455 (1): 152–62. doi:10.1016/0005-2736(76)90160-7. PMID 990323.
- ^ A b Molnár J, Engi H, Hohmann J, Molnár P, Deli J, Wesolowska O a kol. (2010). „Zrušení rezistence na více léčivých přípravků přírodními látkami z rostlin“. Aktuální témata v medicinální chemii. 10 (17): 1757–68. doi:10.2174/156802610792928103. PMID 20645919.
- ^ Cushnie TP, Cushnie B, Lamb AJ (listopad 2014). „Alkaloidy: přehled jejich antibakteriálních, antibiotik zesilujících a antivirulenčních aktivit“. International Journal of Antimicrobial Agents. 44 (5): 377–86. doi:10.1016 / j.ijantimicag.2014.06.001. PMID 25130096.
- ^ Banoee M, Seif S, Nazari ZE, Jafari-Fesharaki P, Shahverdi HR, Moballegh A, et al. (Květen 2010). "Nanočástice ZnO zlepšily antibakteriální aktivitu ciprofloxacinu proti Staphylococcus aureus a Escherichia coli" (PDF). Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (2): 557–61. doi:10,1002 / jbm.b.31615. PMID 20225250.
