Fischerova syntéza oxazolu - Fischer oxazole synthesis
| Fischerova syntéza oxazolu | |
|---|---|
| Pojmenoval podle | Hermann Emil Fischer |
| Typ reakce | Reakce tvořící prsten |
The Fischerova syntéza oxazolu je chemická syntéza z oxazol od a kyanohydrin a aldehyd v přítomnosti bezvodý kyselina chlorovodíková.[1] Tuto metodu objevil Emil Fischer v roce 1896.[2] Samotný kyanohydrin je odvozen od samostatného aldehydu. The reaktanty samotné syntézy oxazolu, kyanohydrinu aldehydu a druhého samotného aldehydu, jsou obvykle přítomny v ekvimolárních množstvích.[3] Oba reaktanty obvykle mají aromatický skupina, která se objeví na konkrétních pozicích ve výsledku heterocyklus.
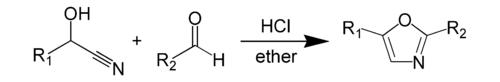
Specifičtější příklad syntézy Fischerova oxazolu zahrnuje reakci nitrilu kyseliny mandlové s benzaldehyd čímž se získá 2,5-difenyl-oxazol.[4]

Dějiny
Fischer vyvinul Fischerovu syntézu oxazolu během svého působení v Berlínská univerzita. Fischerova syntéza oxazolů byla jednou z prvních syntéz vyvinutých k výrobě 2,5-disubstituovaných oxazolů.[4]
Mechanismus
Fischerova syntéza oxazolu je typem dehydratační reakce které mohou nastat za mírných podmínek v a přeskupení skupin, které se nezdají být možné. K reakci dochází rozpuštěním reaktanty v suchu éter a prochází roztokem suchým, plynným chlorovodík. Produkt, kterým je 2,5-disubstituovaný oxazol, sráží jako hydrochlorid a lze je převést na volná základna přidáním vody nebo varem s alkoholem.[1]
The kyanohydriny a aldehydy obvykle se používají pro syntézu aromatický, nicméně byly případy, kdy alifatický byly použity první sloučeniny. Prvním krokem mechanismu je přidání plynných HCl do kyanohydrin 1. The kyanohydrin odebírá vodík z HCl zatímco chloridový ion útočí na uhlík v kyanoskupina. Tento první krok vede k tvorbě iminochloridu středně pokročilí 2, pravděpodobně jako hydrochloridová sůl. Tento středně pokročilí pak reaguje s aldehyd; the hydroxyl skupina 2 odebírá vodík z dusíku, zatímco osamělý pár dusíku napadá elektrofilní karbonyl uhlík na aldehyd Následující krok povede k SN2 útok následovaný ztrátou vody, čímž se získá chlor-oxazolin středně pokročilí 4. Další je tautomerizace prstenu proton. Poslední krok zahrnuje odstranění a ztráta HCl molekula za vzniku produktu 6, což je 2,5-diaryloxazol.[4]

Aplikace
Diarylazoly jsou běžné strukturální motivy jak v přírodních produktech, tak v kandidátech na léky, je však obtížné je syntetizovat. Diaryloxazoly se obecně připravují pomocí Fischerovy syntézy oxazolů nebo Robinson-Gabriel syntéza kde je oxazolový kruh konstruován buď syntézou.[5]
Fischerova syntéza oxazolu byla také užitečná při syntéze 2- (4-bromfenyl) 5-fenyloxazolu počínaje benzaldehydkyanhydrinem a 4-brombenzaldehydem. Oxazolový kruh chlorování dochází k získání 2,5-bis (4-bromfenyl) -4-chloroxazolu 7 spolu s 2,5-bis (4-bromfenyl) -4-oxazolidinonem 8. Druhá sloučenina je obecně a vedlejší produkt.[6]

Dalším užitečným příkladem je dvoustupňová syntéza halfordinolu, mateřské sloučeniny pro Rutaceae alkaloidy. Počáteční kroky následují po Fischerově syntéze oxazolu, ačkoli cyklizace katalyzovaná kyselinou probíhá spíše ve dvou krocích než v jednom, což zajišťuje tvorbu di-chloru středně pokročilí, zabraňující tvorbě regioizomer.[4]

V nedávném výzkumu[Citace je zapotřebí ] přehodnocení Fischerovy syntézy oxazolů vedlo k syntéze 2,5-disubstituovaných oxazolů z aldehydů a a-hydroxyamidů. Na rozdíl od syntézy Fischerových oxazolů se však nová metoda neomezuje pouze na diaryloxazoly.[7]
Reference
- ^ A b Wiley, R. H. The Chemistry of Oxazoles. Chem. Rev. 1945, 37, 401. (doi: 10.1021 / cr60118a002 )
- ^ Fischer, E. Ber. 1896, 29, 205.
- ^ Li, J. J. Fischerova syntéza oxazolu. In Name Reactions: Sbírka podrobných mechanismů a syntetických aplikací, 4. vydání .; Springer-Verlag Berlin Heidelberg: New York, 2003229-230. (Posouzení). ([1] )
- ^ A b C d Maklad, N. Název Reakce v heterocyklické chemii II; Li, J.J .; Wiley & Sons; Hoboken, NJ, 2011, 225-232. ([2] )
- ^ Strotman, N. A .; Chobanian, H. R .; On, J .; Guo, Y .; Dormer, P. G .; Jones, C. M .; Steves, J. E. katalyzátorem řízené regioselektivní spojky Suzuki v obou polohách dihaloimadozlů, dihalooxazolů a dihalothiazolů. J. Org. Chem. 2010, 75, 1733-1739. (doi:10.1021 / jo100148x )
- ^ Turchi, I. J. Oxazole Chemistry: A Review of Recent Advances. Ind. Eng. Che. Prod. Res. Dev. 1981, 20, 32-76. ([3] ) (Posouzení).
- ^ Cornforth, J.W .; Cornforth, R. H. 218. Mechanism and Extension of the Fischer Oxazole Synthesis. J. Am. Chem. Soc. 1949, 1028-1030. (doi:10.1039 / JR9490001028 )
