O-sukcinylbenzoát syntáza - O-succinylbenzoate synthase - Wikipedia
tento článek potřebuje víc odkazy na další články pomoci integrovat to do encyklopedie. (Září 2019) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| o-sukcinylbenzoát syntáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Zde je ilustrována konformace o-sukcinylbenzoát syntázy, když je navázána na Mg kation a její produkt, OSB. Azurově zbarvené R skupiny představují R skupiny, které interagují s Mg kationtem. Červeně a azurově zbarvené R skupiny představují R skupiny, které interagují s OSB. Jedna žlutě zbarvená skupina R představuje Lys 133, u kterého bylo prokázáno, že při dehydratační reakci působí jako katalytická báze i kyselina. | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.2.1.113 | ||||||||
| Číslo CAS | 97089-83-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Ó-Sukcinylbenzoát syntáza (OSBS) (EC 4.2.1.113)[1] je enzym kódováno genem menC v E-coli a katalyzuje dehydrataci 2-sukcinyl-6-hydroxy-2,4-cyklohexadien-l-karboxylátu (SHCHC) za vzniku 4- (2'-karboxyfenyl) -4-oxobutyrátu, také nazývaného Ó-sukcinylbenzoát nebo OSB, odtud název enzymu.[1][2][3][4][5] Tato reakce je čtvrtým krokem biosyntetické dráhy menachinonu, který bakterie používají k syntéze menachinonu, známého také jako vitamin K2.[6]
Klasifikace
OSBS patří do podskupiny mukonátového laktonizačního enzymu nadčeledi enolázy. The systematické jméno tohoto enzymu je (1R, 6R) -6-hydroxy-2-sukcinylcyklohexa-2,4-dien-1-karboxylát hydrolyáza (tvořící 2-sukcinylbenzoát).Mezi další běžné názvy patří: Ó-syntáza kyseliny sukcinylbenzoové a OSB syntáza.
Biosyntetická dráha menachinonu
The menachinon biosyntetická cesta se skládá z devíti enzymatických reakcí, které nakonec vedou k syntéze vitamin K.. Tato cesta je v obou případech docela podobná rostliny a bakterie konečný produkt dráhy se však u obou organismů mírně liší. Konečný produkt v rostlinách a některé sinice je fylochinon, který funguje jako transportér elektronů v fotosyntéza. Konečný produkt v bakteriích a archaea je menachinon, který je součástí anaerobní dýchání.[6] Struktury těchto dvou konečných produktů jsou uvedeny níže.

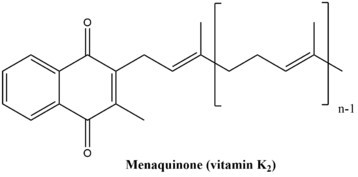
Phyllochinon se běžně nazývá „vitamin K.1„Menachinon se běžně nazývá„ vitamin K.2„Oba spadají pod běžný název„ vitamin K. “Tato cesta není přítomna u lidí a jiných zvířat, avšak vitamin K je nezbytný pro srážení krve a proto musí být konzumovány. Mezi dobré zdroje vitaminu K patří zelenina (kapusta, špenát, brokolice, Růžičková kapusta, květák atd.) a ryby, játra, maso a vejce (i když obsahují menší množství vitaminu K než zelenina).[7]
Struktura
OSBS je monomerní protein skládající se ze dvou domén: „capping domain“ a „barrel domain“, z nichž obě jsou charakteristické pro enoláza nadčeleď. Aktivní místo enzymu je umístěno na rozhraní dvou domén, přičemž se na hlavní doméně vyskytuje acidobazická chemie.[8] OSBS vyžaduje přítomnost Mg2+ fungovat. Mg2+ stabilizuje meziprodukt během reakce.[1]
Aktivita
Reakce katalyzovaná OSBS je uvedena níže:

Reakce zahrnuje dehydrataci SHCHC za vzniku OSB. OSBS má jeden substrát, SHCHC a dva produkty, vodu a OSB.
Homology v jiných organismech
Vazba OSB na aktivní místo OSBS sestává hlavně z nepřímých interakcí prostřednictvím molekul vody nebo hydrofobních interakcí. Tento nedostatek přísné specificity a katalýzy by mohl zjednodušit vývoj tvaru a objemu aktivního místa, což znamená, že OSBS by mohl sloužit jako výchozí bod pro vývoj nových enzymů s novými funkcemi v nadrodině enolázy. Tyto homology by mohly katalyzovat úplně odlišné reakce, ale protože udržují aktivní místo podobné jako u OSBS, substrát a meziprodukt nové reakce by byly strukturně podobné jako u OSBS.[3][4][5]
Jeden takový homolog již byl identifikován: OSBS z Amycolatopsis. OSBS z Amycolatopsis byl poprvé identifikován jako N-acylaminokyselinová racemáza (NAAAR), protože bylo zjištěno, že katalyzuje racemizaci N-acylaminokyselin. Tato schopnost však byla objevena z komerčních důvodů a vzhledem k tomu, že u racemizace N-acylaminokyselin nedochází Amycolatopsis, jeho skutečná práce v samotných bakteriích nebyla známa. V roce 1999 bylo zjištěno, že proteinová sekvence NAAAR byla docela podobná jiné bílkovině s neznámou funkcí Bacillus subtilis. Bylo zjištěno, že oba proteiny účinně katalyzují stejnou reakci jako OSBS E-coli, a tak to bylo považováno za jejich „správnou“ funkci. „NAAAR“ byl správně přejmenován na OSBS. Hypotéza uvedená v prvním odstavci této části pomáhá vysvětlit, jak z OSBS Amycolatopsis může také katalyzovat racemizaci N-acylaminokyselin, stejně jako rozmanitost katalytických rozdílů mezi enzymy nadčeledi enolázy.[3][4][5]
Reference
- ^ A b Klenchin VA, Taylor Ringia EA, Gerlt JA, Rayment I (prosinec 2003). „Vývoj enzymatické aktivity v nadrodině enolázy: strukturální a mutagenní studie mechanismu reakce katalyzované o-sukcinylbenzoát syntázou z Escherichia coli“. Biochemie. 42 (49): 14427–33. doi:10.1021 / bi035545v. PMID 14661953.
- ^ Sharma V, Meganathan R, Hudspeth ME (srpen 1993). „Biosyntéza menachinonu (vitaminu K2): klonování, nukleotidová sekvence a exprese genu menC z Escherichia coli“. Journal of Bacteriology. 175 (15): 4917–21. doi:10.1128 / jb.175.15.4917-4921.1993. PMC 204947. PMID 8335646.
- ^ A b C Thompson TB, Garrett JB, Taylor EA, Meganathan R, Gerlt JA, Rayment I (září 2000). „Vývoj enzymatické aktivity v nadrodině enolázy: struktura o-sukcinylbenzoát syntázy z Escherichia coli v komplexu s Mg2 + a o-sukcinylbenzoátem“. Biochemie. 39 (35): 10662–76. CiteSeerX 10.1.1.565.5855. doi:10.1021 / bi000855o. PMID 10978150.
- ^ A b C Palmer DR, Garrett JB, Sharma V, Meganathan R, Babbitt PC, Gerlt JA (duben 1999). „Neočekávaná divergence funkce a sekvence enzymu:„ Racemáza N-acylaminokyseliny “je o-sukcinylbenzoát syntáza.“ Biochemie. 38 (14): 4252–8. doi:10.1021 / bi990140p. PMID 10194342.
- ^ A b C Taylor Ringia EA, Garrett JB, Thoden JB, Holden HM, Rayment I, Gerlt JA (leden 2004). „Vývoj enzymatické aktivity v nadrodině enolázy: funkční studie promiskuitní o-sukcinylbenzoát syntázy z Amycolatopsis“. Biochemie. 43 (1): 224–9. doi:10.1021 / bi035815 +. PMID 14705949.
- ^ A b van Oostende C, Widhalm JR, Furt F, Ducluzeau AL, Basset GJ (2011). "Phyllochinon (vitamin K1): funkce, enzymy a geny". Pokroky v botanickém výzkumu.
- ^ "Vitamin K". Lékařské centrum University of Maryland. 2011-06-21.
- ^ „Zájmy z výzkumu“. Gerlt Lab - Molekulární a buněčná biologie - University of Illinois.
