N-Hydroxyftalimid - N-Hydroxyphthalimide - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC 2-Hydroxyisoindol-1,3-dion | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.007.600 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H5NÓ3 | |
| Molární hmotnost | 163.132 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
N-Hydroxyftalimid je N-hydroxyderivát ftalimid. Sloučenina se používá, mimo jiné, tak jako katalyzátor pro oxidační reakce, zejména pro selektivní oxidaci (např. alkany na alkoholy ) s molekulární kyslík za mírných podmínek.[1][2]
Výskyt a výroba
Syntéza N-hydroxyftalimid z ftaloylchlorid a hydroxylaminhydrochlorid v přítomnosti uhličitanu sodného ve vodném roztoku poprvé popsal Lassar Cohn v roce 1880 (dále jen „fthalylhydroxylamin“).[3]
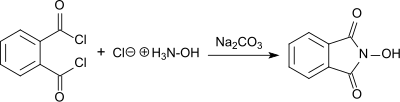
Produkt se tvoří jako červená sodná sůl za základních podmínek, zatímco bílá N-hydroxyftalimid se vysráží v 55% výtěžku jako roztok okyselený. N-hydroxyftalimid se také vyrábí reakcí hydrochloridu hydroxylaminu s diethylftalát v přítomnosti octan sodný,[4] nebo s anhydrid kyseliny ftalové v přítomnosti uhličitan sodný s topením. V posledním případě se po čištění pomocí. Získá celkový výtěžek 76% rekrystalizace.[5]
Mikrovlnné záření anhydridu kyseliny ftalové a hydrochloridu hydroxylaminu v pyridin vyrábí N-hydroxyftalimid v 81% výtěžku.[6] I při absenci báze reagují za vzniku anhydrid kyseliny ftalové a hydroxylaminfosfát N-hydroxyftalimid v 86% výtěžku při zahřátí na 130 ° C.[7]

Vlastnosti
N-Hydroxyftalimid je bezbarvý až žlutý krystalický prášek bez zápachu, který je rozpustný ve vodě a organických rozpouštědlech, jako je octová kyselina, ethylacetát a acetonitril.[8] Sloučenina existuje ve dvou různých barvách monoklinické krystalické formy. V případě bezbarvé bílé formy se N-OH skupina se otáčí asi 1,19 ° od roviny molekuly, zatímco ve žluté formě je mnohem blíže k rovinnosti (rotace 0,06 °).[9]
Barva syntetizovaného N-hydroxyftalimid závisí na typu použitého rozpouštědla; barevný přechod z bílé na žlutou je nevratný.[10] N-hydroxyftalimid tvoří silně zbarvené, většinou žluté nebo červené soli s alkálie a těžké kovy, amoniak a aminy.[11] Hydrolýza N-hydroxyftalimid přidáním silných bází produkuje mono kyselinu ftalovoukyselina hydroxamová podle přidání vody přes jednu z vazeb uhlík-dusík.[4] N-hydroxyftalimidethery jsou na druhou stranu bezbarvé a poskytují Ó-alkylhydroxylaminy alkalickou hydrolýzou nebo štěpením hydrazinhydrát.
"Fthalylhydroxylamin" hlášený Cohnem byl znám tím, že molekulární vzorec z C
8H
5NE
3 ale přesná struktura nebyla známa.[3] Diskutovány byly tři možnosti, které jsou znázorněny na obrázku níže: mono-oxim anhydridu kyseliny ftalové ("ftaloxim", Já), rozšířený kruh se dvěma heteroatomy, (2,3-benzoxazin-1,4-dion, II), a N-hydroxyftalimid (III).[10][12] Teprve v padesátých letech se ukázalo, že Cohnovým produktem je (III), N-hydroxyftalimid.[13]

Aplikace a reakce
Nefkens a Tesser vyvinuli techniku generování aktivní estery z N-hydroxyftalimid[14] pro použití v syntéza peptidů,[15] přístup později rozšířen na použití N-hydroxysukcinimid.[16] Esterová vazba je tvořena mezi N-hydroxyftalimid a a karboxylová kyselina podle odstranění vody, spojení dosaženo pomocí N,N '-dicyklohexylkarbodiimid (DCC). Pro syntézu peptidů, N- konec rostoucího peptidu je chráněný s tert-butyloxykarbonyl zatímco jeho C-konce (Z-NH-CH (R) -COOH) je spojen s N-hydroxyftalimid. An ester dalšího aminokyselina v požadované peptidové sekvenci se třepe s aktivovaným esterem, přidá se k řetězci a vytěsní se N-hydroxyftalimid. Tato reakce je kvantitativní a téměř okamžitá při 0 ° C.[15][17] Před opakováním cyklu je třeba hydrolyzovat výsledný ester.

The N-hydroxyftalimid lze odstranit třepáním s hydrogenuhličitan sodný,[15] ale N-hydroxysukcinimidový přístup vykazuje větší reaktivitu a pohodlí a je obecně výhodný.[16][17]
Estery z N-hydroxyftalimid a aktivován sulfonové kyseliny jako anhydrid kyseliny trifluormethansulfonové nebo p-toluensulfonylchlorid se používají jako takzvané fotokyseliny, které štěpí protony během UV záření.

Generované protony slouží k cílené lokální degradaci kyselinově citlivé fotorezisty.[18]
N-hydroxyftalimid lze převést vinylacetátem v přítomnosti octanu palladnatého na N-vinyloxyftalimid, který je kvantitativně hydrogenován na N-ethoxyftalimid a po vyčištění štěpením poskytnou Ó-ethylhydroxylamin.[19]

Řadu různých funkčních skupin lze oxidovat pomocí aminoxylový radikál (ftalimid-N-oxyl, PINO)[20] vzniklý odběrem atomu vodíku z N-hydroxyftalimid za mírných podmínek (podobně jako TEMPO ):[1]
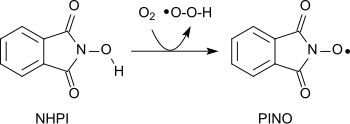
Pomocí molekulárního kyslíku mohou být alkany oxidovány za vzniku alkoholů, sekundární alkoholy na ketony, acetály na estery a alkeny na epoxidy.[21][22][23] Amidové lze převést na karbonylové sloučeniny s N-hydroxyftalimidové a kobaltnaté soli za mírných podmínek.[24]

Efektivní oxidační reakce prekurzorů důležitých základních chemikálií jsou zvláště technicky zajímavé. Například, ε-kaprolaktam lze připravit za použití NHPI z takzvaného KA oleje ("ketonalkoholový" olej, směs cyklohexanolu a cyklohexanonu), který se získá během oxidace cyklohexanu. Reakce probíhá přes cyklohexanolhydroperoxid, který reaguje s amoniakem za vzniku peroxydicyklohexylaminu s následným přesmykem v přítomnosti katalytického množství chloridu lithného.[22][25]

Použití N-hydroxyftalimid jako katalyzátor při oxidaci KA oleje zabraňuje tvorbě nežádoucího vedlejšího produktu síranu amonného, který se vyrábí běžnou syntézou ε-kaprolaktamu (Beckmann přesmyk cyklohexanonoximu s kyselina sírová ).
Alkany se v přítomnosti oxidu dusičitého převádějí na nitroalkany.[26]
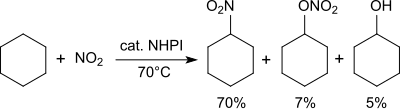
Cyklohexan se při 70 ° C směsí oxidu dusičitého a vzduchu převede na směs nitrocyklohexanu (70%), cyklohexylnitrátu (7%) a cyklohexanolu (5%).
Dále aplikace N-hydroxyftalimid jako oxidační činidla v fotografičtí vývojáři[27] a jako činidla regulující náboj v tonerech[28] byly popsány v patentové literatuře.
Ftalimido-N-oxyl (PINO)
Radikál odvozený odstraněním atomu H z N-hydroxyftalimid se nazývá N-ftalimido-N-oxyl, zkratka bytí PINO. Je to silné abstrahující činidlo na atomu H.[1] Energie disociace vazby NHPI (tj. PINO-H) je mezi 88-90 kcal / mol, v závislosti na rozpouštědle.[29]
Reference
- ^ A b C Recupero, Francesco; Punta, Carlo (2007). "Volná radikální funkcionalita organických sloučenin katalyzovaných N-Hydroxyftalimid ". Chem. Rev. 107 (9): 3800–3842. doi:10.1021 / cr040170k. PMID 17848093.
- ^ Melone, Lucio; Punta, Carlo (2013). „Aerobní oxidace bez kovů zprostředkovaná N-hydroxyftalimid. Stručná recenze “. Beilstein J. Org. Chem. 9: 1296–1310. doi:10,3762 / bjoc. 9.146. PMID 23843925.
- ^ A b Cohn, Lassar (1880). „Phthalylhydroxylamin: Ueberführung der Phthalsäure in Salicylsäure“ [N-hydroxyftalimid: přeměna kyseliny ftalové na kyselinu salicylovou]. Justus Liebigs Ann. Chem. (v němčině). 205 (3): 295–314. doi:10,1002 / jlac.18802050304.
- ^ A b Bauer, Ludwig; Miarka, Stanley V. (1957). "Chemie N-Hydroxyftalimid ". J. Am. Chem. Soc. 79 (8): 1983–1985. doi:10.1021 / ja01565a061.
- ^ Gross, H .; Keitel, I. (1969). „Zur Darstellung von N-Hydroxyftalimid und N-Hydroxysuccinimid "[O přípravě N-hydroxyftalimid a N-hydroxysukcinimid]. J. Prakt. Chem. (v němčině). 311 (4): 692–693. doi:10.1002 / prac.19693110424.
- ^ Sugamoto, Kazuhiro; Matsushita, Yoh-ichi; Kameda, Yu-hei; Suzuki, Masahiko; Matsui, Takanao (2005). „Mikrovlnná syntéza N-Hydroxyftalimidové deriváty “. Synth. Commun. 35 (1): 67–70. doi:10.1081 / SCC-200046498.
- ^ EP přihláška 1085013 „Elke Fritz-Langhals,“ Verfahren zur Herstellung cyclischer N-Hydroxy-dikarboximid (Způsob přípravy cyklického N-hydroxydicarboximides) ", publikováno 21. 3. 2001, přidělené Consortium für elektrochemische Industrie GmbH
- ^ Gambarotti, Cristian; Punta, Carlo; Recupero, Francesco; Zlotorzynska, Maria; Sammis, Glenn (2013). "N-Hydroxyftalimid". N-Hydroftalimid. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rn00598.pub2. ISBN 978-0471936237.
- ^ Reichelt, Hendrik; Faunce, Chester A .; Paradies, Henrich H. (2007). "Nepolapitelné formy a struktury N-hydroxyftalimid: Bezbarvé a žluté krystalické formy N-hydroxyftalimid ". J. Phys. Chem. A. 111 (13): 2587–2601. doi:10.1021 / jp068599y. PMID 17388355.
- ^ A b Ames, D. E.; Gray, T. F. (1955). "N-Hydroxyimidy. Část II. Deriváty kyseliny homoftalové a ftalové ". J. Chem. Soc.: 3518–3521. doi:10.1039 / JR9550003518.
- ^ Porcheddu, Andrea; Giacomelli, Giampaolo (2009). "Syntéza oximů a hydroxamových kyselin". V Rappaport, Zvi; Lieberman, Joel F. (eds.). Chemistry of Hydroxylamines, Oximes, and Hydroxamic Acids, Part 1. Chichester: Wiley. str. 224–226. ISBN 978-0-470-51261-6.
- ^ Bradly, Oscar L .; Baker, Leslie C .; Goldstein, Richard F .; Harris, Samuel (1928). "LXVIII. — Isomerismus oximů. Část XXXIII. Oximy kyseliny opianové a anhydridu kyseliny ftalové". J. Chem. Soc.: 529–539. doi:10.1039 / JR9280000529.
- ^ Hurd, Charles D .; Buess, Charles M .; Bauer, Ludwig (1954). „Succino- a ftalo-hydroxamové kyseliny“. J. Org. Chem. 19 (7): 1140–1149. doi:10.1021 / jo01372a021.
- ^ Nefkens, G. H. L .; Tesser, G. I .; Nivard, R. J. F. (1962). "Syntéza a reakce esterů N-hydroxyftalimid a N-chráněné aminokyseliny ". Recl. Trav. Chim. Pays-Bas. 81 (8): 683–690. doi:10,1002 / recl. 19620810807.
- ^ A b C Nefkens, G. H. L .; Tesser, G. I. (1961). "Nový aktivovaný ester v syntéze peptidů". J. Am. Chem. Soc. 83 (5): 1263. doi:10.1021 / ja01466a068.
- ^ A b Anderson, George W .; Zimmerman, Joan E .; Callahan, Francis M. (1964). "Použití esterů N-Hydroxysukcinimid v syntéze peptidů ". J. Am. Chem. Soc. 86 (9): 1839–1842. doi:10.1021 / ja01063a037.
- ^ A b Bodanszky, Miklos (1993). „Aktivace a propojení“. Principy syntézy peptidů (2. vyd.). Springer-Verlag. str. 9–61. doi:10.1007/978-3-642-78056-1_2. ISBN 9783642780561.
- ^ 0919867 Elian, E. Günther, R. Leuschner
- ^ 1995025090, D.M.C. Callant, A.M.C.F. Castelijns, J.G. De Vries
- ^ S. Coseri (2009), „Phthalimide-N-oxyl (PINO) Radical, silný katalyzátor: jeho tvorba a univerzálnost vůči různým organickým substrátům“, Catal. Rev. Sci. Eng., 51 (2), s. 218–292, doi:10.1080/01614940902743841
- ^ Y. Ishii, K. Nakayama, M. Takeno, S. Sakaguchi, T. Iwahama, Y. Nishiyama (1995), „Novel Catalysis N-Hydroxyftalimid při oxidaci organických substrátů molekulárním kyslíkem ", J. Org. Chem., 60 (13), s. 3934–3935, doi:10.1021 / jo00118a002CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b „Objev katalyzátoru produkujícího uhlíkové radikály a jeho aplikace na organickou syntézu“ (PDF). TCIMAIL, číslo 116. Tokyo Chemical Industry Co. Ltd. duben 2003. Citováno 2016-08-11.
- ^ B. B. Wentzel, M.P.J. Donners, P.L. Alsters, M.C. Feiters, R.J.M. Nolte (2000), "N-Hydroxyftalimid / kobalt (II) katalyzovaný nízkoteplotní benzylovou oxidací pomocí molekulárního kyslíku ", Čtyřstěn, 56 (39), s. 7797–7803, doi:10.1016 / S0040-4020 (00) 00679-7CS1 maint: více jmen: seznam autorů (odkaz)
- ^ F. Minisci, C. Punta, F. Recupero, F. Fontana, G.F. Pedulli (2002), „Aerobic Oxidation of N- Alkylamidy katalyzované N-Hydroxyftalimid za mírných podmínek. Polární a entalpické efekty ", J. Org. Chem., 67 (8), s. 2671–2676, doi:10.1021 / jo016398e, PMID 11950315CS1 maint: více jmen: seznam autorů (odkaz)
- ^ O. Fukuda, S. Sakaguchi, Y. Ishii (2001), „Nová strategie pro katalytickou Baeyer-Villigerovu oxidaci KA-oleje molekulárním kyslíkem za použití N-hydroxyftalimid ", Tetrahedron Lett., 42 (20), s. 3479–3481, doi:10.1016 / S0040-4039 (01) 00469-5CS1 maint: více jmen: seznam autorů (odkaz)
- ^ S. Sakaguchi, Y. Nishiwaki, T. Kitamura, Y. Ishii (2001), „Efektivní katalytická nitrace alkanu s NO2 pod vzduchem za pomoci N-hydroxyftalid ", Angew. Chem., Int. Upravit., 40 (1), s. 222–224, doi:10.1002 / 1521-3773 (20010105) 40: 1 <222 :: AID-ANIE222> 3.0.CO; 2-WCS1 maint: více jmen: seznam autorů (odkaz)
- ^ EP přihláška 0664479, W. Ishikawa & T. Sampei, „Metoda zpracování fotografického materiálu citlivého na halogenidy stříbra“, publikováno 26. 7. 1994, přidělené společnosti Konica Corp.
- ^ USA 5332637 J.C. Wilson; S.M. Bonser & H.W. Osterhoudt, „Elektrostatografický suchý toner a vývojové směsi s hydroxyftalimidem“, vydaný 26. 7. 1994, přidělený společnosti Eastman Kodak Co.
- ^ Coseri, Sergiu (2009). „Phthalimide-N-oxyl (PINO) Radical, silný katalyzátor: jeho tvorba a univerzálnost vůči různým organickým substrátům“. Recenze katalýzy. 51 (2): 218–292. doi:10.1080/01614940902743841.
