Diagnóza infarktu myokardu - Myocardial infarction diagnosis
| Diagnóza infarktu myokardu | |
|---|---|
| Účel | diagnostikovat infarkt myokardu pomocí fyzické prohlídky a EKG (plus krevní test) |
A diagnóza infarktu myokardu je vytvořen integrací historie současné nemoci a fyzikálního vyšetření s elektrokardiogram nálezy a srdeční markery (krevní testy pro srdeční sval buňka poškození).[1][2] A koronární angiogram umožňuje vizualizaci zúžení nebo překážek na srdečních cévách a terapeutická opatření mohou následovat okamžitě. V pitva, a patolog může diagnostikovat infarkt myokardu na základě anatomopatologické zjištění.
A rentgenový snímek hrudníku a rutinní krevní testy mohou naznačovat komplikace nebo vyvolávající příčiny a jsou často prováděny po příjezdu do pohotovostní oddělení. Nové regionální abnormality pohybu stěn na echokardiogram naznačují také infarkt myokardu. Echo může být provedeno v nejednoznačných případech pohotovostním kardiologem.[3] U stabilních pacientů, jejichž příznaky v době hodnocení ustoupily, Technecium (99mTc) sestamibi (tj. „MIBI sken“), chlorid thalium-201 nebo Rubidium-82 Chlorid lze použít v nukleární medicína vizualizovat oblasti se sníženým průtokem krve ve spojení s fyziologickým nebo farmakologickým stresem.[3][4] Thalium lze také použít ke stanovení životaschopnosti tkáně, přičemž se rozlišuje, zda je nefunkční myokard ve skutečnosti mrtvý, nebo pouze ve stavu hibernace nebo omráčení.[5]
Diagnostická kritéria
Podle kritérií WHO revidovaných v roce 2000[6] srdeční troponin nárůst doprovázený buď typickými příznaky, patologické Q vlny, elevace ST nebo deprese nebo koronární intervence jsou diagnostikou IM.
Předchozí kritéria WHO[7] formulovaný v roce 1979 kladl menší důraz na srdeční biomarkery; podle nich je pacientovi diagnostikován infarkt myokardu, pokud jsou splněna dvě (pravděpodobná) nebo tři (jednoznačná) z následujících kritérií:
- Klinická anamnéza bolesti na hrudi ischemického typu trvající déle než 20 minut
- Změny v sériovém sledování EKG
- Vzestup a pokles sérových srdečních biomarkerů, jako je kreatinkináza -MB zlomek a troponin
Vyšetření
Celkový vzhled pacientů se může lišit podle symptomů; pacient může být pohodlný nebo neklidný a ve vážné nouzi se zvýšeným rizikem dechová frekvence. Super a bledá kůže je běžné a ukazuje na vazokonstrikce. Někteří pacienti mají nízkou horečku (38–39 ° C). Krevní tlak může být zvýšena nebo snížena a puls může se stát nepravidelný.[8][9]
Pokud dojde k srdečnímu selhání, zvýšené krční žilní tlak a hepatojugulární reflux nebo otoky nohou způsobené periferními otok lze najít při kontrole. Zřídka lze pocítit srdeční bouli s tempem odlišným od pulzního rytmu prekordiální vyšetření. Různé abnormality lze nalézt na vyšetření poslechem, například třetí a čtvrtý zvuk srdce, systolické šelesty, paradoxní rozdělení druhého zvuku srdce, a perikardiální tření a rales přes plíce.[8][10]
Elektrokardiogram

Primárním účelem elektrokardiogram je zjistit ischemie nebo akutní koronární poranění v širokém rozsahu, symptomatické pohotovostní oddělení populace. Ke sledování rychlých změn v čase lze použít sériové EKG. Standardní 12svodové EKG přímo nezkoumá pravá komora, a je relativně špatná při zkoumání zadních bazálních a postranních stěn levá komora. Zejména akutní infarkt myokardu v distribuci arteriální arterie pravděpodobně způsobí nediagnostické EKG.[11] Použití dalších elektrod EKG, jako jsou pravostranné elektrody V3R a V4R a zadní elektrody V7, V8 a V9, mohou zlepšit citlivost na infarkt myokardu pravé a zadní komory.
12svodové EKG se používá ke klasifikaci pacientů do jedné ze tří skupin:[12]
- ti s Výška segmentu ST nebo nové blok větve svazku (podezřelý z akutního poranění a možný kandidát na akutní reperfuzní terapii s trombolytika nebo primární PCI ),
- pacienti s depresí segmentu ST nebo inverzí vlny T (podezřelí z ischemie) a
- pacienti s takzvaným nediagnostickým nebo normálním EKG.
Normální EKG nevylučuje akutní infarkt myokardu. Chyby v interpretaci jsou poměrně časté a neschopnost identifikovat vysoce rizikové prvky má negativní dopad na kvalitu péče o pacienta.[13]
Před provedením diagnostických vyšetření by mělo být stanoveno, zda je u osoby vysoké riziko infarktu myokardu.[14] Lidé, kteří mají normální EKG a kteří jsou například schopni cvičit, si nezaslouží rutinní zobrazování.[14] Zobrazovací testy, jako je stresový radionuklid zobrazení perfúze myokardu nebo stres echokardiografie může potvrdit diagnózu, když historie člověka, fyzikální vyšetření, EKG a srdeční biomarkery naznačují pravděpodobnost problému.[14]
Srdeční markery
Srdeční markery nebo srdeční enzymy jsou proteiny, které unikají z poškozených buněk myokardu přes poškozené buněčné membrány do krevního řečiště. Až do 80. let 20. století enzymy SGOT a LDH byly použity k hodnocení srdečního poškození. Nyní jsou markery nejčastěji používané při detekci MI MB podtyp enzymu kreatinkináza a srdeční troponiny T a já, protože jsou specifičtější pro poranění myokardu. Srdeční troponiny T a I, které se uvolňují během 4–6 hodin po infarktu infarktu myokardu a zůstávají zvýšené po dobu až 2 týdnů, mají téměř úplnou tkáňovou specificitu a jsou nyní preferovanými markery pro hodnocení poškození myokardu.[15]Protein vázající mastné kyseliny srdečního typu je další marker používaný v některých domácích testovacích soupravách. Zvýšené troponiny v oblasti bolesti na hrudi mohou přesně předpovědět vysokou pravděpodobnost infarktu myokardu v blízké budoucnosti.[16] Nové značky jako např glykogen fosforyláza izoenzym BB jsou předmětem vyšetřování.[17]
Diagnóza infarktu myokardu vyžaduje dvě ze tří složek (anamnéza, EKG a enzymy). Když dojde k poškození srdce, hladiny srdečních markerů v průběhu času stoupají, a proto krevní testy pro ně jsou převzaty po dobu 24 hodin. Protože tyto hladiny enzymů nejsou bezprostředně po infarktu zvýšeny, jsou pacienti s bolestmi na hrudi obecně léčeni za předpokladu, že došlo k infarktu myokardu, a poté jsou hodnoceni na přesnější diagnózu.[18]
Angiografie

V obtížných případech nebo v situacích, kdy je vhodný zásah k obnovení průtoku krve, koronární angiografie lze provést. A katétr je vložen do tepny (obvykle radiální nebo stehenní tepna[19]) a tlačil na cévy zásobující srdce. Katétrem se podá rentgenově neprůhledné barvivo a provede se řada rentgenových paprsků (fluoroskopie). Lze identifikovat ucpané nebo zúžené tepny a angioplastika aplikováno jako terapeutické opatření (viz níže). Angioplastika vyžaduje rozsáhlé dovednosti, zejména v případě nouze. Provádí ji lékař vyškolený v intervenční kardiologie.
Histopatologie
Histopatologické vyšetření srdce může odhalit infarkt při pitvě. Pod mikroskopem se infarkt myokardu prezentuje jako ohraničená oblast ischemické, koagulační nekróza (buněčná smrt). Při hrubém vyšetření není infarkt identifikovatelný během prvních 12 hodin.[20]
I když dřívější změny lze rozeznat pomocí elektronová mikroskopie, jedna z prvních změn pod běžným mikroskopem jsou tzv vlnitá vlákna.[21] Následně myocyt cytoplazma stává se více eosinofilní (růžová) a buňky ztrácejí své příčné pruhování s typickými změnami a nakonec ztrátou buněčné jádro.[22] Intersticium na okraji infarktové oblasti je zpočátku infiltrováno neutrofily, pak s lymfocyty a makrofágy, SZO fagocytóza („jíst“) zbytky myocytů. Nekrotická oblast je obklopena a postupně napadána granulační tkáň, který nahradí infarkt vláknitým (kolagenní ) jizva (což jsou typické kroky v hojení ran ). Intersticiální prostor (prostor mezi buňkami mimo krevní cévy) může být infiltrován červené krvinky.[20]
Tyto vlastnosti lze rozpoznat v případech, kdy nedošlo k obnovení perfúze; reperfúzované infarkty mohou mít i další znaky, například kontrakční pásová nekróza.[23]
Tyto tabulky poskytují přehled histopatologie pozorované u infarktu myokardu v čase po obstrukci.
Podle jednotlivých parametrů
| Histologické parametry myokardu (barvení HE)[24] | Nejčasnější projev[24] | Plný vývoj[24] | Snížení / zmizení[24] | obraz |
|---|---|---|---|---|
| Napnutá / zvlněná vlákna | 1–2 h |  | ||
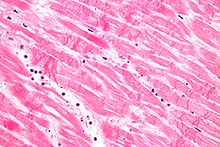
| Koagulační nekróza: cytoplazmatická hypereosinofilie | 1–3 h | 1–3 dny; cytoplazmatická hypereosinofilie a ztráta pruhování | > 3 dny: rozpad |  |
| Intersticiální edém | 4–12 h | 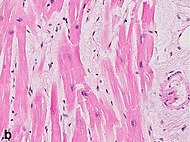 | ||
| Koagulační nekróza: „Jaderné změny“ | 12–24 (pyknóza, karyorrhexis) | 1–3 dny (ztráta jader) | Závisí na velikosti infarktu | |
| Neutrofil infiltrace | 12–24 h | 1–3 dny | 5–7 dní |  |
| Karyorrhexis neutrofilů | 1,5–2 dny | 3–5 dnů |  | |
| Makrofágy a lymfocyty | 3–5 dnů | 5–10 dní (včetně „siderofágů“) | 10 dní až 2 měsíce |  |
| Nádoby / endoteliální klíčky * | 5–10 dní | 10 dní – 4 týdny | 4 týdny: zmizení kapilár; některé velké rozšířené cévy přetrvávají | 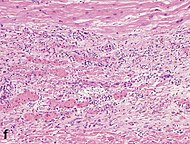 |
| Fibroblast a mladý kolagen * | 5–10 dní | 2–4 týdny | Po 4 týdnech; závisí na velikosti infarktu; |  |
| Hustá fibróza | 4 týdny | 2–3 měsíce | Ne | 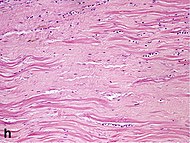 |
- Někteří autoři shrnují vaskulární a časné fibrotické změny jako „granulační tkáň“, která je maximální za 2–3 týdny
Diferenciální diagnózy fibrózy myokardu:
- Intersticiální fibróza, který je nespecifický a který byl popsán u městnavého srdečního selhání, hypertenze a normálního stárnutí.[25]
- Subepikardiální fibróza, který je spojen s neinfarktovými diagnózami, jako je myokarditida[26] a neischemická kardiomyopatie.[27]
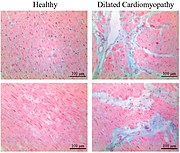
Zdravý myokard versus intersticiální fibróza u dilatační kardiomyopatie. Alcianská modrá skvrna.
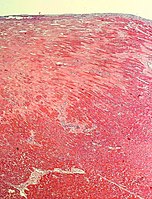
Subepikardiální fibróza (epikard nahoře)
Chronologický
| Čas | Hrubé vyšetření | Histopatologie podle světelná mikroskopie |
|---|---|---|
| 0 - 0,5 hodiny | Žádný[poznámka 1] | Žádný[poznámka 1] |
| 0,5 - 4 hodiny | Žádný[poznámka 2] |
|
| 4 - 12 hodin |
|
|
| 12 - 24 hodin |
|
|
| 1 - 3 dny |
|
|
| 3 - 7 dní |
|
|
| 7 - 10 dní |
|
|
| 10 - 14 dní |
|
|
| 2 - 8 týdnů |
|
|
| Více než 2 měsíce | Dokončené jizvy[Poznámka 3] | Vytvořila se hustá kolagenní jizva[Poznámka 3] |
| Pokud není v polích uvedeno jinak, pak je reference číslo [29] | ||
Viz také
Poznámky
- ^ A b Prvních ~ 30 minut není vidět žádná změna hrubé vyšetření nebo světelnou mikroskopií v histopatologie. Nicméně, v elektronová mikroskopie lze pozorovat uvolněné myofibrily, stejně jako ztrátu glykogenu a mitochondriální otok.
- ^ Často je však možné zvýraznit oblast nekrózy, která se poprvé projeví po 2 až 3 hodinách ponořením plátků tkáně do roztoku trifenyltetrazoliumchloridu. Toto barvivo dodává neporušenému neinfikovanému myokardu cihlově červenou barvu, kde je zachována aktivita dehydrogenázy. Protože dehydrogenázy jsou vyčerpány v oblasti ischemické nekrózy (tj. Unikají přes poškozené buněčné membrány), je infarktová oblast odhalena jako nezašpiněná bledá zóna. Místo trifenyltetrazoliumchloridového barviva lze k vizualizaci oblasti nekrózy použít také barvivo LDH (laktátdehydrogenáza).
- ^ A b Jakmile je jizva dokončena, dosud neexistuje běžná metoda rozlišování skutečného stáří infarktu, protože např. jizva stará čtyři měsíce vypadá stejně jako jizva stará deset let.
Reference
- ^ Mallinson, T (2010). "Infarkt myokardu". Zaměřte se na první pomoc (15): 15. Archivovány od originál dne 2010-05-21. Citováno 2010-06-08.
- ^ Infarkt myokardu: diagnostika a vyšetřování - GPnotebook, vyvoláno 27. listopadu 2006.
- ^ A b DE Fenton a kol. Infarkt myokardu - eMedicína, vyvoláno 27. listopadu 2006.
- ^ SKENOVÁNÍ SRDCE Archivováno 16. února 2009 v Wayback Machine - Informace o pacientovi od University College v Londýně. Citováno 27. listopadu 2006.
- ^ Skoufis E, McGhie AI (1998). „Radionuklidové techniky pro hodnocení životaschopnosti myokardu“. Tex Heart Inst J. 25 (4): 272–9. PMC 325572. PMID 9885104.
- ^ Alpert JS, Thygesen K, Antman E, Bassand JP (2000). „Nově definovaný infarkt myokardu - dokument konsensu Společného výboru pro evropskou kardiologickou společnost / American College of Cardiology Committee pro redefinici infarktu myokardu“. J Am Coll Cardiol. 36 (3): 959–69. doi:10.1016 / S0735-1097 (00) 00804-4. PMID 10987628.
- ^ Anonymous (březen 1979). „Nomenklatura a kritéria pro diagnostiku ischemické choroby srdeční. Zpráva pracovní skupiny Společné mezinárodní společnosti a kardiologické federace / Světové zdravotnické organizace o standardizaci klinické nomenklatury“. Oběh. 59 (3): 607–9. doi:10.1161 / 01.CIR.59.3.607. PMID 761341.
- ^ A b S. Garas et al.. Infarkt myokardu. eMedicína. Citováno 22. listopadu 2006.
- ^ Kasper DL, Braunwald E, Fauci AS, Hauser SL, Longo DL, Jameson JL. Harrisonovy principy interního lékařství. p. 1444. New York: McGraw-Hill, 2005. ISBN 0-07-139140-1.
- ^ Kasper DL, et al. Harrisonovy principy interního lékařství. p. 1450.
- ^ Cannon CP ve společnosti al. Správa akutních koronárních syndromů. p. 175. New Jersey: Humana Press, 1999. ISBN 0-89603-552-2.
- ^ Výbor Ecc, pracovní skupiny podvýborů American Heart Association (2005). „Pokyny American Heart Association 2005 pro kardiopulmonální resuscitaci a nouzovou kardiovaskulární péči - Část 8: Stabilizace pacienta akutními koronárními syndromy“. Oběh. 112 (24 doplňků): IV – 89 – IV – 110. doi:10.1161 / CIRCULATIONAHA.105.166561. PMID 16314375.
- ^ Masoudi FA, Magid DJ, Vinson DR a kol. (Říjen 2006). „Důsledky neschopnosti identifikovat vysoce rizikové nálezy na elektrokardiogramu pro kvalitu péče o pacienty s akutním infarktem myokardu: výsledky studie kvality urgentního infarktu myokardu (EDQMI)“. Oběh. 114 (15): 1565–71. doi:10.1161 / CIRCULATIONAHA.106.623652. PMID 17015790.
- ^ A b C Americká společnost pro jadernou kardiologii, „Pět věcí, které by lékaři a pacienti měli zpochybňovat“ (PDF), Moudře vybírat: iniciativa Nadace ABIM, Americká společnost pro jadernou kardiologii, archivovány z originál (PDF) 16. dubna 2012, vyvoláno 17. srpna 2012, který cituje
- Hendel, R. C .; Berman, D. S .; Di Carli, M. F .; Heidenreich, P. A .; Henkin, R.E .; Pellikka, P. A .; Pohost, G. M .; Williams, K. A .; Americká vysoká škola kardiologické nadace Pracovní skupina pro kritéria vhodného použití; Americká společnost pro jadernou kardiologii; American College Of, R .; American Heart, A .; Americká společnost pro echokardiologii; Společnost kardiovaskulární počítačové tomografie; Společnost pro kardiovaskulární magnetickou rezonanci; Society Of Nuclear, M. (2009). „ACCF / ASNC / ACR / AHA / ASE / SCCT / SCMR / SNM 2009 Vhodná kritéria použití pro zobrazování srdečních radionuklidů“. Journal of the American College of Cardiology. 53 (23): 2201–2229. doi:10.1016 / j.jacc.2009.02.013. PMID 19497454.
- Taylor, A. J .; Cerqueira, M .; Hodgson, J. M.; Mark, D .; Min, J .; O'Gara, P .; Rubin, G. D .; Americká vysoká škola kardiologické nadace Pracovní skupina pro kritéria vhodného použití; Společnost kardiovaskulární počítačové tomografie; American College Of, R .; American Heart, A .; Americká společnost pro echokardiografii; Americká společnost pro jadernou kardiologii; Severoamerická společnost pro kardiovaskulární zobrazování; Společnost pro kardiovaskulární angiografické intervence; Společnost pro kardiovaskulární magnetickou rezonanci; Kramer, C. M .; Berman; Hnědý; Chaudhry, F. A .; Cury, R. C .; Desai, M. Y .; Einstein, A. J .; Gomes, A. S .; Harrington, R .; Hoffmann, U .; Khare, R .; Menší; McGann; Rosenberg, A. (2010). „ACCF / SCCT / ACR / AHA / ASE / ASNC / NASCI / SCAI / SCMR 2010 Vhodná kritéria použití pro srdeční počítačovou tomografii“. Journal of the American College of Cardiology. 56 (22): 1864–1894. doi:10.1016 / j.jacc.2010.07.005. PMID 21087721.
- Anderson, J. L .; Adams, C. D .; Antman, E. M .; Bridges, C. R .; Califf, R. M .; Casey, D. E .; Chavey, W. E .; Fesmire, F. M .; Hochman, J. S .; Levin, T. N .; Lincoff, A. M .; Peterson, E. D .; Theroux, P .; Wenger, N. K.; Wright, R. S. (2007). „Pokyny ACC / AHA 2007 pro léčbu pacientů s nestabilní anginou pectoris / infarkt myokardu bez elevace ST: Shrnutí: Zpráva pracovní skupiny Americké kardiologické / Americké asociace srdečních asociací o praktických pokynech (Psací výbor k revizi z roku 2002 Pokyny pro léčbu pacientů s nestabilní anginou pectoris / infarktem myokardu bez elevace ST): Vyvinuto ve spolupráci s Americkou vysokou školou pohotovostních lékařů, Společností pro kardiovaskulární angiografii a intervence a Společností hrudních chirurgů: schváleno Americkou asociací kardiovaskulární a plicní rehabilitace a Společnost pro akademickou urgentní medicínu ". Oběh. 116 (7): 803. doi:10.1161 / CIRCULATIONAHA.107.185752.
- ^ Eisenman A (2006). „Troponinové testy pro diagnostiku infarktu myokardu a akutního koronárního syndromu: kde stojíme?“. Expert Rev Cardiovasc Ther. 4 (4): 509–14. doi:10.1586/14779072.4.4.509. PMID 16918269.
- ^ Aviles RJ, Askari AT, Lindahl B, Wallentin L, Jia G, Ohman EM, Mahaffey KW, Newby LK, Califf RM, Simoons ML, Topol EJ, Berger P, Lauer MS (2002). "Hladiny troponinu T u pacientů s akutními koronárními syndromy, s nebo bez renální dysfunkce". N Engl J Med. 346 (26): 2047–52. doi:10.1056 / NEJMoa013456. PMID 12087140.. Shrnutí pro laiky
- ^ Apple FS, Wu AH, Mair J a kol. (2005). „Budoucí biomarkery pro detekci ischemie a stratifikace rizika u akutního koronárního syndromu“. Clin. Chem. 51 (5): 810–24. doi:10.1373 / clinchem.2004.046292. PMID 15774573.
- ^ Braunwald E, Antman EM, Beasley JW, Califf RM, Cheitlin MD, Hochman JS, Jones RH, Kereiakes D, Kupersmith J, Levin TN, Pepine CJ, Schaeffer JW, Smith EE III, Steward DE, Théroux P (2002). „Aktualizace pokynů ACC / AHA 2002 pro léčbu pacientů s nestabilní anginou pectoris a infarktem myokardu bez elevace segmentu ST: zpráva pracovní skupiny American College of Cardiology / American Heart Association on Practice Guidelines (Výbor pro léčbu pacientů s Nestabilní angina pectoris) " (PDF). J Am Coll Cardiol. 40 (7): 1366–74. doi:10.1016 / s0735-1097 (02) 02336-7. PMID 12383588. Archivovány od originál (PDF) dne 26.03.2009.
- ^ Kolkailah (2018). „Přístup radiální arterie versus femorální arterie pro provádění procedur koronárního katétru u lidí s onemocněním koronárních tepen“. Cochrane Database Syst Rev.
- ^ A b Emanuel Rubin; Fred Gorstein; Raphael Rubin; Roland Schwarting; David Strayer (2001). Rubinova patologie - klinicko-patologické základy medicíny. Maryland: Lippincott Williams & Wilkins. p. 546. ISBN 978-0-7817-4733-2.
- ^ Eichbaum FW (1975). "'Zvlněná vlákna myokardu u spontánních a experimentálních adrenergních kardiopatií “. Kardiologie. 60 (6): 358–65. doi:10.1159/000169735. PMID 782705.
- ^ S Roy. Infarkt myokardu. Citováno 28. listopadu 2006.
- ^ Fishbein, M. C. (1990). "Reperfuzní poranění". Klinická kardiologie. 13 (3): 213–217. doi:10,1002 / clc.4960130312. PMID 2182247.
- ^ A b C d Není-li v rámečcích uvedeno jinak, je odkaz: Michaud, Katarzyna; Basso, Cristina; d’Amati, Giulia; Giordano, Carla; Kholová, Ivana; Preston, Stephen D .; Rizzo, Stefania; Sabatasso, Sara; Sheppard, Mary N .; Vink, Árijec; van der Wal, Allard C. (2019). „Diagnóza infarktu myokardu při pitvě: Přehodnocení AECVP ve světle současné klinické klasifikace“. Virchows Archiv. doi:10.1007 / s00428-019-02662-1. ISSN 0945-6317.
- „Tento článek je distribuován za podmínek mezinárodní licence Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/ Archivováno 2015-11-21 na Wayback Machine )"
- ^ Žlab, Michael; Aujla, Preetinder; Jana, Sayantan; Kassiri, Zamaneh (2019). „Nefibrilární strana fibrózy: příspěvek bazální membrány, proteoglykanů a glykoproteinů k fibróze myokardu“. Journal of Cardiovascular Development and Disease. 6 (4): 35. doi:10,3390 / jcdd6040035. ISSN 2308-3425.
- ^ Gräni, Christoph; Eichhorn, Christian; Bière, Loïc; Kaneko, Kyoichi; Murthy, Venkatesh L .; Agarwal, Vikram; Aghayev, Ayaz; Steigner, Michael; Blankstein, Ron; Jerosch-Herold, Michael; Kwong, Raymond Y. (2019). „Porovnání metod kvantifikace fibrózy myokardu pomocí kardiovaskulární magnetické rezonance pro stratifikaci rizika pacientů s podezřením na myokarditidu“. Journal of Cardiovascular Magnetic Resonance. 21 (1). doi:10.1186 / s12968-019-0520-0. ISSN 1532-429X.
- ^ Bhaskaran, Ashwin; Tung, Roderick; Stevenson, William G .; Kumar, Saurabh (2019). „Katetrizační ablace VT u neischemických kardiomyopatií: endokardiální, epikardiální a intramurální přístupy“. Srdce, plíce a oběh. 28 (1): 84–101. doi:10.1016 / j.hlc.2018.10.007. ISSN 1443-9506.
- ^ Bishop JE, Greenbaum R, Gibson DG, Yacoub M, Laurent GJ. Zvýšená depozice kolagenu převážně typu I u onemocnění myokardu. J Mol Cell Cardiol. 1990; 22: 1157–1165
- ^ Tabulka 11-2 v: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K .; Fausto, Nelson (1997). Robbinsova základní patologie. Philadelphia: Saunders. ISBN 1-4160-2973-7. 8. vydání.