Agonista receptoru melatoninu - Melatonin receptor agonist
| Agonista receptoru melatoninu | |
|---|---|
| Třída drog | |
 Melatonin, prototypový agonista receptoru melatoninu | |
| Identifikátory třídy | |
| Použití | Poruchy spánku, deprese, ADHD atd. |
| ATC kód | N05CH |
| Biologický cíl | Melatoninový receptor |
| Klinické údaje | |
| WebMD | RxList |
| externí odkazy | |
| Pletivo | D008550 |
| Na Wikidata | |
Agonisté receptoru melatoninu jsou analogy melatonin které se vážou a aktivují melatoninový receptor.[1] Agonisté receptoru melatoninu mají řadu terapeutických aplikací, včetně léčby poruch spánku a deprese. Objev a vývoj agonistů receptoru melatoninu byl motivován potřebou účinnějších analogů než melatonin, s lepším farmakokinetika a delší poločas rozpadu. Agonisté receptoru melatoninu byli vyvinuti se strukturou melatoninu jako modelem.[1]
Melatoninové receptory jsou Receptory spojené s G proteinem a jsou exprimovány v různých tkáních těla. U lidí existují dva podtypy receptoru, melatoninový receptor 1 (MT1) a melatoninový receptor 2 (MT2).[2] Melatonin a receptor melatoninu agonisté, na trhu nebo v klinické testy, všechny se váží na oba typy receptorů a aktivují je.[1] Vazba agonistů na receptory byla zkoumána od roku 1986, dosud však není plně objasněna.[1][3][4] Když se agonisté receptoru melatoninu váží na své receptory a aktivují je, dochází k mnoha fyziologickým procesům.[2][4][5]
Dějiny

V roce 1917 McCord a Allen objevili samotný melatonin.[6] V roce 1958 Aaron B. Lerner a jeho kolegové izolovali látku N-acetyl-5-methoxytryptamin a pojmenovali jej melatonin.[1][6] Vysoce afinitní vazebná místa pro melatonin byla farmakologicky charakterizována v hovězí mozek v roce 1979. První melatonergní receptor byl klonován melanofory z Xenopus laevis v roce 1994.[6] V letech 1994-1995 byly receptory melatoninu charakterizovány a klonovány do člověka Reppertem a kolegy.[7]
TIK-301 (PD-6735, LY-156 735 ) je ve fázi II klinického hodnocení ve Spojených státech (USA) od roku 2002.[1] FDA v květnu 2004 udělil označení léčivých přípravků pro vzácná onemocnění TIK-301 k použití jako léčba porucha spánku cirkadiánního rytmu u nevidomých jedinců bez vnímání světla a jedinců s tardivní dyskineze.[1] V roce 2005 Ramelteon (Rozerem) byl v USA schválen pro léčbu nespavost, charakterizovaná jako potíže se usínáním, u dospělých.[Citace je zapotřebí ] Melatonin ve formě prodlouženého uvolňování (obchodní název Circadin ) byl schválen v roce 2007 v Evropě (EU) k použití jako krátkodobá léčba u pacientů ve věku 55 let a starších k primární nespavosti (špatná kvalita spánku).[Citace je zapotřebí ] Produkty obsahující melatonin jsou ve Spojených státech k dispozici jako doplněk stravy[Citace je zapotřebí ] a Kanada. V roce 2009 agomelatin (Valdoxan, Melitor, Thymanax) byl také[je zapotřebí objasnění ] schválen v Evropě a je indikován k léčbě velká depresivní porucha u dospělých.[Citace je zapotřebí ] Tasimelteon dokončil v roce 2010 klinické hodnocení fáze III ve Spojených státech pro primární nespavost.[8] The Úřad pro kontrolu potravin a léčiv (FDA) udělil tasimelteon lék na vzácná onemocnění status označení pro nevidomé bez vnímání světlem s non-24-hodinová porucha spánku a bdění v lednu téhož roku,[Citace je zapotřebí ] a konečného souhlasu FDA se stejným účelem bylo dosaženo v lednu 2014 pod obchodním názvem Hetlioz.[9]
Melatoninové receptory

U lidí existují dva podtypy receptorů melatoninu, na které jsou zaměřeni agonisté melatoninu, MT1 a MT2. Jsou to receptory spojené s G proteinem a jsou exprimovány v různých tkáních těla společně nebo jednotlivě.[2] MT1 receptory jsou exprimovány v mnoha oblastech centrální nervový systém (CNS): suprachiasmatické jádro (SCN) hypotalamu, hipokampus, substantia nigra, mozeček, centrální dopaminergní dráhy, ventrální tegmentální oblast a nucleus accumbens.[2][5] MT1 je také vyjádřen v sítnice, vaječník, varle, prsní žláza, koronární oběh a aorta, žlučník, játra, ledviny, kůže a imunitní systém. MT2 receptory jsou exprimovány hlavně v CNS, také v plicích, srdeční, koronární a aortální tkáni, myometrium a granulózní buňky, imunitní buňky, duodenum a adipocyty.[2]
Mechanismus účinku
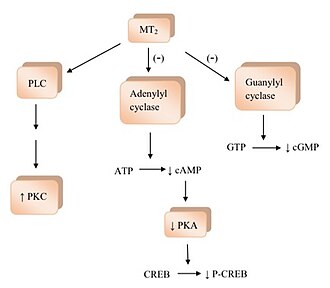
Vazba melatoninu na receptory melatoninu aktivuje několik signálních drah.[1] MT1 aktivace receptoru inhibuje adenylyl cykláza a jeho inhibice způsobí zvlněný efekt neaktivace; počínaje klesající tvorbou cyklický adenosinmonofosfát (cAMP) a poté postupuje k méně protein kináza A (PKA) aktivita, která zase brání fosforylaci proteinu vázajícího se na element reagující na cAMP (CREB vazebný protein ) do P-CREB.[4] MT1 receptory se také aktivují fosfolipáza C (PLC), ovlivňují iontové kanály a regulují tok iontů uvnitř buňky.[1][2][4] Vazba melatoninu na MT2 Receptory inhibují adenylylcyklázu, což snižuje tvorbu cAMP.[4] Také to brání guanylyl cykláza a tedy formování cyklický guanosinmonofosfát (cGMP). Vazba na MT2 receptory pravděpodobně ovlivňují PLC, což se zvyšuje protein kináza C. (PKC) aktivita. Aktivace receptoru může vést k iontovému toku uvnitř buňky.[1][4]
Když agonisté receptoru melatoninu aktivují své receptory, způsobí to řadu fyziologických procesů.[2][4][5] MT1 a MT2 receptory mohou být terčem léčby cirkadiánních a ne-cirkadiánních poruch spánku kvůli jejich rozdílům ve farmakologii a funkci v rámci SCN. SCN je zodpovědný za udržování 24hodinového cyklu, který reguluje mnoho různých tělesných funkcí od spánku po imunitní funkce.[10] Receptory melatoninu byly identifikovány v kardiovaskulárním systému. Důkazy ze studií na zvířatech poukazují na dvojí roli melatoninu ve vaskulatuře.[2] Aktivace MT1 receptory zprostředkovávají vazokonstrikci a aktivaci MT2 receptory zprostředkovávají vazodilataci. Melatonin se podílí na regulaci imunitních odpovědí u lidí i zvířat aktivací MT1 a MT2 receptory.[2][4] MT1 a MT2 receptory jsou v oku rozšířené a podílejí se na regulaci sekrece komorové tekutiny, což je důležité pro glaukom a v fototransdukce. Toto není úplný seznam, protože mnoho možných procesů vyžaduje další potvrzení.[2]
Návrh a vývoj léků
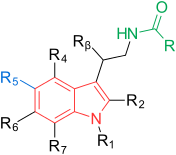
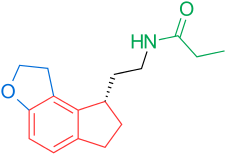
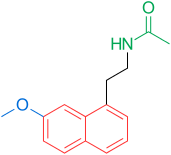
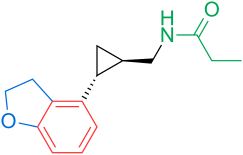
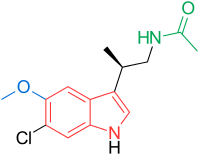
Receptory a struktura melatoninu jsou známé. Výzkumníci proto začali zkoumat modulace základní struktury, aby vyvinuli lepší agonisty než melatonin; účinnější, s lepší farmakokinetikou a delším poločasem. TIK-301 (obrázek 1) je agonista raných tříd. Je velmi podobný melatoninu a dostal se do klinických studií.[1] To vedlo k dalšímu výzkumu molekuly, hlavně substituci aromatického kruhu. Různé modulace vykazovaly slibnou aktivitu, zejména naftalen kroužek, který je přítomen v agomelatinu (obrázek 1).[1][6] Jiné kruhové systémy také prokázaly aktivitu agonisty melatoninu. Mezi nimi jsou indane který je přítomen v ramelteonu (obrázek 1) a kruhovém systému tasimelteonu (obrázek 1).[1][3]
Vztah struktura-aktivita
Obecná struktura melatoninu je indol zazvonit s methoxy skupina v poloze 5 (5-methoxy skupina) a acylaminoethyl postranní řetězec v poloze 3.[1] Oba postranní řetězce jsou důležité pro vazbu na receptory a pro jejich aktivaci.[3] Indolový kruh byl hodnocen na všech pozicích účinkem substitucí, jak je vidět na obrázku 1.[1] Každá pozice je dále vysvětlena níže:[1]
| Pozice | Zkratka | Akce |
|---|---|---|
| 1 | R1 | Možné nahradit malými skupinami, jako je methyl, bez malých změn vazebné afinity. Objemné skupiny snižují vazebnou afinitu a vnitřní aktivita. |
| 2 | R2 | Přidání jodu, bromu a fenyl funkční skupiny vést k agonistům s přibližně desetinásobnou vyšší vazebnou afinitou. |
| 3 | R3 | Acylaminoethyl vedlejší řetězec je důležitý, jak bylo uvedeno výše. V této poloze je možné řídit agonistickou a antagonistickou aktivitu. |
| 4 | R4 | Často se podílí na uzavření kruhu u agonistů melatoninu, ačkoli tato poloha byla špatně prozkoumána. |
| 5 | R5 | Jak již bylo zmíněno, je důležitá methoxyskupina. Substituce halogeny, jako je chlor (Cl) a brom (Br), prokázala nižší vazebnou afinitu. Přesunutí methoxyskupiny do jiných poloh na indolovém kruhu, např. 4, 6 nebo 7 vede k nižší vazebné afinitě. |
| 6 | R6 | Substituce vede k nižší vazebné afinitě, ale tato poloha je důležitá pro farmakokinetiku. Hlavním metabolitem in vivo je 6-hydroxymelatonin. |
| 7 | R7 | Zavedení skupin v této poloze obecně vede k nižší vazebné afinitě. |
| β | Rβ | Lze nahradit malými skupinami, jako je methyl, bez malých změn vazebné afinity. Hromadnější skupiny mají nižší vazebnou afinitu. |
Vazba a farmakofor
2-Iodomelatonin byl syntetizován v roce 1986 a jeho radioligand, 2- [125I] -melatonin, byl užitečný při hledání buněčných cílů melatoninu. I když receptor melatoninu nebyl v lidské bytosti charakterizován a klonován až do roku 1994, bylo možné do té doby začít provádět vazebné studie v různých tkáních.[1] Jak bylo uvedeno výše v kapitole o vztahu struktura-aktivita, pro činnost jsou důležité určité skupiny. Nejdůležitějšími skupinami jsou 5-methoxyskupina a acylaminoethylový postranní řetězec, protože se vážou na receptory a aktivují je.[3][4] Skupina –NH indolového kruhu není důležitá pro vazbu a aktivaci. Proto je možné jej nahradit jinými aromatickými kruhovými systémy. Aromatický kruh a ethylový postranní řetězec drží správnou vzdálenost mezi těmito dvěma skupinami. Správná vzdálenost je klíčem k dobré vazbě a důležitější než jaký typ aromatického kruhového systému analog obsahuje. Proto je možné použít různé kruhové systémy v analogech receptoru melatoninu, pokud je správná vzdálenost.[1][3][4]
Receptory melatoninu se skládají z proteinů, z nichž každý má přibližně 40 kDa. MT1 receptor kóduje 350 aminokyselin a MT2 kóduje 362 aminokyselin. Vazba melatoninu a jeho analogů na receptory není zcela známa. Vazebný prostor pro melatonin a analogy na MT1 receptor je menší než na MT2.[4] Vyšetřování se obvykle zaměřuje na dvě vázací kapsy pro dva postranní řetězce. Vazebná kapsa 5-methoxyskupiny je zkoumána více než druhá kapsa.[4][5] Vědci se shodují, že kyslík ve skupině se váže na histidin (His) zbytky v transmembránové doméně 5 (TM5) receptoru s vodíkovou vazbou; His195 v MT1 a His208 v MT2.[3][4] Další aminokyselina, valin 192 (Val), se také podílí na vazbě 5-methoxyskupiny vazbou na methylovou část skupiny.[4]
Vazba N-acetylové skupiny je složitější a méně známá. Důležité aminokyseliny ve vazebné kapse pro tuto skupinu se mezi dvěma receptory liší. Seriny Ser110 a Ser114 v doméně TM3 se zdají být důležité pro vazbu k MT1 receptor. Nicméně, asparagin 175 (Asn) v doméně TM4 bude pravděpodobně pro MT důležitý2 receptor.[4] Aromatický kruhový systém v melatoninu a analogech s největší pravděpodobností přispívá k určité vazebné afinitě vazbou na aromatické kruhy aminokyselin fenylalanin (Phe) a tryptofan (Trp) v receptoru. Vazby, které se tvoří, jsou van der Waalsovy interakce.[3] N-acetylová vazebná a vazebná kapsa, vazba kruhového systému a důležité domény jsou poněkud známé a vyžadují další zkoumání.[1][3][4]
Karbamátové insekticidy cílit na lidské receptory melatoninu.[11]
Aktuální stav
Dnes (únor 2014) jsou na trhu tři agonisté melatoninu; Ramelteon (Rozerem), agomelatin (Valdoxan, Melitor, Thymanax) a tasimelteon (Hetlioz). Ramelteon vyvinul Farmaceutická společnost Takeda a schválen ve Spojených státech v roce 2005. Agomelatin byl vyvinut farmaceutickou společností Sluha a schválen v Evropě 2009. Tasimelteon byl vyvinut společností Vanda Pharmaceuticals a dokončil studii fáze III v roce 2010. Byl schválen FDA 31. ledna 2014 pro léčbu non-24-hodinová porucha spánku a bdění u úplně slepých jedinců.[9]
Jeden agonista melatoninu získal označení pro léčivé přípravky pro vzácná onemocnění a prochází klinickými testy ve Spojených státech: TIK-301. Původně TIK-301 byl vyvinut společností Eli Lilly and Company a nazvaný LY-156 735, až v červenci 2007 převzala vývoj společnost Tikvah Pharmaceuticals a nazvala ji TIK-301. Nyní je ve fázi II a je od roku 2002.[1][12] V červenci 2010 byl v Evropě schválen melatonin s prodlouženým uvolňováním (Circadin, Neurim Pharmaceuticals) pro použití po dobu 13 týdnů u pacientů s nespavostí starších 55 let.[13] Společnost Neurim Pharmaceuticals dále oznámila výsledky pozitivní studie fáze II s hodnocenou sloučeninou piromelatinem (Neu-P11) v únoru 2013.[14]
| Circadin | Ramelteon | Agomelatin | Tasimelteon | TIK-301 | |
|---|---|---|---|---|---|
| Vazebná afinita | — | MT1: Ki = 0,014 nM MT2: Ki = 0,045 nM | MT1: Ki = 0,062 nM MT2: Ki = 0,268 nM 5-HT2C: IC50 = 270 nM * | MT1: Ki = 0,35 nM MT2: Ki = 0,17 nM | MT1: Ki = 0,081 nM MT2: Ki = 0,042 nM |
| Biologická dostupnost | 15% | < 2% | < 5% | u lidí neurčeno | — |
| Poločas rozpadu | 40–50 min 3,5–4 h (terminál) | 1–2 h | 1–2 h | 0,9–1,7 h 0,8–5,9 h (terminál) | — |
| Vazba na bílkoviny | 60% | 82% | 95% | 89–90% | — |
| Objem distribuce | — | 73,6 l | 35 l | 56–126 l | — |
| Společnost | Neurim Pharmaceuticals | Farmaceutická společnost Takeda | Sluha | Vanda Pharmaceuticals | Tikvah Pharmaceuticals |
| * Antagonista serotoninu. | |||||
Viz také
- TIK-301 (LY-156 735, PD-6735)
Reference
- ^ A b C d E F G h i j k l m n Ó p q r s t u Rivara, S., Mor, M., Bedini, A., Spadoni, G., Tarzia, G. (2008). „Agonisté melatoninového receptoru: SAR a aplikace při léčbě poruch spánku a bdění“. Aktuální témata v medicinální chemii. 8 (11): 954–68. doi:10.2174/156802608784936719. PMID 18673165.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E F G h i j Pandi-Perumal, S. R., Trakht, I., Srinivasan, V., Spence, D. W., Maestroni, G. J. M., Zisapel, N., Cardinali, D. P. (2008). "Fyziologické účinky melatoninu: role melatoninových receptorů a signálních transdukčních drah". Pokrok v neurobiologii. 85 (3): 335–53. doi:10.1016 / j.pneurobio.2008.04.001. PMID 18571301.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E F G h Sugden, D., Davidson, K., Hough, K. A., Teh, M. T. (2004). „Melatonin, receptory melatoninu a melanofory: dojemný příběh“. Výzkum pigmentových buněk. 17 (5): 454–60. doi:10.1111 / j.1600-0749.2004.00185.x. PMID 15357831.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E F G h i j k l m n Ó p Dubocovich, M. L., Delagrange, P., Krause, D. N., Sugden, D., Cardinali, D. P., Olcese, J. (2010). „International Union of Basic and Clinical Pharmacology. LXXV. Nomenklatura, Classification, and Pharmacology of G Protein-Coupled Melatonin Receptors“. Farmakologické recenze. 62 (3): 343–80. doi:10.1124 / pr.110.002832. PMC 2964901. PMID 20605968.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d Witt-Enderby, P. A., Bennett, J., Jarzynka, M. J., Firestine, S., Melan, M. A. (2003). "Melatoninové receptory a jejich regulace: biochemický a strukturální mechanismus". Humanitní vědy. 72 (20): 2183–98. doi:10.1016 / S0024-3205 (03) 00098-5. PMID 12628439.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d de Bodinat, C., Guardiola-Lemaitre, B., Mocaër, E., Renard, P., Muñoz, C., Millan, M. J. (2010). „Agomelatin, první melatonergní antidepresivum: objev, charakterizace a vývoj“. Recenze přírody Objev drog. 9 (8): 628–42. doi:10.1038 / nrd3140. PMID 20577266.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Ferguson, S.A., Rajaratnam, S. M. W., Dawson, D. (2010). „Agonisté melatoninu a nespavost“. Odborná recenze Neurotherapeutics. 10 (2): 305–38. doi:10.1586 / ern.10.1. PMID 20136385.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Rajaratnam, S. M. W., Cohen, D. A., Rogers, N. L. (2009). "Melatonin a analogy melatoninu". Kliniky spánkové medicíny. 4 (2): 179–93. doi:10.1016 / j.jsmc.2009.02.007.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b „FDA schvaluje Hetlioz: první léčba poruchy spánku a bdění u non-24 hodin u slepých jedinců“ (Tisková zpráva). FDA. 31. ledna 2014. Archivovány od originál 2. února 2014.
- ^ Dubocovich, M. L. (2007). "Melatoninové receptory: role ve spánku a regulace cirkadiánního rytmu". Sleep Medicine. 8: 34–42. doi:10.1016 / j. Spánek.2007.10.007. PMID 18032103.
- ^ Popovska-Gorevski, Marina; Dubocovich, Margarita L .; Rajnarayanan, Rajendram V. (20. února 2017). „Karbamátové insekticidy se zaměřují na lidské receptory melatoninu“. Chemický výzkum v toxikologii. 30 (2): 574–582. doi:10.1021 / acs.chemrestox.6b00301. PMC 5318275. PMID 28027439.
- ^ „Budoucí léčba deprese, úzkosti, poruch spánku, psychóz a ADHD“. Neurotransmitter.net. 17. 06. 2011. Citováno 2012-02-10.[nespolehlivý zdroj? ]
- ^ „Circadin schválen v EU pro léčbu primární nespavosti u pacientů ve věku 55 let a starších po dobu až 3 měsíců“ (Tisková zpráva). Neurim Pharmaceuticals. 5. července 2010. Citováno 19. února 2020.
- ^ „Neurim Pharmaceuticals oznamuje pozitivní klinické studie fáze 2 s výsledky piromelatinu pro léčbu nespavosti“ (Tisková zpráva). Neurim Pharmaceuticals. 18. února 2013. Citováno 19. února 2020.
- ^ „Nejdůležitější informace o předepisování informací pro Hetlioz“ (PDF).
- ^ „Informační materiály ke schůzkám poradního výboru Tasimelteon“ (PDF). Vanda Pharmaceuticals. Listopad 2013. Archivovány od originál (PDF) dne 25. listopadu 2013.