Lysin 2,3-aminomutáza - Lysine 2,3-aminomutase - Wikipedia
| Lysin 2,3-aminomutáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 5.4.3.2 | ||||||||
| Číslo CAS | 9075-20-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Lysin 2,3-aminomutáza (KAM nebo LAM) (ES 5.4.3.2 ) je radikální SAM enzym který usnadňuje přeměnu aminokyselina lysin na beta-lysin.[1][2][3][4] Dosahuje této vzájemné přeměny pomocí tří kofaktory a 5'-deoxyadenosyl radikál vytvořený v a S-adenosyl methionin (SAM) aktivovaná radikální reakční cesta.[1] Zobecněná reakce je uvedena níže:

Struktura
Vpravo je zobrazena trojrozměrná struktura proteinu lysin 2,3-aminomutázy. Struktura byla určena Rentgenová krystalografie na 2,1 Angstrom rozlišení a bylo vidět, že krystalizuje jako homotetramer.[2] KAM byl nejprve purifikován a charakterizován v Clostridium subterminale pro studium metabolismu lysinu.
Kofaktory
Pro reakci katalyzovanou lysin 2,3-aminomutázovým enzymem jsou zapotřebí čtyři klíčové kofaktory. Oni jsou:
- S-adenosyl methionin (SAM): Pomáhá generovat radikální meziprodukt vypůjčením elektronu.[5]
- Pyridoxal fosfát (PLP): Odpovědný za vazbu aminokyseliny během reakce. Pi-systém této molekuly usnadňuje radikálovou delokalizaci během tvorby aziridinylového radikálu. Struktura je uvedena níže:
- Zinek kov: Vyžadováno pro koordinaci mezi dimery v proteinu.
- Cluster železo-síra: K vytvoření 5'-deoxyadenosylového radikálu je zapotřebí klastr 4 železo-4 síra. Tento radikál pak působí jako „stabilní“ nosič radikálu v reakčním mechanismu, který přenáší radikál na aminokyselinu.
Mechanismus reakce
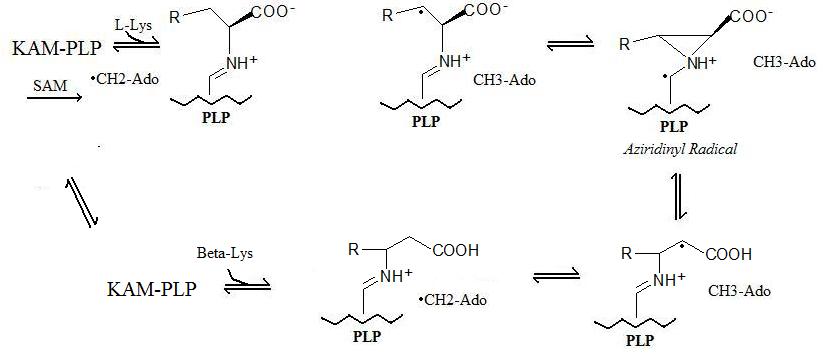
Zobecněná reakce probíhá v 5 krocích:
- Radikální formace: „Stabilní“ radikál se vytváří prostřednictvím a radikální SAM mechanismus, ve kterém S-adenosylmethionin tvoří 5'-deoxyadenosylový radikál.
- Vazba enzymů: Lysin 2,3-aminomutáza se váže na pyridoxal fosfát (PLP).
- Vazba aminokyselin: Aminokyselina (lysin nebo beta-lysin v závislosti na dopředných nebo reverzních reakcích) se váže na pyridoxal fosfát.
- Radikální přenos: 5'-deoxyadenosylový radikál se přenese na aminokyselinu a vytvoří se aziridinylový radikál. V této konfiguraci je radikál stabilizován pi-systémem pyridoxal fosfátu.
- Konverze aminokyselin: V posledním kroku se vytvoří nová aminokyselina a radikál se vrátí do stabilnějšího stavu na 5'-deoxyadenosylu.
Reakční mechanismus popsaný výše je uveden níže:
Reference
- ^ Frey PA (květen 1993). „Lysin 2,3-aminomutáza: je adenosylmethionin chudým adenosylkobalaminem?“. FASEB Journal. 7 (8): 662–70. doi:10.1096 / fasebj.7.8.8500691. PMID 8500691. S2CID 33374466.
- ^ Lepore BW, Růžička FJ, Frey PA, Ringe D (září 2005). „Rentgenová krystalová struktura lysin-2,3-aminomutázy z Clostridium subterminale“. Sborník Národní akademie věd Spojených států amerických. 102 (39): 13819–24. Bibcode:2005PNAS..10213819L. doi:10.1073 / pnas.0505726102. PMC 1236562. PMID 16166264.
- ^ Aberhart DJ, Gould SJ, Lin HJ, Thiruvengadam TK, Weiller BH (1981). "Stereochemie lysin 2,3-aminomutázy". J. Am. Chem. Soc. 103 (22): 6750–6752. doi:10.1021 / ja00412a040.
- ^ Zappia V, Barker HA (červen 1970). "Studie na lysin-2,3-aminomutáze. Struktura podjednotky a sulfhydrylové skupiny". Biochimica et Biophysica Acta. 207 (3): 505–13. doi:10.1016 / s0005-2795 (70) 80013-7. PMID 5452674.
- ^ Bhandari DM, Fedoseyenko D, Begley TP (2018). "Mechanistické studie na radikální enzym SAM tryptofan lyáza (NosL)". Radikální enzymy SAM. Metody v enzymologii. 606. 155–178. doi:10.1016 / bs.mie.2018.06.008. ISBN 9780128127940. PMID 30097091.
externí odkazy
- Lysin + 2,3-aminomutáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)

