L-ribulóza-5-fosfát 4-epimeráza - L-ribulose-5-phosphate 4-epimerase
| L-ribulosa-fosfát-4-epimeráza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| EC číslo | 5.1.3.4 | ||||||||
| Číslo CAS | 9024-19-5 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a L-ribulosa-5-fosfát 4-epimeráza (ES 5.1.3.4 ) je enzym že katalyzuje interkonverze ribulosa 5-fosfát a xylulóza 5-fosfát v oxidační fázi Cesta fosfátu pentózy.[1]
- L-ribulosa 5-fosfát D-xylulóza-5-fosfát
Tento enzym má molekulovou hmotnost 102 kDa a předpokládá se, že je složen ze čtyř identických 25,5 kDa podjednotek. Patří do rodiny izomerázy, konkrétně ty racemázy a epimerázy jednající na sacharidy a deriváty.[2] The systematické jméno této třídy enzymů je L-ribulosa-5-fosfát 4-epimeráza. Mezi další běžně používaná jména patří fosforibulóza izomeráza, ribulóza fosfát 4-epimeráza, L-ribulosa-fosfát-4-epimeráza, L-ribulosa 5-fosfát 4-epimeráza, AraD, a L-Ru5P. Tento enzym se účastní interverze pentózy a glukuronátu a metabolismus askorbátu a aldarátu.
Enzymový mechanismus
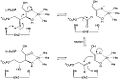
Mechanismus účinku ribulózy 5-fosfát 4-epimerázy v aktivním místě
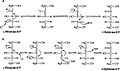
Aldol a dehydratační mechanismy
L-Ribulóza-5-fosfát-4-epimeráza katalyzuje epimerizaci L-ribulosa 5-fosfát na D-xylulóza 5-fosfát štěpením retro-aldolem a následným aldolová reakce. Navrhovaný mechanismus zahrnuje abstrakci proton z hydroxyl skupina na C-4, následovaná odštěpením vazby mezi C-3 a C-4 za vzniku aceton-enediolátu stabilizovaného kovem a glykolaldehyd fosfátový fragment. Vazba C-C glykolaldehydfosfátu se poté otočí o 180 ° a vazba C-C mezi C-3 a C-4 se regeneruje, aby poskytla inverzi stereochemie na C-4.[3]
Tento mechanismus je zpochybněn možnou alternativou dehydratace reakční schéma. Literatura[2][3] upřednostňuje aldolový mechanismus ze dvou důvodů. Za prvé, mechanismus štěpení retroaldolem je analogický s reakcí katalyzovanou L-fukulosa-fosfát aldoláza který má vysokou úroveň podobnosti sekvence s L-ribulosa-5-fosfát 4-epimeráza. Zadruhé, analýza 13C a deuterium kinetické izotopové účinky směřuje k aldolovému mechanismu. Bylo hlášeno, že v deuteriu je malý až žádný rozdíl izotop účinky na C-3 a C-4, což naznačuje, že tyto vazby C – H se během epimerizace neporuší.[3] U mechanismu dehydratace lze očekávat změny izotopového účinku na C-3, protože rozbití vazby C – H je krok omezující rychlost v tomto mechanismu a nahrazení C-3 vodík s deuteriem by významně změnilo rychlost. Zároveň jsou výrazně velké 13Účinky izotopu C, což naznačuje, že zlomení vazby C – C omezuje rychlost, jak se u aldolového mechanismu očekávalo.[3]
Struktura

Homotetramerická struktura L-Ru5P
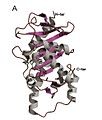
Monomer L-Ru5P

Aktivní web L-Ru5p
Struktura je homotetramerní a zobrazuje symetrii C4.[4] Každý proteinová podjednotka má jednu doménu skládající se z centrální β list lemované na obou stranách vrstvami α-šroubovice. Centrální β-list je vytvořen z devíti β-řetězců (bl-b9) a je převážně antiparalelní s výjimkou mezi vlákny b7 a b8. Osm α-šroubovic struktury tvoří dvě vrstvy na obou stranách centrálního β-listu. Aktivní místo je identifikováno polohou katalyzátoru zinek zbytek a je umístěn na rozhraní mezi dvěma sousedními podjednotkami. Asp76, His95, His97 a His171 působí jako zbytky vázající kov. Pozoruhodným rysem struktury je, že se velmi podobá struktuře L-fukulosa-fosfát aldoláza.[2] To je v souladu s představou, že oba enzymy patří do nadrodiny epimerázy /aldolasy které katalyzují štěpné reakce vazby uhlík-uhlík stabilizované kovem izolovat středně pokročilí.
Biologická funkce
Ribulóza-5-fosfát-4-epimeráza se nachází na dobře studovaných Operon L-arabinózy. Tento operon se skládá z osmi genů araA-araH s genem pro Ribulóza 5-fosfát 4-epimerázu nazývaným araD. Systém arabinózy umožňuje příjem pentóza L-arabinóza a poté přeměna intracelulární arabinóza ve třech krocích katalyzovaných produkty genů araB, araA, araD na D-xyulóza-5-fosfát.[5]
| Gen | Protein |
|---|---|
| AraA | Izomeráza |
| Arab | Ribulokináza |
| AraC | Regulační |
| AraD | Epimeráza |
| AraE | Příjem |
| AraF | Příjem |
| AraG | Příjem |
| AraH | Příjem |
Vývoj
L-Ribulóza-5-fosfát 4-epimeráza a Lalfulasa -fukulosa-1-fosfát (L-Fuc1P) jsou evolučně příbuzné enzymy, které vykazují 26% sekvenční identitu a velmi vysoký stupeň strukturní podobnosti.[2] Oba zaměstnávají divalenta kation při stabilizaci izolovat během katalýzy, a oba jsou schopni deprotonovat C-4 hydroxylovou skupinu fosfoketózového substrátu. Navzdory těmto mnoha podobnostem existují jemné rozdíly, které umožňují enzymům katalyzovat dvě zdánlivě odlišné reakce a přizpůsobit se substráty se velmi liší v poloze fosfátu (C-5 vs C-1).[6]
Reference
- ^ Englesberg, E .; R.L. Anderson; R. Weinberg (29. ledna 1962). „Mutanti Escherichia coli citlivé na L-arabinózu, L-ribulózu 5-fosfát 4-epimerázu“. Journal of Bacteriology. 84 (137): 137–46. doi:10.1128 / JB.84.1.137-146.1962. PMC 277779. PMID 13890280. Citováno 17. května 2011.
- ^ A b C d Yu, Luo; Jomy Samuel; Steven C Mosimann; Jeffrey E Lee; Martin E Tanner; Natalie CJ Strynadka (2001). „The Structure of Ribulose-5-Phosphate 4-Epimerase: an Aldolase-like Platform for Epimerization“. Biochemie. 40 (49): 14763–14771. CiteSeerX 10.1.1.510.5360. doi:10.1021 / bi0112513. PMID 11732895.
- ^ A b C d Lee LV, Vu MV, Cleland WW (duben 2000). „Účinky 13C a izotopu deuteria naznačují mechanismus štěpení aldolu pro 4-epimerázu L-ribulóza-5-fosfátu“. Biochemie. 39 (16): 4808–20. CiteSeerX 10.1.1.537.5159. doi:10.1021 / bi992894 +. PMID 10769138.
- ^ Andersson, Arnold; Gunter Schneider (15. května 1995). „Čištění a předběžné rentgenové krystalografické studie rekombinantní ~ -ribulosa-5-fosfát 4-epimerázy z Escherichia coli". Věda o bílkovinách. 4 (12): 1648–1650. doi:10.1002 / pro.5560040823. PMC 2143197. PMID 8520491.
- ^ Schlelf, Robert (prosinec 2000). "Regulace L-arabinózového operonu Escherichia coli". Trendy v genetice. 16 (12): 559–564. doi:10.1016 / S0168-9525 (00) 02153-3. PMID 11102706.[mrtvý odkaz ]
- ^ Samuel, Jomy; Yu Luo; Paul M. Morgan; Natalie CJ Strynadka; Martin E Tanner (9. listopadu 2001). „Katalýza a vazba v L-ribulóza-5-fosfát-4-epimeráze: Srovnání s L-fukulosa-fosfát-aldoláza“. Biochemie. 40 (49): 14772–14780. doi:10.1021 / bi011252v. PMID 11732896.
Další čtení
- BURMA DP, HORECKER BL (1958). „Fermentace pentózy od Lactobacillus Plantarum: IV. L-Ribulóza-5-fosfát 4-epimeráza ". J. Biol. Chem. 231 (2): 1053–64. PMID 13539036.
- Deupree JD; Wood WA (1970). "L-Ribulóza 5-fosfát 4-epimeráza Aerobacter aerogenes. Důkazy o 4-epimerizaci nezávislé na nikotinamidu a adeninu na dinukleotidu krystalickým enzymem “. J. Biol. Chem. 245 (15): 3988–95. PMID 4395381.
- Lee N, Patrick JW, Masson M (1968). "Krystalický L-ribulosa 5-fosfát 4-epimeráza z Escherichia coli ". J. Biol. Chem. 243 (18): 4700–5. PMID 4879898.
- WOLIN MJ, SIMPSON FJ, WOOD WA (1958). "Degradace L-arabinóza od Aerobacter aerogenes. III Identifikace a vlastnosti L-ribulóza-5-fosfát 4-epimerázy ". J. Biol. Chem. 232 (1): 559–75. PMID 13549442.






