Imunochemie lepku - Gluten immunochemistry
The imunochemie z Triticeae lepky je důležitý u několika zánětlivých onemocnění. Lze jej rozdělit na vrozené reakce (přímá stimulace imunitního systému), třída II zprostředkovaná prezentace (HLA DQ ), třída I. zprostředkovaná stimulace zabijácké buňky, a protilátka uznání. Odpovědi na lepek bílkoviny a polypeptid regiony se liší podle typu citlivosti na lepek. Reakce také závisí na genetickém složení lidský leukocytový antigen geny. U enteropatie citlivé na lepek existují 4 typy rozpoznávání, imunita (forma aktivace buněčné imunity), HLA-DQ, a protilátka uznání gliadin a transglutamináza. S idiopatickou citlivostí na lepek bylo vyřešeno pouze rozpoznávání protilátek proti gliadinu. v alergie na pšenici, cesty odezvy jsou zprostředkovány IgE proti jiným pšeničným proteinům a jiným formám gliadinu.

Imunita
|
Imunita na lepek odkazuje na imunitní odpověď který pracuje nezávisle na Receptor T-buněk nebo protilátka rozpoznání „vrozeného“ peptidu. Tento peptid působí přímo na buňky, jako jsou monocyty, stimuluje jejich růst a diferenciaci.[1] Vrozená imunita vůči lepku je komplikována zjevnou úlohou lepku při obcházení normální obrany hostitele a mechanismů vylučování peptidů ve střevě. I když to není skutečně vrozené, tyto aktivity umožňují gliadinu vstoupit do oblastí, kde je patronem mnoha lymfocytů. Při obtoku těchto filtrů mění gliadin normální chování obou zažívacích buněk, tzv enterocyty nebo epiteliální buňky a lymfocyty. Tím se zvyšuje potenciál způsobení citlivosti (viz Základní podmínky). Jedním z možných vysvětlení, proč se někteří lidé stávají citlivými, je to, že tito jedinci nemusí produkovat adekvátní peptidázy v některých oblastech střeva, což jim umožní přežít. Jiným vysvětlením může být, že potravinové chemikálie nebo léky oslabují obranyschopnost. To může být případ alergie na ω5-gliadin s citlivostí na salicylát. Neexistuje jasný důvod, ať už z genetiky, nebo z dlouhodobých studií vnímavých jedinců, proč by se tato omezení střevních peptidů změnila.
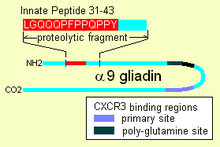
Jakmile je uvnitř, α-9 gliadin 31-55 vykazuje schopnost aktivovat nediferencované imunitní buňky, které pak proliferují a také produkují zánětlivé cytokiny, zejména interleukin 15 (IL-15). To produkuje řadu následných odpovědí, které jsou prozánětlivé. Druhým peptidem, který může mít vrozené chování, jsou peptidy vázající se na receptor „CXCR3“, receptor existuje na enterocytech, buňkách membrány kartáčového okraje. Peptid vytěsňuje imunitní faktor a signalizuje narušení membránového těsnění, těsných spojů mezi buňkami.
Alfa gliadin 31-43
Lepek nese vrozenou odezvu peptidu (IRP) nacházející se na a-9 gliadinu v polohách 31-43 a na a-3, 4, 5, 8 a 11 gliadinech. IRP leží v oblasti dlouhé 25 aminokyselin, která je rezistentní vůči pankreatické proteázy. 25mer je také odolný vůči Okraj kartáče membrána peptidázy z tenké střevo u celiaků.[3] IRP vyvolal rychlou expresi interleukin 15 (IL15) a další faktory.[4] IRP tedy aktivuje imunitní systém.[1][5] Studie ukazují, že zatímco u normálních jedinců je peptid v průběhu času upravován tak, aby produkoval neaktivní peptid, u celiaků může 19mer ztratit zbytek z jednoho nebo druhého konce, po prodloužené inkubaci zůstává 50% neporušených.
Intraepithileal lymfocyty a IL15
Uvolňování IL15 je hlavním faktorem celiakie, protože bylo zjištěno, že IL15 přitahuje intraepiteliální lymfocyty (IEL), které charakterizují celiakii Marshova stupně 1 a 2.[6] Lymfocyty přitahované IL-15 se skládají z obohacených markerů přirozené zabijácké buňky versus normální pomocné T-buňky. Jednou z hypotéz je, že IL-15 indukuje vysoce zánětlivou Thl reakci, která aktivuje pomocné T-buňky (specifické pro Diad2 s gliadinem), které pak organizují destruktivní odpověď, ale důvod, proč se zánětlivé buňky vyvíjejí před pomocnými buňkami specifickými pro gliadin, není znám.[7] Odpověď IRP se liší od typických odpovědí, které stimulují uvolňování IL15, jako je např virová infekce. Kromě toho další cytokiny jako IL12 a IL2, které jsou obvykle spojeny se stimulací T-pomocných buněk, nejsou zahrnuty. V těchto dvou směrech je vrozená peptidová aktivace T-buněk u celiakie zvláštní. Zdá se, že IL-15 vyvolává zvýšení SLÍDA a NKG2D což může zvýšit zabíjení buněk na hranici štětce.[1]
Kromě toho je zahrnuta vrozená imunita vůči IRP peptidu celiakie, dermatitis herpetiformis a možná juvenilní diabetes. IRP cíle monocyty a zvyšuje produkci IL-15 pomocí HLA-DQ nezávislý Cesta, následná studie ukázala, že jak tato oblast, tak „33mer" mohou vytvořit stejnou odpověď v buňkách jak u ošetřených celiaků, tak u neeliaků. Na rozdíl od neeliaků však léčené celiakální buňky produkují marker onemocnění dusitany.[8] To naznačuje, že další abnormalita u lidí s celiakií, která umožňuje stimulaci pokračovat za normální zdravý stav. Po rozsáhlé studii neexistuje žádná známá genetická asociace, která by se v současné době jeví jako výjimečná a implikuje do defektu další faktory prostředí.
Infiltrující peptidy
Některé alfa gliadiny mají jiné přímo působící vlastnosti. Jiné gliadinové peptidy, jeden v oblasti bohaté na glutamin a další peptid, „QVLQQSTYQLLQELCCQHLW“, váží chemoatraktantový receptor, CXCR3. Gliadin se váže na, blokuje a vytěsňuje faktor, I-TAC, který váže tento receptor.[2] V tomto procesu získává více CXCR3 receptorů, zvyšuje se MyD88 a Zonulin výraz.[1][9] Faktor, který vytěsňuje, I-TAC, je atraktantem T-buněk. Tento peptid může být také zapojen do zvýšeného rizika cukrovka 1. typu tak jako zonulin faktorem je také výroba.[10] Toto spouštění zonulinu nakonec vede k degradaci těsných spojů, které umožňují velkým solutům, jako jsou proteolyticky rezistentní fragmenty gliadinu, vstupovat za membránové buňky kartáčového okraje.
Jedna studie zkoumala účinek ω-5 gliadinu, primární příčiny WD-EIA a zjistili zvýšenou permeabilitu střevních buněk.[11] Další studie ukazují, že reaktivita IgE na ω-5 gliadin se výrazně zvyšuje, když je deamidován nebo zesítěn na transglutaminázu.[12]
Omezení HLA třídy I na gliadin
Omezení HLA třídy I na gliadin nejsou dobře charakterizována. HLA-A2 prezentace byla zkoumána. Antigeny HLA-A mohou zprostředkovat apoptóza u autoimunitních onemocnění a HLA A * 0201 u HLA-DQ8 haplotypy byly zdokumentovány.[13] Místa třídy I byla nalezena na karboxylovém konci gliadinu v polohách 123-131, 144-152 a 172-180. Zapojení odpovědí třídy I může být malé, protože protilátky proti transglutamináze korelují s patogenezí a rozpoznání extracelulární matrix a transglutaminázy na povrchu buněk může vysvětlit destrukci u celiakie. Tento proces zahrnuje na protilátkách závislá buněčná cytotoxicita. Pokud jde o receptor zvaný FOS, eufemisticky nazývaný „Death Receptor“, zdá se, že enterocyty nadměrně exprimují receptor v celiakálních lézích, existují spekulace, že prezentace třídy I gliadinu, tTG nebo jiných peptidů, které vyvolávají signalizaci. Úloha receptoru třídy I v buněčně zprostředkované programované buněčné (enterocytové) smrti není známa.
MIC
Tyto proteiny se nazývají sekvence A a B související s polypeptidem MHC třídy I. Podle zjištění sekvenční homologické analýzy se tyto proteiny nacházejí na povrchu enterocytů tenkého střeva a předpokládá se, že hrají roli v nemoci. Dosavadní studie neodhalily žádnou mutaci, která by zvyšovala riziko MICA.
HLA-DQ rozpoznávání lepku
 |  |
| Ilustrace HLA-DQ s peptidem ve vazebné kapse | HLA DQ receptor s navázaným peptidem a TCR |
|
HLA-DQ proteiny představují polypeptidové oblasti proteinů s přibližně 9 aminokyselinami a větší velikostí (10 až 14 zbytků podílejících se na vazbě je pro gliadin běžné) na T lymfocyty.[16]Gliadinové proteiny mohou být adsorbovány APC. Po trávení v lysozomy z APC mohou být gliadinové peptidy recyklovány na povrch buňky navázané na DQ, nebo mohou být navázány a prezentovány přímo z povrchu buňky.[17] Hlavním zdrojem zánětlivého lepku je dietní lepek. Optimální reaktivita gliadinu nastává, když je protein částečně tráven tenkým střevem lysozym a trypsin na proteolytické štěpení. Tyto polypeptidy lepku se pak mohou dostat za epiteliální vrstvu buněk (membránu), kde APC a T-buňky sídlí v lamina propria. (Vidět: Základní podmínky)
APC nesoucí DQ-gliadinový peptid na povrchu se může vázat na T-buňky, které mají podobné protilátkám Receptor T buněk specificky rozpoznávaný DQ2.5 s gliadinem. Komplex (APC-DQ-gliadin) tak stimuluje dělení specifických gliadinových T-buněk. Tyto buňky způsobují B-buňky které rozpoznávají gliadin množit se. B-buňky dozrávají plazmatické buňky produkující protilátky proti gliadinu. To nezpůsobuje celiakii a je neznámým faktorem idiopatické onemocnění. Enteropatie se předpokládá, že nastane, když tkáňová transglutamináza (tTG) tajně odkazuje na gliadin peptidy které vstupují do lamina propria střeva villus. Výsledná struktura může být prezentována APC (se stejným gliadinem rozpoznávajícím DQ izoformy) T-buňkám a B-buňky mohou produkovat protilátky proti transglutamináze. Zdá se, že to má za následek zničení klků. Uvolňování gliadinu transglutaminázou nesnižuje onemocnění. Když tTG-gliadin prochází hydrolýza (ukradne vodu, aby je od sebe oddělil), výsledkem je deamidovaný gliadin. Deamidated gliadinové peptidy jsou ve srovnání s přírodními peptidy zánětlivější. Deamidovaný gliadin se také nachází v potravinách, které obsahovaly lepek, jako je pšeničný chléb, potravinářské pasty.
Hlavními glutenovými proteiny, které se podílejí na celiakii, jsou izoformy α-gliadinu. Alfa gliadin se skládá z opakování motivy že při trávení mohou být prezentovány molekulami HLA-DQ. DQ2.5 rozpoznává několik motivů v lepkových proteinech, a proto HLA-DQ dokáže rozpoznat mnoho motivů na každém gliadinu (viz Porozumění DQ haplotypům a DQ izoformám napravo)[18] Počty různých bílkovin z trávy kmen Triticeae Bylo zjištěno, že nesou motivy prezentované HLA DQ2.5 a DQ8. Pšenice má velké množství těchto proteinů, protože jeho genom obsahuje chromozomy odvozené od dvou kozí tráva druhy a primitivní druhy pšenice.[19][20] Pozice těchto motivů v různých druzích, kmenech a izoformách se mohou lišit kvůli inzercím a delecím v sekvenci. Existuje velké množství variant pšenice a velké množství gliadiny v každé variantě, a tedy mnoho potenciálních stránek. Tyto proteiny, jakmile jsou jednou identifikovány a sekvenovány, mohou být zkoumány pomocí sekvenční homologie.
HLA-DQ2.5
Rozpoznání gliadinu HLA-DQ je rozhodující pro patogenezi enteropatie citlivé na lepek, zdá se také, že se podílí na idiopatické citlivosti na lepek (viz:Porozumění DQ haplotypům a DQ izoformám napravo).HLA-DQ2 primárně představuje gliadiny s izoformou HLA-DQ DQ2.5 (DQ α5-β2) izoforma. DQA1 * 0202: DQB1 * 0201 homozygoti (DQ a2-β2) se také zdají být schopni prezentovat patogenní gliadinové peptidy, ale menší soubor s nižší vazebnou afinitou.
DQ2,5 a α-gliadin
Mnoho z těchto gliadinových motivů je substrátem tkáňová transglutamináza a proto je lze upravit pomocí deamidace ve střevě k vytvoření více zánětlivých peptidů. Zdá se, že nejdůležitější rozpoznávání směřuje k α- / β-gliadiny. Příklad opakování motivu napříč mnoha proteiny, α-2 gliadin (57-68) a (62-75) se také nacházejí na α-4, α-9 gliadinu.[22] Mnoho gliadinů obsahuje „motiv α-20“, který se nachází v pšenici a dalších Triticeae rody. (viz také: "α-20" gliadinové motivy). Alfa-2 secalin, lepkavý protein v žitě, je složen ze dvou amino-koncových překrývajících se míst T-buněk v pozicích (8-19) a (13-23).[22]
A2-gliadin

Ačkoli u celiakie lze nalézt odpověď T-buněk na mnoho prolaminů, zdá se, že zaměřením T-buněk je jeden konkrétní gliadin, a2-gliadin.[23] Tyto odpovědi byly závislé na předchozí léčbě tkáňová transglutamináza. Α2-gliadin se liší od ostatních α-gliadinů, konkrétně proto, že obsahuje inzert 14 aminokyselin.[24] Tato konkrétní inzerce vytváří 6 míst T-buněk, kde v nejpodobnějších gliadinech jsou 2 nebo méně míst. Stránky patří třem epitop skupiny „α-I“, „α-II“ a „α-III“[25] Inzerce také vytváří větší oblast a-gliadinu, která je rezistentní na gastrointestinální proteázy. Nejmenší digest trypsinu a chymotrypsinu pro region je a 33mer.[1] Tato konkrétní oblast má tři tkáňová transglutaminázová místa, dvě místa, která leží uvnitř inzerce 14 aminokyselin, oblast maximální stimulace se nachází s více než 80% snížením odpovědi na nativní, nedeaminovanou sekvenci v poloze.[26] Vzhledem k hustotě míst T-buněk na „33meru“ afinita k deamidovanému gliadinu silně naznačuje, že s ním lze nejlépe zacházet jako s jedním místem T-buněk s mnohem vyšší afinitou.[1] Samotné toto místo může splňovat všechny adaptivní imunitní požadavky na pomocné buňky T s účastí HLA-DQ2.5 na některé celiakii.
DQ2,5 a y-gliadin
Zatímco gama gliadin není pro onemocnění zprostředkovaná DQ2.5 tak důležitý jako α-2 gliadin, existuje řada identifikovaných motivů. Identifikované gama epitopy jsou DQ2- „γ-I“, - „γ-II“ (γ30), - „γ-III“, - „γ-IV“, - „γ-VI“ a - „γ-VII“ [27][28]Některé z těchto epitopů jsou rozpoznávány u dětí, které nemají reaktivitu T-buněk vůči α-2 gliadinu.[29] Na γ-5 gliadinu, pozice 26–51, byl nalezen fragment zbytku proteolytické rezistence 26, který má více transglutamináz a T-buněčných epitopů. Toto místo má 5 překrývajících se T-buněčných míst DQ2- „γ-II“, - „γ-III“, - „γ-IV“ a „γ-glia 2“.[30] Počítačová analýza 156 prolaminů a glutelinů odhalila mnoho odolnějších fragmentů, jeden, y-gliadin, obsahující 4 epitopy, měl délku 68 aminokyselin.
DQ2 a gluteliny
Gluteliny z Triticeae prezentované DQ2 jsou někteří celiatici. U pšenice mají nízkomolekulární gluteniny často strukturní podobnost s prolaminy podobných druhů Triticeae. Byly identifikovány dva motivy, podobné Kl (46-60), podobné pGH3 (41-59) a GF1 (33-51). Vysoko molekulární glutenin byl také identifikován jako potenciálně toxický protein[31] Některé z HMW gluteninů zvyšují odpověď při léčbě transglutaminázou, což naznačuje, že místa mohou být podobná místům T-buněk alfa-gliadinu a gama gliadinu.[32]
DQ2.2 omezené stránky s gliadinem
DQ2.2 může představovat menší počet míst s nižší afinitou ve srovnání s DQ2.5. Některé z těchto míst se nacházejí na γ-gliadinu, který je nejvíce podobný gliadinu prolaminy dalších Triticeae rody, gliadin, který se jeví jako podobný předkům. Buňky prezentující antigen nesoucí DQ2.2 mohou prezentovat místa alfa gliadinu, například oblast alfa-II „33meru“, a proto může „33mer“ hrát roli u jedinců nesoucích DQ2.2, ale vazebná kapacita je podstatně nižší.[28]
HLA-DQ8
HLA-DQ8 propůjčuje náchylnost k celiakii, ale způsobem podobným DQ2.5.[33] Homozygoti DQ8, DQ2.5 / DQ8 a DQ8 / DQ2.2 jsou vyšší, než se očekávalo na základě hladin v obecné populaci. (Viz: Porozumění DQ haplotypům a DQ izoformám).[15] HLA-DQ8 obecně není tak zapojen do nejzávažnějších komplikací a nerozpoznává „33mer“ α-2 gliadinu ve stejné míře jako DQ2.5. Existuje menší počet gliadinových (prolaminových) peptidů prezentovaných HLA-DQ8. Bylo provedeno několik studií o adaptivní imunitní odpovědi u jedinců s DQ8 / DQ2. Zdá se, že DQ8 se mnohem více spoléhá na adaptivní imunitu vůči karboxylové polovině alfa gliadinů.[34] Navíc se zdá, že reaguje s gama gliadinem v míře srovnatelné s DQ2.5.[35] Reakce T-buněk na glutenin s vysokou molekulovou hmotností mohou být důležitější u celiakie zprostředkované DQ8 než u DQ2.5.[31]
Rozpoznávání protilátek
Rozpoznávání protilátek proti lepku je složité. Přímá vazba na lepek jako např protilátky proti gliadinu má nejednoznačnou patogenezi u celiakie. Zesíťování gliadinu s tkáňovou transglutaminázou vede k produkci protilátky proti transglutamináze, ale toto je zprostředkováno rozpoznáváním gliadinu T-buňkami. The alergické rozpoznávání gliadinu u žírných buněk mají eosinofily v přítomnosti IgE významné přímé důsledky, jako např anafylaxe vyvolaná cvičením.
Anti-gliadinové protilátky, stejně jako protilátky detekované při celiakii, se vážou na a-2 gliadin (57-73).[36]Toto místo je v „33meru“ reaktivním s T-buňkami prezentovaném DQ2.5. Tam byl nějaký návrh pšenice hraje roli v juvenilní diabetes jako protilátky proti nelepivému skladování semen glb-1 (globulin) se podílejí na křížové reakci autoantigenní protilátky, které ničí buňky ostrůvků ve slinivce břišní.[37] Bylo zjištěno, že protilátky proti gliadinu synapsin I[38] Omega-gliadin a protilátky HMU Glutenin podjednotky byly nalezeny nejčastěji u jedinců s anafylaxe vyvolaná cvičením a Bakerova alergie a představují silnou třídu lepkových alergenů. Nelepivé bílkoviny v pšenici jsou také alergeny, mezi ně patří: LTP (albumin /globulin ), thioredoxin -hB a pšeničná mouka peroxidáza.[39][40][41][42] Bylo zjištěno, že konkrétní peptid s 5 zbytky, motiv Gln-Gln-Gln-Pro-Pro, je hlavním alergenem na pšenici.[43]
Zkrocení imunochemie Triticeae
Nové imunogenní motivy se objevují v literatuře téměř každý měsíc a nový gliadin a Triticeae objevují se proteinové sekvence, které obsahují tyto motivy. HLA DQ2.5 omezený peptid "IIQPQQPAQ" produkoval přibližně 50 zásahů identických sekvencí při hledání NCBI-Blast je jedním z několika desítek známých motivů[22] zatímco byla zkoumána pouze malá část variant lepku Triticeae. Z tohoto důvodu je imunochemie nejlépe diskutována na úrovni Triticeae, protože je zřejmé, že speciální imunologické vlastnosti proteinů se zdají mít bazální afinitu k těmto taxonům a objevují se koncentrované v pšenici jako výsledek jeho tří různých genomů. Některé současné studie tvrdí, že odstranění toxicity gliadinů z pšenice jako pravděpodobné,[44] ale jak ukazuje výše, problém je monumentální. Existuje mnoho glutenových proteinů, tři genomy s mnoha geny pro alfa, gama a omega gliadiny. U každého motivu je přítomno mnoho genomových lokusů a existuje mnoho motivů, některé stále nejsou známy.
Různé kmeny Triticeae existují pro různé průmyslové aplikace; durum na těstoviny a potravinářské pasty, dva druhy ječmene na pivo, chlebové pšenice používané v různých oblastech s různými pěstitelskými podmínkami. Nahrazení těchto motivů není věrohodný úkol, protože kontaminace 0,02% pšenice v bezlepkové stravě je považována za patogenní a vyžadovala by výměnu motivů u všech známých regionálních odrůd - potenciálně tisíců genetických modifikací.[44] Odezvy třídy I a protilátky jsou downstream od rozpoznávání třídy II a mají malou nápravnou hodnotu při změně. Vrozenou odezvou peptidu by mohla být stříbrná kulka, za předpokladu, že existuje pouze jeden z nich na protein a pouze několik genomových lokusů s proteinem. Nevyřešené otázky související s úplným pochopením imunitních odpovědí na lepek jsou: Proč rychle stoupá rychlost pozdní citlivosti na lepek? Je to opravdu problém s pšenicí, nebo něco, co se dělá s pšenicí nebo s těmi, kdo jí pšenici (například přenosné nemoci jsou spouštěčem? Někteří jedinci jsou náchylní k genetice (časný nástup), ale mnoho případů s pozdním nástupem by mohlo mít různé spouštěče, protože neexistuje nic, co by geneticky oddělilo 30 až 40% lidí mohl mít Triticeae citlivost od ~ 1%, které za svůj život vůle mít určitou úroveň této nemoci.
Dalším způsobem, jak učinit pšenici méně imunogenní, je vložit proteolytická místa do delších motivů (25-mer a 33-mer), což usnadňuje úplnější trávení.
Reference
- ^ A b C d E F G h van Heel DA, West J (červenec 2006). „Nedávný pokrok v celiakii“. Střevo. 55 (7): 1037–46. doi:10.1136 / gut.2005.075119. PMC 1856316. PMID 16766754.
- ^ A b Lammers KM, Lu R, Brownley J a kol. (Červenec 2008). „Gliadin indukuje zvýšení střevní permeability a uvolňování zonulinu vazbou na chemokinový receptor CXCR3“. Gastroenterologie. 135 (1): 194–204.e3. doi:10.1053 / j.gastro.2008.03.023. PMC 2653457. PMID 18485912.
- ^ Mamone G, Ferranti P, Rossi M a kol. (Srpen 2007). „Identifikace peptidu z alfa-gliadinu rezistentního na zažívací enzymy: důsledky pro celiakii“. J. Chromatogr. B. 855 (2): 236–41. doi:10.1016 / j.jchromb.2007.05.009. PMID 17544966.
- ^ Dalšími faktory jsou (aktivace COX-2, CD25, p38 MAP kinázy buňkami negativními na CD3 (mononukleární buňky Lamina proxima) a CD83 na dendritických buňkách
- ^ Maiuri L, Ciacci C, Ricciardelli I, Vacca L, Raia V, Auricchio S, Picard J, Osman M, Quaratino S, Londei M (2003). "Sdružení mezi vrozenou odpovědí na gliadin a aktivací patogenních T buněk u celiakie". Lanceta. 362 (9377): 30–37. doi:10.1016 / S0140-6736 (03) 13803-2. PMID 12853196. S2CID 29403502.
- ^ Maiuri L, Ciacci C, Vacca L a kol. (Leden 2001). „IL-15 řídí specifickou migraci CD94 + a TCR-gammadelta + intraepiteliální lymfocyty v orgánových kulturách léčených pacientů s celiakií.“ Dopoledne. J. Gastroenterol. 96 (1): 150–6. PMID 11197245.
- ^ Londei M, Ciacci C, Ricciardelli I, Vacca L, Quaratino S, Maiuri L (květen 2005). „Gliadin jako stimulátor vrozených odpovědí na celiakii“. Mol. Immunol. 42 (8): 913–8. doi:10.1016 / j.molimm.2004.12.005. PMID 15829281.
- ^ Bernardo D, Garrote JA, Fernández-Salazar L, Riestra S, Arranz E (2007). „Je gliadin skutečně bezpečný pro neceliatické jedince? Produkce interleukinu 15 v bioptické kultuře od neceliatických jedinců napadených gliadinovými peptidy“. Střevo. 56 (6): 889–90. doi:10.1136 / gut.2006.118265. PMC 1954879. PMID 17519496.
- ^ Thomas KE, Sapone A, Fasano A, Vogel SN (únor 2006). „Gliadinová stimulace exprese zánětlivých genů myších makrofágů a střevní propustnosti závisí na MyD88: role vrozené imunitní odpovědi u celiakie“. J. Immunol. 176 (4): 2512–21. doi:10,4049 / jimmunol.176.4.2512. PMID 16456012.
- ^ Sapone A, de Magistris L, Pietzak M, et al. (Květen 2006). „Regulace zonulinu je spojena se zvýšenou propustností střev u subjektů s diabetem 1. typu a jejich příbuzných“. Cukrovka. 55 (5): 1443–9. doi:10 2337 / db05-1593. PMID 16644703.
- ^ Bodinier M, Legoux MA, Pineau F a kol. (Květen 2007). "Střevní translokační schopnosti pšeničných alergenů pomocí buněčné linie Caco-2". J. Agric. Food Chem. 55 (11): 4576–83. doi:10.1021 / jf070187e. PMID 17477542.
- ^ Palosuo K, Varjonen E, Nurkkala J a kol. (Červen 2003). „Transglutaminázou zprostředkované zesíťování peptické frakce omega-5 gliadinu zvyšuje reaktivitu IgE u pšenice závislé anafylaxe vyvolané cvičením“. J. Allergy Clin. Immunol. 111 (6): 1386–92. doi:10.1067 / mai.2003.1498. PMID 12789243.
- ^ Gianfrani C, Troncone R, Mugione P, Cosentini E, De Pascale M, Faruolo C, Senger S, Terrazzano G, Southwood S, Auricchio S, Sette A (2003). „Asociace celiakie s odpověďmi CD8 + T buněk: identifikace nového epitopu s omezeným HLA-A2 odvozeným od gliadinu“. J. Immunol. 170 (5): 2719–26. doi:10,4049 / jimmunol.170.5.2719. PMID 12594302.
- ^ van Belzen MJ, Koeleman BP, Crusius JB a kol. (Květen 2004). „Definování příspěvku regionu HLA k pacientům s celiakií pozitivních na cis DQ2“. Genes Immun. 5 (3): 215–20. doi:10.1038 / sj.gene.6364061. PMID 15014431.
- ^ A b Karell K, Louka AS, Moodie SJ a kol. (Duben 2003). „Typy HLA u pacientů s celiakií, kteří nejsou nositeli heterodimeru DQA1 * 05-DQB1 * 02 (DQ2): výsledky Evropské genetické skupiny pro celiakii“. Hučení. Immunol. 64 (4): 469–77. doi:10.1016 / S0198-8859 (03) 00027-2. PMID 12651074.
- ^ van de Wal Y, Kooy YM, Drijfhout JW, Amons R, Koning F (1996). "Vazebné vlastnosti peptidu molekuly DQ (alfa1 * 0501, beta1 * 0201) spojené s celiakií". Imunogenetika. 44 (4): 246–53. doi:10.1007 / BF02602553. PMID 8753854. S2CID 6103676.
- ^ A b Qiao SW, Bergseng E, Molberg O, Xia J, Fleckenstein B, Khosla C, Sollid LM (2004). „Prezentace antigenu 33-merního gliadinového peptidu přirozeně vytvořeného trávením zažívacím traktem na T buňkách. J. Immunol. 173 (3): 1756–1762. doi:10,4049 / jimmunol.173.3.1757. PMID 15265905.
- ^ McLachlan A, Cullis PG, Cornell HJ (říjen 2002). "Použití motivů rozšířených aminokyselin pro zaměření na toxické peptidy u celiakie". J. Biochem. Mol. Biol. Biophys. 6 (5): 319–24. doi:10.1080/1025814021000003238. PMID 12385967.
- ^ Heun M, Schäfer-Pregl R, Klawan D, Castagna R, Accerbi M, Borghi B, Salamini F (1997). „Místo domestikace pšenice Einkorn identifikované otiskem DNA“. Věda. 278 (5341): 1312–1314. Bibcode:1997Sci ... 278.1312H. doi:10.1126 / science.278.5341.1312.
- ^ Dvořák J, Akhunov ED, Akhunov AR, Deal KR, Luo MC (2006). „Molekulární charakterizace diagnostického DNA markeru pro domestikovanou tetraploidní pšenici poskytuje důkazy o toku genů z divoké tetraploidní pšenice do hexaploidní pšenice“. Mol Biol Evol. 23 (7): 1386–1396. doi:10.1093 / molbev / msl004. PMID 16675504.
- ^ Kim C, Quarsten H, Bergseng E, Khosla C, Sollid L (2004). "Strukturální základ pro prezentaci glutenových epitopů u celiakie zprostředkovanou HLA-DQ2". Proc Natl Acad Sci USA. 101 (12): 4175–9. Bibcode:2004PNAS..101,4175K. doi:10.1073 / pnas.0306885101. PMC 384714. PMID 15020763.
- ^ A b C Vader L, Stepniak D, Bunnik E, Kooy Y, de Haan W, Drijfhout J, Van Veelen P, Koning F (2003). "Charakterizace toxicity obilovin pro pacienty s celiakií na základě homologie bílkovin v zrnech". Gastroenterologie. 125 (4): 1105–13. doi:10.1016 / S0016-5085 (03) 01204-6. PMID 14517794.
- ^ Arentz-Hansen H, Körner R, Molberg O a kol. (Únor 2000). „Reakce střevních T buněk na alfa-gliadin u dospělých s celiakií je zaměřena na jediný deamidovaný glutamin cílený tkáňovou transglutaminázou“. J. Exp. Med. 191 (4): 603–12. doi:10.1084 / jem.191.4.603. PMC 2195837. PMID 10684852.
- ^ Sekvence vložky je P-Q-P-Q-L-P-Y-P-Q-P-Q-L-P-Y Arentz-Hansen H, Körner R, Molberg O; et al. (Únor 2000). „Reakce střevních T buněk na alfa-gliadin u dospělých s celiakií je zaměřena na jediný deamidovaný glutamin cílený tkáňovou transglutaminázou“. J. Exp. Med. 191 (4): 603–12. doi:10.1084 / jem.191.4.603. PMC 2195837. PMID 10684852.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ 1 místo „α-I“, 3 místa „α-II“ a 2 místa „α-III“, Qiao SW, Bergseng E, Molberg Ø; et al. (Srpen 2004). „Prezentace antigenu 33-mer gliadinového peptidu přirozeně vytvořeného trávením zažívacím traktem z T buněk odvozených z celiakie“. J. Immunol. 173 (3): 1757–62. doi:10,4049 / jimmunol.173.3.1757. PMID 15265905.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Anderson RP, van Heel DA, Tye-Din JA, Jewell DP, Hill AV (duben 2006). "Antagonisté a netoxické varianty dominantního pšeničného gliadinového T buněčného epitopu u celiakie". Střevo. 55 (4): 485–91. doi:10.1136 / gut.2005.064550. PMC 1856168. PMID 16299041.
- ^ lim "γ-II" = IQPEQPAQL, lim "γ-III" = EQPEQPYPE, lim "γ-IV" = SQEFPQPEQ, "γ-VI" = PEQPFPEQPEQ a lim "γ-VII" = PQPQQQFPQ jsou odvozeny z Qiao SW, Bergseng E, Molberg O, Jung G, Fleckenstein B, Sollid LM (červenec 2005). „Zpřesnění pravidel vazby epiadopu T buněk gliadinu na molekulu DQ2 spojenou s onemocněním u celiakie: význam mezery prolinů a deamidace glutaminu“. J. Immunol. 175 (1): 254–61. doi:10,4049 / jimmunol.175.1.254. PMID 15972656.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Qiao SW, Bergseng E, Molberg O, Jung G, Fleckenstein B, Sollid LM (červenec 2005). „Zpřesnění pravidel vazby epiadopu T buněk gliadinu na molekulu DQ2 spojenou s onemocněním u celiakie: význam mezery prolinů a deamidace glutaminu“. J. Immunol. 175 (1): 254–61. doi:10,4049 / jimmunol.175.1.254. PMID 15972656.
- ^ Vader W, Kooy Y, Van Veelen P a kol. (Červen 2002). „Lepková odezva u dětí s celiakií je zaměřena na více gliadinových a gluteninových peptidů“. Gastroenterologie. 122 (7): 1729–37. doi:10.1053 / gast.2002.33606. PMID 12055577.
- ^ Shan L, Qiao SW, Arentz-Hansen H a kol. (2005). „Identifikace a analýza multivalentních proteolyticky rezistentních peptidů z lepku: důsledky pro celiakální sprue“. J. Proteome Res. 4 (5): 1732–41. doi:10.1021 / pr050173t. PMC 1343496. PMID 16212427.
- ^ A b Dewar D, Amato M, Ellis H, Pollock E, Gonzalez-Cinca N, Wieser H, Ciclitira P (2006). "Toxicita vysokomolekulárních gluteninových podjednotek pšenice pro pacienty s celiakií". Eur J Gastroenterol Hepatol. 18 (5): 483–91. doi:10.1097/00042737-200605000-00005. PMID 16607142. S2CID 13405457.
- ^ Molberg Ø, Solheim Flaete N, Jensen T a kol. (Srpen 2003). "Střevní reakce T-buněk na vysokomolekulární gluteniny u celiakie". Gastroenterologie. 125 (2): 337–44. doi:10.1016 / S0016-5085 (03) 00890-4. PMID 12891534.
- ^ HLA-DQ8 obecně označuje DQ8.1, DQA1 * 0301: DQB1 * 0302, ale DQA1 * 0301 a DQA1 * 0303 mohou produkovat stejnou funkční izoformu, zřídka je DQA1 * 0503 v haplotypu DQ8, nemá známou souvislost s onemocněním
- ^ pozice (~ 230-240) a (> 241- <255) alfa gliadinu AJ133612
- ^ U γ-gliadinů, γ-M369999 gliadin, dochází k reakci na více místech (poloha: (~ 16-24), (> 41- <60), (~ 79-90), (~ 94-102), (> 101 - <120))
- ^ Bateman EA, Ferry BL, hala A, Misbah SA, Anderson R, Kelleher P (2004). „IgA protilátky pacientů s celiakií rozpoznávají dominantní T buněčný epitop A-gliadinu“. Střevo. 53 (9): 1274–1278. doi:10.1136 / gut.2003.032755. PMC 1774203. PMID 15306584.
- ^ MacFarlane AJ, Burghardt KM, Kelly J, Simell T, Simell O, Altosaar I, Scott FW (2003). „Protein z cukrovky typu 1 spojený s cukrovkou (Triticum aestivum). CDNA klon pšeničného skladovacího globulinu, Glb1, spojený s poškozením ostrůvků“. J Biol Chem. 278 (1): 54–63. doi:10,1074 / jbc.M210636200. PMID 12409286.
- ^ Alaedini A, Okamoto H, Briani C a kol. (2007). „Imunitní zkřížená reaktivita při celiakii: protilátky proti gliadinu se vážou na neuronální synapsin I“. J. Immunol. 178 (10): 6590–5. doi:10,4049 / jimmunol.178.10.6590. PMID 17475890.
- ^ Pastorello EA, Farioli L, Conti A a kol. (2007). „Alergie na pšenici zprostředkovaná IgE u evropských pacientů: inhibitory alfa-amylázy, bílkoviny pro přenos lipidů a nízkomolekulární gluteniny. Alergenní molekuly rozpoznány dvojitě zaslepenou, placebem kontrolovanou potravinovou výzvou“. Mezinárodní archiv alergie a imunologie. 144 (1): 10–22. doi:10.1159/000102609. PMID 17496422.
- ^ Gómez L, Martín E, Hernández D a kol. (1990). „Členové rodiny inhibitorů alfa-amylázy z pšeničného endospermu jsou hlavními alergeny spojenými s pekařským astmatem.“ FEBS Lett. 261 (1): 85–8. doi:10.1016 / 0014-5793 (90) 80642-V. PMID 2307238.
- ^ Weichel M, Glaser AG, Ballmer-Weber BK, Schmid-Grendelmeier P, Crameri R (2006). „Pšenice a kukuřice thioredoxiny: nová rodina křížově reaktivních alergenů na cereálie související s pekařským astmatem“. J. Allergy Clin. Immunol. 117 (3): 676–81. doi:10.1016 / j.jaci.2005.11.040. PMID 16522470.
- ^ Sánchez-Monge R, García-Casado G, López-Otín C, Armentia A, Salcedo G (1997). „Peroxidáza z pšeničné mouky je prominentní alergen spojený s pekařským astmatem“. Clin. Exp. Alergie. 27 (10): 1130–7. doi:10.1111 / j.1365-2222.1997.tb01149.x. PMID 9383252.
- ^ Tanabe S, Arai S, Yanagihara Y, Mita H, Takahashi K, Watanabe M (1996). „Hlavní pšeničný alergen má motiv Gln-Gln-Gln-Pro-Pro identifikovaný jako epitop vázající IgE.“ Biochem. Biophys. Res. Commun. 219 (2): 290–3. doi:10.1006 / bbrc.1996.0225. PMID 8604979.
- ^ A b Benahmed M, Mention J, Matysiak-Budnik T, Cerf-Bensussan N (2003). „Celiakie: budoucnost bez bezlepkové stravy ??“. Gastroenterologie. 125 (4): 1264–7. doi:10.1016 / j.gastro.2003.07.002. PMID 14517809.








