Dikarbonyl - Dicarbonyl
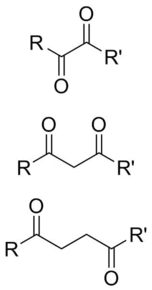
A dikarbonyl je molekula obsahující dva karbonyl (C = O) skupiny. I když by tento výraz mohl odkazovat na jakýkoli organická sloučenina obsahující dvě karbonylové skupiny, konkrétněji se používá k popisu molekul, ve kterých jsou oba karbonyly v dostatečně těsné blízkosti, aby se změnila jejich reaktivita, jako jsou 1,2-, 1,3- a 1,4-dikarbonylové skupiny. Jejich vlastnosti se často liší od vlastností monokarbonylů, a proto se obvykle považují za jejich vlastní funkční skupiny. Tyto sloučeniny mohou mít symetrické nebo nesymetrické substituenty na každém karbonylu a mohou být také funkčně symetrické (dialdehydy, diketony, diestery, atd.) nebo nesymetrické (ketoestery, ketokyseliny, atd.).
1,2-dikarbonyly
1,2-dialdehyd
Jediný 1,2-dialdehyd je glyoxal, (CHO)2. Jako mnoho alkyldialdehydů se s glyoxalem setkáváme téměř výlučně jako s jeho hydrátem a jeho oligomery. Tyto deriváty se často chovají jako aldehyd. Glyoxal snadno kondenzuje aminy. Prostřednictvím takových reakcí je předchůdcem mnoha heterocykly, např. imidazoly.

1,2-diketony
Hlavní diketon je diacetyl, také známý jako 2,3-butandion, CH3C (O) C (O) CH3. 1,2-Diketony jsou často generovány oxidací (dehydrogenací) dioly:[1]
- RCH (OH) CH (OH) R → RC (0) C (O) R + 2H2
2,3-butandion, 2,3-pentandion a 2,3-hexandion se nacházejí v malých množstvích v různých potravinách. Používají se jako aroma složky v nealkoholických nápojích a v pečivu.[1] Benzil, (PhCO)2, je odpovídající difenylový derivát.
Charakteristickým rysem 1,2-diketonů je dlouhá vazba C-C spojující karbonylové skupiny. Tato vzdálenost vazby je asi 1,54 Á, ve srovnání s 1,45 Á pro odpovídající vazbu v 1,3-butadien. Účinek se připisuje odpuzování mezi částečnými kladnými náboji atomů uhlíku v karbonylu.[2]
1,2-Diketony kondenzují s mnoha bifunkčními nukleofily, jako je např močovina a thiomočovina dát heterocykly. Kondenzace s aromatickými aminy dává diketimin ((RC = NAr)2).
V případech 1,2-cyklohexandion a 1,2-cyklopentandion, enol je asi o 1-3 kcal / mol stabilnější než diketo forma.[3]
1,2-Diestery a dikyseliny
Kyselina šťavelová a její estery definují tuto rodinu sloučenin. Dikyselina se průmyslově vyrábí oxidací odpadních cukrů. Vyskytuje se přirozeně (jako konjugovaná báze), zejména u členů rostlinného druhu Oxalis. Kondenzace diesterů s diaminy dává cyklické diamidy.
1,2-Keto- a formylkarboxylové kyseliny
Kyselina pyrohroznová (CH3KOKOS2H) je mateřská 2-ketokyselina. Jeho konjugovaná báze, pyruvát (CH3KOKOS2−), je součástí cyklus kyseliny citronové a produkt metabolismu glukózy (glykolýza ). Odpovídající aldehydová kyselina je kyselina glyoxalová (HC (O) CO2H).
1,3-dikarbonyly
1,3-dialdehydy
Mateřský 1,3-dialdehyd je malondialdehyd (CH2(CHO)2). Jako většina dialdehydů se s ním jako takový setkáváme jen zřídka. Místo toho se s ním zachází téměř výlučně jako s jeho hydrátem, methylacetalem a jeho oligomery. Tyto deriváty se často chovají jako rodiče. Je známo mnoho 2-substituovaných derivátů. Často se připravují alkylací izolovat malondialdehydu.
1,3-diketony
Důležitým členem je acetylaceton, CH3C (O) CH2C (O) CH3. Dimedone je cyklický 1,3-diketon. Acetylaceton se průmyslově připravuje tepelným přesmykem isopropenylacetátu.[1] Další cyklický 1,3-diketon je 2,2,4,4-tetramethylcyklobutandion, což je předchůdce užitečného diol.
- CH2(CH3) COC (O) Me → MeC (O) CH2Přijít
1,3-Diketony, které mohou tautomerizovat do enol to je konjugované na druhý karbonyl obvykle existují převážně v enolové formě, a to zejména tehdy, když lze produkt dále stabilizovat šestičlenným kruhem obsahujícím vodíkovou vazbu. Například procento enol in acetylaceton, trifluoracetyaceton, a hexafluoracetylaceton jsou 85, 97, respektive 100% (čisté, 33 ° C).[4]
Stejně jako ostatní diketony jsou 1,3-diketony všestrannými předchůdci heterocyklů. Hydrazin, například, kondenzuje dát pyrazoly.
Konjugovaná báze odvozená od 1,3-ketonů může sloužit jako ligand s tvořit koordinační komplexy acetylacetonátu kovu. V DeMayo reakce 1,3-diketony fotochemicky reagují s alkeny pericyklická reakce za vzniku (substituovaných) 1,5-diketonů.
Klasicky 1,3-diketony připravuje Claisenova kondenzace ketonu s esterem.
1,3-Diestery a dikyseliny
Kyselina malonová a její estery jsou mateřskými členy této třídy dikarbonylů. Běžné jsou také 2-substituované deriváty vzorce RCH (CO2R)2, které vznikají C-alkylací konjugované báze (enolátu) NaCH (CO2R)2.
1,4-dikarbonyly
1,4-dialdehydy
Sukcinaldehyd (CH2CHO)2 je nejjednodušší a výchozí 1,4-dialdehyd. Snadno hydratuje, čímž se získá 2,5-dihydroxytetrahydrofuran. Aromatický analog je ftalaldehyd. Tyto dikarbonyly tvoří heterocyklické hydráty, což ilustruje ftalaldehyd.

Podobné cyklizační rovnováhy platí pro vysoce reaktivní maleinový dialdehyd.[5]
1,4-diketony
Diketony se dvěma methylenovými skupinami oddělujícími karbonylové skupiny, nazývané také γ-diketony, obvykle koexistují s jejich enol tautomery. Prvním členem je acetonylaceton. 1,4-Diketony jsou užitečné prekurzory heterocyklů prostřednictvím Syntéza Paal – Knorr, což dává pyrroly:
Tato reaktivita je základem neurotoxicity γ-diketonů.[6] 1,4-Diketony jsou také předchůdci furany a thiofeny. Kondenzace 1,4-diketonů (a souvisejících substrátů) s hydraziny poskytují dihydropyridaziny, které lze převést na pyridaziny.
1,4-Diestery a dikyseliny
Kyselina jantarová a její estery jsou mateřskými členy této rodiny 1,4-dikarbonylů. Kyselina jantarová je pozoruhodná jako složka v cyklus kyseliny citronové. Tvoří anhydrid cyklické kyseliny, anhydrid kyseliny jantarové. Mezi nenasycené členy patří maleic a kyseliny fumarové a estery.
1,5-dikarbonyly
1,5-dialdehydy
Glutaraldehyd (CH2)3(CHO)2 je nejjednodušší a výchozí 1,5-dialdehyd. Snadno hydratuje. Aromatický analog je isophthalaldehyde.[7]
1,5-diketony
Tyto diketony mají tři methylenové skupiny oddělující karbonylové skupiny.
1,5-Diestery a dikyseliny
Kyselina glutarová (CH2)3(CO.)2H)2 je mateřská 1,5-dikyselina.
Hydratace a cyklizace

Sukcinaldehyd, glutaraldehyd, a adipaldehyd tvoří hydráty, které cyklizují.[8] Podobné reakce platí pro mnoho dikarbonylů.
Bezpečnost
Řada dikarbonylových sloučenin je bioaktivních. Je známo, že diacetyl způsobuje onemocnění plic bronchiolitis obliterans u osob, které tomu byly vystaveny v pracovním prostředí.[9] Dialdehydy, např. glutaraldehyd a malonaldehyd jsou fixační prostředky nebo sterilizátory.
Viz také
Reference
- ^ A b C Hardo Siegel; Manfred Eggersdorfer (2007). "Ketony". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. p. 16. doi:10.1002 / 14356007.a15_077.
- ^ Eriks, K .; Hayden, T. D .; Yang, S. Hsi; Chan, I.Y. (1983). „Krystal a molekulární struktura biacetylu (2,3-butandionu), (H3CCO)2, při -12 a -100 ° C ". J. Am. Chem. Soc. 105 (12): 3940–3942. doi:10.1021 / ja00350a032.
- ^ Jana, Kalyanashis; Ganguly, Bishwajit (2018). „DFT Study to Explore the Importance of Ring Size and Effect of Solvents on the Keto – Enol Tautomerization Process of α- and β-Cyclodiones“. ACS Omega. 3 (7): 8429–8439. doi:10.1021 / acsomega.8b01008. PMC 6644555. PMID 31458971.
- ^ Jane L. Burdett; Max T. Rogers (1964). „Keto-enolový tautomerismus v β-dikarbonylech studovaných nukleární magnetickou rezonanční spektroskopií. I. Protonové chemické posuny a rovnovážné konstanty čistých sloučenin“. J. Am. Chem. Soc. 86: 2105–2109. doi:10.1021 / ja01065a003.
- ^ D. M. Burness (1960). „2,5-dihydro-2,5-dimethoxyfuran“. Organické syntézy. 40: 29. doi:10.15227 / orgsyn.040.0029.
- ^ Stephen R Clough; Leyna Mulholland (2005), "Hexane", Encyklopedie toxikologie, 2 (2. vyd.), Elsevier, str. 522–525
- ^ Ackerman, J. H .; Surrey, A. R. (1967). „Isophthalaldehyde“. Organické syntézy. 47: 76. doi:10.15227 / orgsyn.047.0076.
- ^ Hardy, P. M .; Nicholls, A. C .; Rydon, H. N. (1972). „Hydratace a polymerace sukcinaldehydu, glutaraldehydu a adipaldehydu“. Journal of the Chemical Society, Perkin Transactions 2 (15): 2270. doi:10.1039 / P29720002270.
- ^ Kreiss, Kathleen (srpen 2017). „Uznáváme profesní účinky diacetylu: Co se můžeme z této historie poučit?“. Toxikologie. 388: 48–54. doi:10.1016 / j.tox.2016.06.009. PMC 5323392. PMID 27326900.


