Radiobiologie - Radiobiology
Radiobiologie (také známý jako radiační biologiea neobvykle jako aktinobiologie) je obor klinický a základní lékařské vědy to zahrnuje studium akce ionizující radiace zejména na živé věci účinky záření na zdraví. Ionizující záření je obecně škodlivé a potenciálně smrtelné pro živé věci, ale může mít zdravotní přínosy radiační terapie pro léčbu rakoviny a tyreotoxikóza. Jeho nejběžnějším dopadem je indukce rakoviny s latentní období let nebo desetiletí po expozici. Vysoké dávky mohou vizuálně působit dramaticky radiační popáleniny a / nebo rychlá fatalita prostřednictvím syndrom akutního záření. Používají se kontrolované dávky lékařské zobrazování a radioterapie.
Zdravé efekty
Ionizující záření je obecně škodlivé a potenciálně smrtelné pro živé bytosti, ale může mít pro zdraví přínos radiační terapie pro léčbu rakoviny a tyreotoxikóza.
Nejnepříznivější účinky ozáření na zdraví lze rozdělit do dvou obecných kategorií:
- deterministické účinky (reakce škodlivých tkání) z velké části způsobené usmrcením / nesprávnou funkcí buněk po vysokých dávkách; a
- stochastické účinky, tj. rakovina a dědičné účinky zahrnující buď vývoj rakoviny u exponovaných jedinců v důsledku mutace somatických buněk, nebo dědičné onemocnění u jejich potomků v důsledku mutace reprodukčních (zárodečných) buněk.[1]
Stochastický
Některé účinky ionizujícího záření na lidské zdraví jsou stochastický, což znamená, že jejich pravděpodobnost výskytu se zvyšuje s dávkou, zatímco závažnost je nezávislá na dávce.[2] Radiačně indukovaná rakovina, teratogeneze, kognitivní pokles, a srdeční choroba jsou všechny příklady stochastických účinků.
Jeho nejčastější dopad je stochastický indukce rakoviny s latentní dobou let nebo desetiletí po expozici. Mechanismus, podle kterého k tomu dochází, je dobře znám, ale kvantitativní modely předpovídající úroveň rizika zůstávají kontroverzní. Nejvíce přijímaný model předpokládá, že výskyt rakovin způsobených ionizujícím zářením se lineárně zvyšuje efektivní dávka záření ve výši 5,5% za sievert.[3] Pokud tohle lineární model je správné, pak je přirozené záření na pozadí nejnebezpečnějším zdrojem záření pro veřejné zdraví, následované lékařským zobrazením jako bezprostřední sekundou. Další stochastické účinky ionizujícího záření jsou teratogeneze, kognitivní pokles, a srdeční choroba.
Kvantitativní údaje o účincích ionizujícího záření na lidské zdraví jsou ve srovnání s jinými zdravotními stavy relativně omezené kvůli nízkému počtu dosud známých případů a kvůli stochastické povaze některých účinků. Stochastické účinky lze měřit pouze pomocí velkých epidemiologických studií, kde bylo shromážděno dostatek údajů k odstranění matoucích faktorů, jako jsou kuřácké návyky a další faktory životního stylu. Nejbohatší zdroj vysoce kvalitních dat pochází ze studia japonštiny přeživší atomové bomby. In vitro a pokusy na zvířatech jsou informativní, ale rádiový odpor se velmi liší mezi druhy.
Přidané celoživotní riziko vzniku rakoviny jediným CT břicha 8 mSv se odhaduje na 0,05% nebo na 1 z 2 000.[4]
Deterministický
Deterministický účinky jsou ty, které se spolehlivě vyskytnou nad prahovou dávkou a jejich závažnost se zvyšuje s dávkou.[2]
Vysoká dávka záření vede k deterministickým účinkům, které se spolehlivě vyskytují nad prahovou hodnotou, a jejich závažnost se zvyšuje s dávkou. Deterministické efekty nemusí být nutně více či méně závažné než stochastické efekty; buď může nakonec vést k dočasnému obtěžování nebo úmrtí. Příklady deterministických účinků jsou:
- Syndrom akutního záření akutním celotělovým zářením
- Radiační popáleniny, od záření k určitému povrchu těla
- Radiační tyroiditida, potenciální vedlejší účinek radiační léčby proti hypertyreóza
- Syndrom chronického záření, z dlouhodobého záření.
- Radiační poškození plic, například radiační terapie do plic
- Šedý zákal a neplodnost.[2]
Americká národní akademie věd pro biologické účinky ionizujícího záření „dospěla k závěru, že neexistují přesvědčivé důkazy, které by naznačovaly prahovou hodnotu dávky, pod níž je riziko indukce nádoru nulové“.[5]
| Fáze | Příznak | Celé tělo absorbovaná dávka (Gy ) | ||||
|---|---|---|---|---|---|---|
| 1–2 Gy | 2–6 Gy | 6–8 Gy | 8–30 Gy | > 30 Gy | ||
| Bezprostřední | Nevolnost a zvracení | 5–50% | 50–100% | 75–100% | 90–100% | 100% |
| Čas nástupu | 2–6 h | 1–2 h | 10–60 min | <10 min | Minut | |
| Doba trvání | <24 hodin | 24–48 hodin | <48 hodin | <48 hodin | N / A (pacienti zemřou za <48 h) | |
| Průjem | Žádný | Žádný až mírný (<10%) | Těžký (> 10%) | Těžký (> 95%) | Těžký (100%) | |
| Čas nástupu | — | 3–8 h | 1–3 h | <1 h | <1 h | |
| Bolest hlavy | Mírný | Mírné až střední (50%) | Střední (80%) | Těžká (80–90%) | Těžké (100%) | |
| Čas nástupu | — | 4–24 h | 3–4 h | 1–2 h | <1 h | |
| Horečka | Žádný | Mírný nárůst (10–100%) | Střední až těžká (100%) | Těžké (100%) | Těžké (100%) | |
| Čas nástupu | — | 1–3 h | <1 h | <1 h | <1 h | |
| CNS funkce | Žádné poškození | Kognitivní porucha 6–20 h | Kognitivní porucha> 24 hodin | Rychlá ztráta kapacity | Záchvaty, třes, ataxie, letargie | |
| Latentní období | 28–31 dní | 7–28 dní | <7 dní | Žádný | Žádný | |
| Nemoc | Mírný až střední Leukopenie Únava Slabost | Střední až těžká Leukopenie Purpura Krvácení Infekce Alopecie po 3Gy | Těžká leukopenie Vysoká horečka Průjem Zvracení Závrať a dezorientace Hypotenze Poruchy elektrolytů | Nevolnost Zvracení Těžký průjem Vysoká horečka Poruchy elektrolytů Šokovat | N / A (pacienti zemřou za <48 hodin) | |
| Úmrtnost | Bez péče | 0–5% | 5–95% | 95–100% | 100% | 100% |
| S péčí | 0–5% | 5–50% | 50–100% | 99–100% | 100% | |
| Smrt | 6–8 týdnů | 4–6 týdnů | 2–4 týdny | 2 dny - 2 týdny | 1–2 dny | |
| Zdroj tabulky[6] | ||||||
Podle typu záření
Když jsou pohlceny izotopy emitující částice alfa, jsou mnohem nebezpečnější, než by naznačoval jejich poločas nebo rychlost rozpadu. To je způsobeno vysokou relativní biologická účinnost alfa záření způsobí biologické poškození poté, co radioizotopy emitující alfa vstoupí do živých buněk. Požité radioizotopy alfa emitoru, jako je transuranics nebo aktinidy jsou v průměru asi 20krát nebezpečnější a v některých experimentech až 1000krát nebezpečnější než ekvivalentní aktivita radioizotopů emitujících beta nebo gama. Pokud typ záření není znám, lze jej určit diferenciálním měřením v přítomnosti elektrických polí, magnetických polí nebo různého množství stínění.
V těhotenství
Riziko vzniku rakoviny vyvolané zářením v určitém okamžiku života je větší při vystavení plodu než dospělému, a to jednak proto, že buňky jsou zranitelnější, když rostou, jednak proto, že po dávce vznikne mnohem delší životnost.
Mezi možné deterministické účinky patří radiační expozice v těhotenství potrat, strukturální vrozené vady, Omezení růstu a mentální postižení.[7] Deterministické účinky byly studovány například u osob, které přežily atomové bombardování Hirošimy a Nagasaki a případy, kdy radiační terapie bylo nutné během těhotenství:
| Gestační věk | Embryonální věk | Účinky | Odhadovaná prahová dávka (mGy ) |
|---|---|---|---|
| 2 až 4 týdny | 0 až 2 týdny | Potrat nebo žádný (vše nebo nic) | 50 - 100[7] |
| 4 až 10 týdnů | 2 až 8 týdnů | Strukturální vrozené vady | 200[7] |
| Omezení růstu | 200 - 250[7] | ||
| 10 až 17 týdnů | 8 až 15 týdnů | Těžká mentální postižení | 60 - 310[7] |
| 18 až 27 týdnů | 16 až 25 týdnů | Těžká mentální postižení (nižší riziko) | 250 - 280[7] |
Odhaduje se, že intelektuální deficit je asi 25 IQ-body na 1 000 mGy v 10. až 17. týdnu gestačního věku.[7]
Tyto účinky jsou někdy relevantní při rozhodování o lékařské zobrazování v těhotenství, od té doby projekční rentgenografie a CT skenování vystavuje plod záření.
Také riziko pro matku pozdější získání radiačně indukované rakovina prsu se zdá být zvláště vysoká pro dávky záření během těhotenství.[8]
Měření
Lidské tělo nemůže cítit ionizující záření s výjimkou velmi vysokých dávek, ale účinky ionizace lze použít k charakterizaci záření. Zajímavé parametry zahrnují rychlost dezintegrace, tok částic, typ částic, energii paprsku, kermu, rychlost dávky a dávku záření.
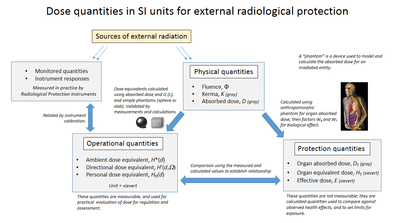
Vyžaduje se monitorování a výpočet dávek pro ochranu lidského zdraví dozimetrie a provádí se ve vědě o fyzika zdraví. Klíčovými nástroji pro měření je použití dozimetry dát vnější efektivní dávka absorpce a použití biologického testu pro požitou dávku. Článek o sievert shrnuje doporučení ICRU a ICRP týkající se použití dávkových množství a obsahuje průvodce účinky ionizujícího záření měřeného na sítích a uvádí příklady přibližných hodnot absorpce dávky v určitých situacích.
The odevzdaná dávka je mírou stochastického zdravotního rizika v důsledku příjmu radioaktivního materiálu do lidského těla. ICRP uvádí: „Pro vnitřní ozáření se závazné účinné dávky obecně určují z hodnocení příjmu radionuklidů z měření biotestem nebo jiných množství. Dávka záření se určuje z příjmu pomocí doporučených koeficientů dávky.“[9]
Absorbovaná, ekvivalentní a účinná dávka
The Absorbovaná dávka je množství fyzické dávky D představující střední energii předanou hmota na jednotku hmotnosti o ionizující radiace. V systému SI jednotek je měrná jednotka jouly na kilogram a její speciální název je šedá (Gy).[10] Non-SI CGS jednotka rad se někdy také používá, převážně v USA.
Představovat stochastické riziko ekvivalentní dávka H T a efektivní dávka E jsou použity a pro jejich výpočet z absorbované dávky jsou použity příslušné dávkové faktory a koeficienty.[11] Ekvivalentní a efektivní dávková množství jsou vyjádřena v jednotkách sievert nebo rem což znamená, že byly vzaty v úvahu biologické účinky. Obvykle jsou v souladu s doporučeními Mezinárodní výbor pro radiační ochranu (ICRP) a Mezinárodní komise pro radiační jednotky a měření (ICRU). Soudržný systém radiačních ochranných veličin, které vyvinuli, je uveden v doprovodném schématu.
Organizace
The Mezinárodní komise pro radiační ochranu (ICRP) spravuje Mezinárodní systém radiační ochrany, který stanoví doporučené limity pro příjem dávky. Hodnoty dávky mohou představovat absorbovanou, ekvivalentní, efektivní nebo potvrzenou dávku.
Mezi další důležité organizace studující toto téma patří
- Mezinárodní komise pro radiační jednotky a měření (ICRU)
- Vědecký výbor OSN pro účinky atomového záření (UNSCEAR)
- NÁS Národní rada pro radiační ochranu a měření (NCRP)
- Spojené království Public Health England
- NÁS Národní akademie věd (NAS prostřednictvím studií BEIR)
- francouzština Institut de radioprotection et de sûreté nucléaire (IRSN)
- Evropský výbor pro radiační riziko (ECRR) stupeň záření závisí na stupni ovlivnění částí těla
Cesty expozice
Externí


Vnější expozice je expozice, ke které dochází, když je radioaktivní zdroj (nebo jiný zdroj záření) mimo (a zůstává mimo) organismus, který je vystaven. Mezi příklady vnější expozice patří:
- Osoba, která umístí zapečetěné radioaktivní zdroj v kapse
- Cestovatel ve vesmíru, který je ozářen kosmické paprsky
- Osoba, která je léčena rakovina buď teleterapie nebo brachyterapie. Zatímco v brachyterapii je zdroj uvnitř osoby, je stále považován za vnější expozici, protože nevede k a odevzdaná dávka.
- Pracovník jaderné elektrárny, jehož ruce byly znečištěny radioaktivním prachem. Za předpokladu, že jsou jeho ruce očištěny před absorpcí, vdechnutím nebo požitím jakéhokoli radioaktivního materiálu, je kontaminace kůže považována za vnější expozici.
Vnější expozice je relativně snadný odhadnout a ozářený organismus se nestane radioaktivním, s výjimkou případu, kdy je záření intenzivní neutron paprsek, který způsobuje aktivace.
Podle typu lékařského zobrazování
Efektivní dávka podle lékařského zobrazovacího typu | |||
|---|---|---|---|
| Cílové orgány | Typ zkoušky | Účinná dávka u dospělých[12] | Ekvivalentní čas záření na pozadí[12] |
| CT hlavy | Jedna série | 2 mSv | 8 měsíců |
| S + bez radiokontrast | 4 mSv | 16 měsíců | |
| Hruď | CT hrudníku | 7 mSv | 2 roky |
| CT hrudníku, screeningový protokol rakoviny plic | 1,5 mSv | 6 měsíců | |
| Rentgen hrudníku | 0,1 mSv | 10 dní | |
| Srdce | Koronární CT angiografie | 12 mSv | 4 roky |
| Koronární CT vápníkové skenování | 3 mSv | 1 rok | |
| Břišní | CT břicha a pánve | 10 mSv | 3 roky |
| CT břicha a pánve, protokol s nízkou dávkou | 3 mSv[13] | 1 rok | |
| CT břicha a pánve, s + bez radiokontrast | 20 mSv | 7 let | |
| CT kolonografie | 6 mSv | 2 roky | |
| Intravenózní pyelogram | 3 mSv | 1 rok | |
| Série horního zažívacího traktu | 6 mSv | 2 roky | |
| Série dolního zažívacího traktu | 8 mSv | 3 roky | |
| Páteř | RTG páteře | 1,5 mSv | 6 měsíců |
| CT páteře | 6 mSv | 2 roky | |
| Končetiny | RTG končetiny | 0,001 mSv | 3 hodiny |
| Dolní končetiny CT angiografie | 0,3 - 1,6 mSv[14] | 5 týdnů - 6 měsíců | |
| Zubní rentgen | 0,005 mSv | 1 den | |
| DEXA (hustota kostí) | 0,001 mSv | 3 hodiny | |
| PET-CT kombinace | 25 mSv | 8 let | |
| Mamografie | 0,4 mSv | 7 týdnů | |
Vnitřní
K vnitřní expozici dochází, když radioaktivní materiál vstoupí do organismu a radioaktivní atomy se začlení do organismu. K tomu může dojít vdechováním, požitím nebo injekcí. Níže je uvedena řada příkladů vnitřní expozice.
- Expozice způsobená draslík-40 přítomný v a normální osoba.
- Expozice požití rozpustné radioaktivní látky, jako je např 89Sr v krávy ' mléko.
- Osoba, která je léčena na rakovinu pomocí a radiofarmaka kde se jako léčivo používá radioizotop (obvykle kapalina nebo pilulka). Přehled tohoto tématu byl publikován v roce 1999.[15] Protože se radioaktivní materiál důkladně promísí s postiženým předmětem, je často obtížné dekontaminovat předmět nebo osobu v případě, že dojde k vnitřní expozici. Zatímco některé velmi nerozpustné materiály, jako je štěpné produkty v rámci oxid uraničitý matice by se nikdy nemohla skutečně stát součástí organismu, je normální považovat takové částice v plicích a zažívacím traktu za formu vnitřní kontaminace, která vede k vnitřní expozici.
- Terapie zachycením borových neutronů (BNCT) zahrnuje injekci a bór-10 značená chemická látka, která se přednostně váže na nádorové buňky. Neutrony z a nukleární reaktor jsou tvarovány a moderátor neutronů do neutronového energetického spektra vhodného pro BNCT zpracování. Nádor je selektivně bombardován těmito neutrony. Neutrony rychle zpomalí v těle, aby se stala nízkou energií tepelné neutrony. Tyto tepelné neutrony jsou zachyceny vstřikovaným bórem-10 a tvoří se vzrušený (bór-11), který se rozpadá na lithium-7 a a helium-4 alfa částice oba produkují úzce rozmístěné ionizující záření. Tento koncept je popsán jako binární systém využívající dvě samostatné složky pro léčbu rakoviny. Každá složka sama o sobě je pro buňky relativně neškodná, ale při kombinovaném ošetření produkují vysoce cytocidní (cytotoxický ) účinek, který je smrtelný (v omezeném rozsahu 5-9 mikrometrů nebo přibližně s jedním průměrem buňky). Klinické studie se slibnými výsledky se v současné době provádějí ve Finsku a Japonsku.
Když radioaktivní sloučeniny vstoupí do lidského těla, účinky se liší od účinků vyplývajících z expozice vnějšímu zdroji záření. Zejména v případě alfa záření, které normálně neproniká kůží, může být expozice po požití nebo vdechnutí mnohem škodlivější. Radiační expozice je obvykle vyjádřena jako a odevzdaná dávka.
Dějiny
Přestože záření bylo objeveno na konci 19. století, nebezpečí radioaktivity a záření nebyla okamžitě rozpoznána. Akutní účinky záření byly poprvé pozorovány při použití rentgenového záření, když Wilhelm Röntgen záměrně podrobil své prsty rentgenovým paprskům v roce 1895. Publikoval svá pozorování týkající se popálenin, které se vyvinuly, i když je nesprávně rozdělil na ozon, volné radikály produkovaný ve vzduchu rentgenovými paprsky. Ostatní volné radikály produkované v těle jsou nyní považovány za důležitější. Jeho zranění se uzdravila později.
Jako oblast lékařských věd pochází radiobiologie Leopold Freund 1896 - ukázka terapeutického ošetření chlupatého krtek pomocí nového typu elektromagnetická radiace volala rentgenové záření, který objevil před 1 rokem německý fyzik, Wilhelm Röntgen. Po ozáření žab a hmyzu rentgenovými paprsky počátkem roku 1896 Ivan Romanovič Tarkhanov dospěli k závěru, že tyto nově objevené paprsky nejen fotografují, ale také „ovlivňují životní funkci“.[16] Současně Pierre a Marie Curie objevili radioaktivní polonium a radium, které se později používalo k léčbě rakovina.
Genetické účinky záření, včetně účinků na riziko rakoviny, byly zjištěny mnohem později. V roce 1927 Hermann Joseph Muller publikoval výzkum ukazující genetické účinky a v roce 1946 mu byla udělena Nobelova cena za jeho zjištění.
Obecněji řečeno, třicátá léta viděla pokusy vyvinout obecný model pro radiobiologii. Pozoruhodné zde bylo Douglas Lea,[17][18] jehož prezentace rovněž zahrnovala vyčerpávající přehled asi 400 podpůrných publikací.[19][stránka potřebná ][20]
Než byly známy biologické účinky záření, mnoho lékařů a společností začalo prodávat radioaktivní látky jako patentová medicína a radioaktivní šarlatánství. Příkladem bylo radia klystýr léčby a vody obsahující rádium, které se mají pít jako tonika. Marie Curie vystupoval proti tomuto druhu léčby a varoval, že účinky radiace na lidské tělo nebyly dobře pochopeny. Curie později zemřel aplastická anémie způsobené radiační otravou. Eben Byers, slavný americký prominent, zemřel na mnohočetné druhy rakoviny (ale ne syndrom akutního záření) v roce 1932 po konzumaci velkého množství rádium několik let; jeho smrt upozornila veřejnost na nebezpečí radiace. Ve 30. letech 20. století, po řadě případů nekrózy kostí a úmrtí nadšenců, téměř všechny léčivé přípravky obsahující radium z trhu zmizely.
Ve Spojených státech jsou zkušenosti tzv Radium dívky kde tisíce malířů s rádiovým vytáčením dostaly rakovinu ústní dutiny -[21]ale žádné případy syndromu akutního záření -[22]popularizoval varování o zdraví při práci spojená s radiačními riziky. Robley D. Evans, na MIT vyvinul první standard pro přípustnou zátěž těla rádium, klíčový krok k založení nukleární medicína jako studijní obor. S rozvojem jaderné reaktory a nukleární zbraně ve 40. letech 20. století byla věnována zvýšená vědecká pozornost studiu všech druhů radiačních účinků.
The atomové bombardování Hirošimy a Nagasaki vedlo k velkému počtu případů otravy radiací, což umožnilo lepší pochopení jejích příznaků a nebezpečí. Chirurg nemocnice Červeného kříže Dr. Terufumi Sasaki vedl intenzivní výzkum syndromu v týdnech a měsících následujících po bombových útocích na Hirošimu. Dr. Sasaki a jeho tým byli schopni sledovat účinky záření u pacientů v různé blízkosti samotného výbuchu, což vedlo k vytvoření tří zaznamenaných stádií syndromu. Během 25–30 dnů po výbuchu si chirurg Červeného kříže všiml prudkého poklesu počtu bílých krvinek a tento pokles spolu s příznaky horečky stanovil jako prognostické standardy pro syndrom akutního záření.[23] Herečka Midori Naka, který byl přítomen při atomovém bombardování Hirošimy, byl prvním případem otravy radiací, který byl rozsáhle studován. Její smrt 24. srpna 1945 byla vůbec první smrt, která byla oficiálně potvrzena v důsledku otravy radiací (neboli „atomová bomba“).
Oblasti zájmu
Interakce mezi organismy a elektromagnetickými poli (EMF) a ionizujícím zářením lze studovat mnoha způsoby:
- Fyzika záření
- Radiační chemie
- molekulární a buněčná biologie
- Molekulární genetika
- Buněčná smrt a apoptóza
- Vysoká a nízká úroveň elektromagnetické záření a zdraví
- Specifické míry absorpce organismů
- Radiační otrava
- Radiační onkologie (radiační terapie v rakovina )
- Bioelektromagnetika
- Elektrické pole a Magnetické pole - jejich obecná povaha.
- Elektrofyziologie - vědecké studium elektrických vlastností biologických buněk a tkání.
- Biomagnetismus - magnetické vlastnosti živých systémů (viz například výzkum David Cohen použitím OLIHEŇ zobrazování) a Magnetobiologie - studium účinku magnetů na živé systémy. Viz také Elektromagnetické záření a zdraví
- Bioelektromagnetismus - elektromagnetické vlastnosti živých systémů a Bioelektromagnetika - studium vlivu elektromagnetických polí na živé systémy.
- Elektroterapie
- Radiační terapie
- Radiogenomika
- Elektrokonvulzivní terapie
- Transkraniální magnetická stimulace - silný elektrický proud vytváří přechodné, prostorově zaměřené magnetické pole, které může proniknout do pokožky hlavy a lebky subjektu a vyvolat elektrickou aktivitu v neuronech na povrchu mozku.
- Magnetická rezonance - k získání 3D obrazu hustoty molekul vody v mozku se používá velmi silné magnetické pole, které odhaluje různé anatomické struktury. Související technika, funkční magnetická rezonance, odhaluje vzorec průtoku krve v mozku a může ukázat, které části mozku se podílejí na konkrétním úkolu.
- Embryogeneze, Ontogeny a Vývojová biologie - disciplína, která dala vzniknout mnoha vědním oborovým teoriím.
- Bioenergetika - studium energetické výměny na molekulární úrovni živých systémů.
- Biologická psychiatrie, Neurologie, Psychoneuroimunologie
- Bioluminiscence - výrazná fosforescence nalezená u hub, hlubinných tvorů atd., proti Biofoton - mnohem slabší elektromagnetické záření, myšlenka Alexander Gurwitsch, jeho objevitel, být formou signalizace.
Aktivita biologických a astronomických systémů nevyhnutelně generuje magnetická a elektrická pole, která lze měřit citlivými přístroji a která byla někdy navržena jako základ pro "esoterický "myšlenky na energii.
Zdroje záření pro experimentální radiobiologii
Radiobiologické experimenty obvykle využívají zdroj záření, kterým může být:
- An izotopový zdroj, typicky 137Čs nebo 60Spol.
- A urychlovač částic generování vysoké energie protony, elektrony nebo nabité ionty. Biologické vzorky lze ozařovat buď širokým, rovnoměrným paprskem,[24] nebo pomocí a mikrobeam, zaměřené na buněčné nebo subcelulární velikosti.
- A UV lampa.
Viz také
- Radiace na pozadí
- Biologické účinky záření na epigenom
- Křivka přežití buněk
- Ohrožení zdraví kosmickými paprsky
- Laboratoř kosmického záření NASA
- Nukleární medicína
- Radioaktivita v biologii
- Radiologie
- Radiofobie
- Radiosenzitivita
- Relativní biologická účinnost
Reference
- ^ ICRP 2007, str. 49, bod 55.
- ^ A b C Christensen DM, Iddins CJ, Sugarman SL (únor 2014). „Poranění a nemoci způsobené ionizujícím zářením“. Emerg Med Clin North Am. Elsevier. 32 (1): 245–65. doi:10.1016 / j.emc.2013.10.002. PMID 24275177.Poznámka: první stránka je k dispozici zdarma na adrese URL.
- ^ ICRP 2007, str. 55, odstavec 83.
- ^ „Způsobují CT vyšetření rakovinu?“. Harvard Health Publishing. Harvardská Univerzita. Březen 2013. Citováno 15. července 2020. Poznámka: První odstavec je poskytován zdarma.
- ^ Národní rada pro výzkum (2006). Zdravotní rizika z expozice nízkým úrovním ionizujícího záření: BEIR VII Fáze 2. Národní akademie věd. p. 10. doi:10.17226/11340. ISBN 978-0-309-09156-5. Citováno 11. listopadu 2013.
- ^ „Radiační expozice a kontaminace - zranění; otrava - Merck Manuals Professional Edition“. Příručka Merck Professional Edition. Citováno 6 zář 2017.
- ^ A b C d E F G „Pokyny pro diagnostické zobrazování během těhotenství a kojení“. Americký kongres porodníků a gynekologů. Únor 2016
- ^ Ronckers, Cécile M; Erdmann, Christine A; Land, Charles E (23. listopadu 2004). „Radiace a rakovina prsu: přehled současných důkazů“. Výzkum rakoviny prsu (Recenze článek.). BMC (Springer Nature). 7 (1): 21–32. doi:10.1186 / bcr970. ISSN 1465-542X. PMC 1064116. PMID 15642178.
- ^ ICRP 2007, str. 73, bod 144.
- ^ ICRP 2007, str. 24, glosář.
- ^ ICRP 2007, s. 61-62, body 104 a 105.
- ^ A b Není-li v rámečcích uvedeno jinak, je odkaz:
- „Radiační dávka při rentgenových a CT vyšetřeních“. RadiologyInfo.org podle Radiologická společnost Severní Ameriky. Citováno 23. října 2017. - ^ Brisbane, Wayne; Bailey, Michael R .; Sorensen, Mathew D. (2016). „Přehled zobrazovacích technik ledvinových kamenů“. Recenze přírody Urologie (Recenze článek). Springer Nature. 13 (11): 654–662. doi:10.1038 / nrurol.2016.154. ISSN 1759-4812. PMC 5443345.
- ^ Zhang, Zhuoli; Qi, Li; Meinel, Felix G .; Zhou, Chang Sheng; Zhao, Yan E .; Schoepf, U. Joseph; Zhang, Long Jiang; Lu, Guang Ming (2014). „Kvalita obrazu a radiační dávka CT angiografie dolní končetiny pomocí 70 kVp, vysoké akvizice a iterativní rekonstrukce potvrzená sinogramem“. PLOS ONE. 9 (6): e99112. doi:10.1371 / journal.pone.0099112. ISSN 1932-6203.
- ^ Wynn, Volkert; Hoffman, Timothy (1999). „Terapeutická radiofarmaka“. Chemické recenze (Recenze článek). Publikace ACS. 99 (9): 2269–92. doi:10.1021 / cr9804386. PMID 11749482.
- ^ Y. B. Kudriashov. Radiační biofyzika. ISBN 9781600212802. Stránka xxi.
- ^ Hall, E J (1. května 1976). „Radiace a jedna buňka: příspěvek fyzika k radiobiologii“. Fyzika v medicíně a biologii (Přednáška). IOP. 21 (3): 347–359. doi:10.1088/0031-9155/21/3/001. PMID 819945.
- ^ Lea, Douglas E. „Radiobiologie ve 40. letech 20. století“. Britský radiologický institut. Citováno 15. července 2020.
- ^ Lea, Douglasi (1955). Působení záření na živé buňky (2. vyd.). Cambridge: Cambridge University Press. ISBN 9781001281377.
- ^ Mitchell, J. S. (2. listopadu 1946). „Akce záření na živé buňky“. Příroda (Knižní recenze). 158 (4018): 601–602. Bibcode:1946Natur.158..601M. doi:10.1038 / 158601a0. PMC 1932419.
- ^ Grady, Denise (6. října 1998). „Záře ve tmě a lekce vědeckého nebezpečí“. The New York Times. Citováno 25. listopadu 2009.
- ^ Rowland, R.E. (1994). Radium in Humans: A Review of U.S. Studies. Argonne National Laboratory. OSTI 751062. Citováno 24. května 2012.
- ^ Carmichael, Ann G. (1991). Medicína: Pokladnice umění a literatury. New York: Harkavy Publishing Service. p. 376. ISBN 978-0-88363-991-7.
- ^ Pattison JE, Hugtenburg RP, Beddoe AH, Charles MW (2001). „Experimentální simulace spektra gama záření A-bomb pro radiobiologická studia“ (PDF). Dozimetrie radiační ochrany. Oxford Academic. 95 (2): 125–136. doi:10.1093 / oxfordjournals.rpd.a006532. PMID 11572640. S2CID 8711325.
Zdroje
- ICRP, 2007. Doporučení Mezinárodní komise pro radiační ochranu z roku 2007. Publikace ICRP 103. Ann. ICRP 37 (2-4).
Další čtení
- Eric Hall, Radiobiologie pro radiologa. 2006. Lippincott
- G. Gordon Steel, „Základní klinická radiobiologie“. 2002. Hodder Arnold.
- Institut pro radiační biologii v Helmholtzově centru pro zdraví životního prostředí [1]
