Kinetochore - Kinetochore

A kinetochore (/kɪˈnɛtək.r/, /-ˈniːtək.r/) je ve tvaru disku protein struktura spojená s duplikátem chromatidy v eukaryotický buňky, kde vlákna vřetena připojit během buněčné dělení vytáhnout sesterské chromatidy odděleně.[1] Kinetochore se sestavuje na centroméra a spojuje chromozom s mikrotubul polymery z mitotické vřeteno v době mitóza a redukční dělení buněk. Jeho proteiny také pomáhají držet sesterské chromatidy pohromadě a hrát v nich roli chromozóm úpravy.[2] Podrobnosti o konkrétních oblastech původu nejsou známy.
Monocentrické organismy, včetně obratlovců, hub a většiny rostlin, mají na každém chromozomu jednu centromerickou oblast, která sestavuje jediný lokalizovaný kinetochor. Holocentrické organismy, jako hlístice a některé rostliny sestavují kinetochor po celé délce chromozomu.[3]
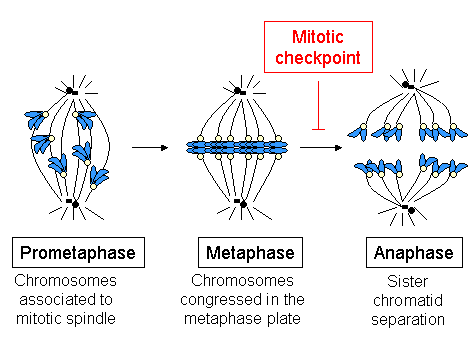
Kinetochory spouštějí, kontrolují a dohlížejí na nápadné pohyby chromozomů během dělení buněk. Během mitózy, ke které dochází po chromozomech duplikováno v S fáze, dvě sesterské chromatidy jsou drženy pohromadě centromérou. Každý chromatid má svůj vlastní kinetochor, který stojí v opačných směrech a připojuje se k opačným pólům mitotického vřetenového aparátu. Po přechodu z metafáze na anafáze, sesterské chromatidy se od sebe oddělují a jednotlivé kinetochory na každé chromatidě řídí jejich pohyb k pólům vřetena, které budou definovat dvě nové dceřiné buňky. Kinetochore je proto nezbytný pro segregaci chromozomů, která je klasicky spojena s mitózou a meiózou.
Struktura Kinetochore
Kinetochore obsahuje dvě oblasti:
- vnitřní kinetochor, který je úzce spojen s centromérou DNA a shromážděny ve specializované formě chromatinu, který přetrvává po celou dobu buněčný cyklus;
- vnější kinetochor, který interaguje s mikrotubuly; vnější kinetochor je velmi dynamická struktura s mnoha identickými komponentami, které jsou sestaveny a funkční pouze během buněčného dělení.
I ty nejjednodušší kinetochory se skládají z více než 19 různých proteinů. Mnoho z těchto proteinů je konzervováno mezi eukaryotickými druhy, včetně specializovaných histon Varianta H3 (tzv CENP-A nebo CenH3), který pomáhá kinetochore asociovat s DNA. Jiné proteiny v kinetochore ho adherují k mikrotubulům (MT) mitotické vřeteno. Jsou tu také motorické proteiny, včetně obou dynein a kinesin, které generují síly, které během mitózy pohybují chromozomy. Jiné proteiny, jako např Mad2, sledujte připojení mikrotubulů, stejně jako napětí mezi sesterskými kinetochory a aktivujte kontrolní bod vřetena zastavit buněčný cyklus, když některý z nich chybí.[4] Skutečná sada genů nezbytných pro funkci kinetochore se u jednotlivých druhů liší.[5][6]
Mezi funkce kinetochore patří ukotvení chromozomů k MT ve vřetenu, ověření ukotvení, aktivace kontrolního bodu vřetena a účast na generování síly k pohonu pohybu chromozomů během dělení buněk.[7] Na druhé straně jsou mikrotubuly metastabilní polymery vyrobené z α- a β-tubulin, střídavě rostoucí a smršťující se fáze, jev známý jako dynamická nestabilita.[8] MT jsou vysoce dynamické struktury, jejichž chování je integrováno s funkcí kinetochore pro řízení pohybu a segregace chromozomů. Rovněž bylo hlášeno, že organizace kinetochore se mezi mitózou a meiózou liší a integrita meiotického kinetochore je nezbytná pro specifické události meiózy, jako je párování homologních chromozomů, monitorientace sesterského kinetochore, ochrana centromerického kohezinu a soudržnost a duplikace těla vřetenového pólu.[9][10]
Ve zvířecích buňkách
Kinetochor se skládá z několika vrstev, které byly původně pozorovány konvenčními metodami fixace a barvení elektronová mikroskopie,[11][12] (přezkoumáno C. Riederem v roce 1982[13]) a v poslední době rychlým zmrazením a nahrazením.[14]

Nejhlubší vrstvou v kinetochoru je vnitřní deska, který je organizován na struktuře chromatinu obsahující nukleosomy prezentace specializovaného histon (pojmenováno CENP-A, který nahrazuje histon H3 v této oblasti), pomocné proteiny a DNA. Organizace DNA v centroméra (satelitní DNA ) je jedním z nejméně pochopených aspektů kinetochorů obratlovců. Vnitřní deska vypadá jako diskrétní heterochromatin doména v celé doméně buněčný cyklus.
Vnější k vnitřní desce je vnější deska, který je složen převážně z bílkovin. Tato struktura je sestavena na povrchu chromozomů až po jaderný obal se porouchá.[11] Vnější deska v kinetochorech obratlovců obsahuje asi 20 kotevních míst pro konce MTs (+) (pojmenované kMT, po kinetochore MT), zatímco vnější deska kinetochore v kvasnicích (Saccharomyces cerevisiae ) obsahuje pouze jedno kotvící místo.
Nejvzdálenější doména v kinetochore tvoří vláknitou korónu, kterou lze konvenčně vizualizovat mikroskopie, ale pouze při absenci MT. Tato koróna je tvořena dynamickou sítí rezidentních a dočasných proteinů zapojených do kontrolní bod vřetena, v ukotvení mikrotubulů a v regulaci chování chromozomů.
Během mitózy každý sestra chromatid formování kompletního chromozomu má svůj vlastní kinetochor. Zřetelné sesterské kinetochory lze pozorovat nejprve na konci roku Fáze G2 v kultivovaných savčích buňkách.[15] Tyto rané kinetochory vykazují zralou laminární strukturu před rozpadem jaderného obalu.[16] Molekulární dráha pro sestavení kinetochore ve vyšších eukaryoty byl studován pomocí genové knockouty u myší a v kultivovaných kuřecích buňkách, stejně jako při použití Interference RNA (RNAi) v C. elegans, Drosophila a lidské buňky, zatím žádná jednoduchá lineární cesta nemůže popsat dosud získaná data.[Citace je zapotřebí ]
První protein sestavený na kinetochore je CENP-A (CSE4 v Saccharomyces cerevisiae). Tento protein je specializovaný izoforma z histon H3.[17] CENP-A je vyžadován pro začlenění proteinů vnitřního kinetochore CENP-C, CENP-H a CENP-I / MIS6.[18][19][20][21][22] Vztah těchto proteinů v cestě závislé na CENP-A není zcela definován. Například lokalizace CENP-C vyžaduje CENP-H v kuřecích buňkách, ale je nezávislá na CENP-I / MIS6 v lidských buňkách. v C. elegans a metazoa, začlenění mnoha proteinů do vnějšího kinetochore závisí nakonec na CENP-A.
Kinetochorové proteiny lze seskupit podle jejich koncentrace v kinetochorech během mitózy: některé proteiny zůstávají vázány během buněčného dělení, zatímco jiné se mění v koncentraci. Dále mohou být recyklovány ve svém vazebném místě na kinetochorech buď pomalu (jsou spíše stabilní) nebo rychle (dynamicky).
- Proteiny, jejichž hladiny zůstávají stabilní od profáze až do pozdní anafáze zahrnují konstitutivní složky vnitřní desky a stabilní složky vnějšího kinetocore, jako je Ndc80 komplex,[23][24] Proteiny KNL / KBP (kinetochore-null/Protein vázající KNL),[25] MIS proteiny[25] a CENP-F.[26][27] Spolu s konstitutivními složkami se zdá, že tyto proteiny organizují jaderné jádro vnitřní a vnější struktury v kinetochore.
- Dynamické složky, které se během mitózy liší v koncentraci na kinetochorech, zahrnují molekulární motory CENP-E a dynein (stejně jako jejich cílové komponenty ZW10 a ROD) a kontrolní bod vřetena bílkoviny (např Mad1, Mad2, BubR1 a CDC20 ). Tyto proteiny se shromažďují na kinetochore ve vysokých koncentracích v nepřítomnosti mikrotubulů; čím vyšší je však počet MT ukotvených na kinetochore, tím nižší jsou koncentrace těchto proteinů.[28] Na metafázi se hladiny CENP-E, Bub3 a Bub1 snižují přibližně o tři až čtyři ve srovnání s volnými kinetochory, zatímco hladiny dyneinu / dynaktinu, Mad1, Mad2 a BubR1 se snižují o více než 10 až 100.[28][29][30][31]
- Zatímco hladiny proteinu kontrolního bodu vřetena přítomné ve vnější destičce se snižují jako kotva MTs,[31] další komponenty jako EB1, APC a bílkoviny v Běžel cesta (RanGap1 a RanBP2 ) přidružte se ke kinetochorům pouze při ukotvení MT.[32][33][34][35] To může patřit k mechanismu v kinetochore rozpoznávat plus-end (+) mikrotubulů, zajišťující jejich správné ukotvení a regulující jejich dynamické chování, když zůstávají ukotveny.
Studie z roku 2010 použila komplexní metodu (nazvanou „multiklasifikátorová kombinatorická proteomika“ nebo MCCP) k analýze proteomický složení chromozomů obratlovců, včetně kinetochorů.[36] Ačkoli tato studie nezahrnuje biochemické obohacení kinetochorů, získaná data zahrnují všechny centromerické subkomplexy s peptidy ze všech 125 známých centromerických proteinů. Podle této studie stále existuje asi sto neznámých proteinů kinetochore, což zdvojnásobuje známou strukturu během mitózy, což potvrzuje kinetochore jako jednu z nejsložitějších buněčných substruktur. Komplexní průzkum literatury důsledně naznačoval, že v kinetochorech již bylo experimentálně prokázáno, že je lokalizováno nejméně 196 lidských proteinů.[37]
Funkce
Počet mikrotubulů připojených k jednomu kinetochoru je variabilní: in Saccharomyces cerevisiae na každý kinetochore se váže pouze jeden MT, zatímco u savců může být na každý kinetochore vázáno 15–35 MT.[38] Ne všechny MT ve vřetenu se však připojí k jednomu kinetochoru. Existují MT, které sahají od jednoho centrosome do druhého (a jsou zodpovědní za délku vřetena) a některé kratší jsou interdigitovány mezi dlouhými MT. Profesor B. Nicklas (Duke University) ukázal, že pokud člověk rozbije přílohu MT-kinetochore pomocí a laserový paprsek chromatidy se již nemohou pohybovat, což vede k abnormální distribuci chromozomů.[39] Tyto experimenty také ukázaly, že kinetochory mají polaritu a že připojení kinetochorů k MT vycházejícím z jednoho nebo druhého centrosomu bude záviset na jeho orientaci. Tato specificita zaručuje, že se na každou stranu vřetena bude pohybovat pouze jeden chromatid, čímž se zajistí správná distribuce genetického materiálu. Jednou ze základních funkcí kinetochore je tedy připojení MT k vřetenu, které je nezbytné pro správnou segregaci sesterských chromatidů. Pokud je ukotvení nesprávné, mohou nastat chyby, které se generují aneuploidie, s katastrofickými důsledky pro buňku. Aby se tomu zabránilo, existují mechanismy detekce a opravy chyb (jako kontrolní bod sestavy vřetena ), jehož složky se nacházejí také na kinetochorech. Pohyb jedné chromatidy směrem k centrozomu je způsoben primárně MT depolymerací ve vazebném místě s kinetochorem. Tyto pohyby vyžadují také generování síly, zahrnující molekulární motory rovněž umístěné na kinetochorech.
Ukotvení chromozomu k MT v mitotickém vřetenu
Zachycení MT
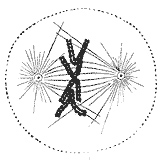
Během fáze syntézy (fáze S) v buněčný cyklus, centrosome začne duplikovat. Jen na začátku mitózy centrioly v každém centrosomu dosáhnou své maximální délky, centrosomy získají další materiál a svou nukleační kapacitu pro mikrotubuly zvyšuje. Jak mitóza postupuje, oba centrosomy se oddělují a vytvářejí mitotické vřeteno.[40] Tímto způsobem má vřeteno v mitotické buňce dva póly vycházející z mikrotubulů. Mikrotubuly jsou dlouhá proteická vlákna s asymetrickými extrémy, "minus" (-) konec relativně stabilní vedle centrosomu a "plus" (+) konec, který snáší střídavé fáze růstu a zmenšování, zkoumání středu buňky. Během tohoto procesu hledání se může mikrotubul setkat a zachytit chromozom kinetochórem.[41][42] Mikrotubuly, které nacházejí a připojují kinetochore, se stabilizují, zatímco ty mikrotubuly, které zůstávají volné, se rychle depolymerizují.[43] Jelikož chromozomy mají dva kinetochory spojené back-to-back (jeden na každé sesterské chromatidě), když se jeden z nich připojí k mikrotubulům generovaným jedním z buněčných pólů, kinetochore na sesterské chromatidě se vystaví protilehlému pólu; z tohoto důvodu se většinou druhý kinetochor připojí k mikrotubulům vycházejícím z protilehlého pólu,[44] takovým způsobem, že chromozomy jsou nyní bi-orientovaný, jedna základní konfigurace (nazývaná také amfitelický) k zajištění správné segregace obou chromatidů, když se buňka rozdělí.[45][46]
Když je k jednomu kinetochoru ukotven pouze jeden mikrotubul, zahájí to rychlý pohyb asociovaného chromozomu směrem k pólu, který generuje tento mikrotubul. Tento pohyb je pravděpodobně zprostředkován motorickou aktivitou směrem k „minusu“ (-) motorický protein cytoplazmatický dynein,[47][48] který je velmi koncentrovaný v kinetochorech, které nejsou ukotveny k MT.[49] Pohyb směrem k pólu je zpomalen, pokud kinetochory získají kMT (MT ukotvené ke kinetochorům) a pohyb bude směrován změnami délky kMTs. Dynein se uvolňuje z kinetochorů při získávání kMT[28] a v kultivovaných savčích buňkách je to nutné pro kontrolní bod vřetena inaktivace, ale ne pro kongres chromozomů na vřetenovém rovníku, získání kMT nebo anafáze A během segregace chromozomů.[50] Ve vyšších rostlinách nebo v kvasnicích nejsou žádné důkazy o dyneinu, ale o jiných kinesiny ke konci (-) může kompenzovat nedostatek dyneinu.

Další motorický protein podílející se na počátečním zachycení MT je CENP-E; jedná se o vysokou molekulovou hmotnost kinesin spojené s vláknitou koronou u savčích kinetochorů od prometafáze do anafáze.[51] V buňkách s nízkou hladinou CENP-E chybí chromozomy tento protein na svých kinetochorech, které jsou často defektní v jejich schopnosti kongresu na metafázové desce. V tomto případě mohou některé chromozomy zůstat chronicky monoorientované (ukotvené pouze na jednom pólu), ačkoli většina chromozomů může na metafázové desce kongresovat správně.[52]
Je všeobecně přijímáno, že vlákno kMTs (svazek mikrotubulů navázaných na kinetochore) pochází ze zachycení MT polymerovaných na centrosomy a vřetenové póly v savčích kultivovaných buňkách.[41] MT však mohou přímo polymerovat na kinetochorech také významně přispět.[53] Způsob, jakým centromerická oblast nebo kinetochore iniciuje vznik kMT a frekvence, s jakou se to děje, jsou důležité otázky,[podle koho? ] protože tento mechanismus může přispívat nejen k počáteční tvorbě kMT, ale také ke způsobu, jakým kinetochory opravují vadné ukotvení MT a regulují pohyb podél kMT.
Role komplexu Ndc80
MT spojené s kinetochory mají speciální vlastnosti: ve srovnání s volnými MT jsou kMT mnohem odolnější vůči depolymerizaci vyvolané chladem, vysokým hydrostatickým tlakům nebo vystavení vápníku.[54] Kromě toho se kMT recyklují mnohem pomaleji než astrální MT a vřetenové MT s volnými (+) konci a pokud se kMT uvolňují z kinetochore pomocí laserového paprsku, rychle depolymerují.[39]
Když bylo jasné, že ani dynein, ani CENP-E nejsou nezbytné pro tvorbu kMT, měly by být za stabilizaci kMT odpovědné další molekuly. Genetická práce Pioneer v kvasinkách odhalila význam komplexu Ndc80 při ukotvení kMT.[23][55][56][57] v Saccharomyces cerevisiae, komplex Ndc80 má čtyři komponenty: Ndc80p, Nuf2p, Spc24p a Spc25p. Mutanti postrádající jakoukoli ze složek tohoto komplexu vykazují ztrátu spojení kinetochore-mikrotubuly, i když struktura kinetochore není zcela ztracena.[23][55] Přesto mutanty, ve kterých je ztracena struktura kinetochore (například mutanty Ndc10 v kvasinkách[58]) mají nedostatek jak ve spojení s mikrotubuly, tak ve schopnosti aktivovat kontrolní bod vřetena, pravděpodobně proto, že kinetochory fungují jako platforma, ve které jsou sestaveny komponenty odezvy.
Komplex Ndc80 je vysoce konzervovaný a byl identifikován v S. pombe, C. elegans, Xenopus, kuře a lidé.[23][24][55][59][60][61][62] Studie na Hec1 (vysoce exprimován v rakovinných buňkách 1), lidský homolog Ndc80p, ukazuje, že je důležitý pro správnou kongres chromozomu a mitotickou progresi a že interaguje se složkami kohesin a kondenzin komplexy.[63]
Různé laboratoře ukázaly, že komplex Ndc80 je nezbytný pro stabilizaci ukotvení kinetochore-mikrotubulů, které jsou potřebné k podpoře centromerického napětí, které se podílí na vytvoření správné chromosomové kongresu při vysokých eukaryoty.[24][60][61][62] Buňky se sníženou funkcí Ndc80 (s použitím RNAi, genový knockout nebo protilátka mikroinjekce) mají abnormálně dlouhá vřetena, nedostatek napětí mezi sesterskými kinetochory, chromozomy neschopné shromažďovat se na metafázové desce a málo nebo jakékoli související kMT.
Existuje celá řada silné podpory schopnosti komplexu Ndc80 přímo se sdružovat s mikrotubuly a tvořit jádrově konzervovanou složku rozhraní kinetochore-mikrotubuly.[64] Tvorba robustních interakcí kinetochore-mikrotubuly však může také vyžadovat funkci dalších proteinů. U kvasinek vyžaduje toto spojení přítomnost komplexu Dam1 -DASH-DDD. Někteří členové tohoto komplexu se vážou přímo na MT, zatímco jiní se vážou na komplex Ndc80.[56][57][65] To znamená, že komplex Dam1-DASH-DDD může být nezbytným adaptérem mezi kinetochory a mikrotubuly. U zvířat však nebyl identifikován ekvivalentní komplex a tato otázka zůstává pod intenzivním vyšetřováním.
Ověření ukotvení kinetochore – MT
V době S-fáze, buňka duplikuje všechny genetické informace uložené v chromozomech, v procesu nazvaném replikace DNA. Na konci tohoto procesu každý chromozóm zahrnuje dvě sestry chromatidy, což jsou dvě úplné a identické molekuly DNA. Obě chromatidy zůstávají spojeny s kohesin komplexy až do anafáze, kdy dojde k segregaci chromozomů. Pokud dojde k segregaci chromozomů správně, obdrží každá dceřinná buňka kompletní sadu chromatidů a aby se tak stalo, musí každá sesterská chromatid ukotvit (prostřednictvím odpovídajícího kinetochoru) na MT generované v protilehlých pólech mitotického vřetena. Tato konfigurace se nazývá amfitelický nebo bi-orientace.
Během procesu ukotvení se však mohou objevit i některé nesprávné konfigurace:[66]

- monotelic: pouze jedna z chromatid je ukotvena k MT, druhý kinetochore není ukotven; v této situaci není centromerické napětí a kontrolní bod vřetena je aktivován, zpožďuje vstup do anafáze a poskytuje buňce čas na opravu chyby. Pokud to není opraveno, neukotvený chromatid může náhodně skončit v kterékoli ze dvou dceřiných buněk a generovat se aneuploidie: jedna dceřiná buňka by měla přebytek chromozomů a druhé by chyběly některé chromozomy.
- syntelický: oba chromatidy jsou ukotveny k MT vycházejícím ze stejného pólu; ani tato situace negeneruje centromerické napětí a aktivuje se kontrolní bod vřetena. Pokud to není opraveno, oba chromatidy skončí ve stejné dceřiné buňce a vytvoří aneuploidii.
- merotelic: alespoň jeden chromatid je ukotven současně k MT vycházejícím z obou pólů. Tato situace generuje centromerické napětí az tohoto důvodu není kontrolní bod vřetena aktivován. Pokud to není opraveno, chromatid navázaný na oba póly zůstane jako zaostávající chromozom na anafázi a nakonec bude rozbit na dva fragmenty, distribuované mezi dceřinými buňkami, generující aneuploidii.
Monotelická i syntelická konfigurace nedokážou generovat centromerické napětí a jsou detekovány kontrolním bodem vřetena. Naproti tomu tento řídicí mechanismus nedetekuje merotelickou konfiguraci. Většina z těchto chyb je však detekována a opravena před vstupem buňky do anafáze.[66] Klíčovým faktorem při opravě těchto chyb při ukotvení je chromozomální komplex cestujících, který zahrnuje kináza protein Aurora B, jeho cílová a aktivační podjednotka INCENP a další dvě podjednotky, Survivin a Borealin / Dasra B (přezkoumáno Adamsem a spolupracovníky v roce 2001[67]). Buňky, ve kterých byla funkce tohoto komplexu zrušena dominantní negativní mutanti, RNAi, protilátka mikroinjekcí nebo použitím selektivních léků se hromadí chyby v ukotvení chromozomů. Mnoho studií ukázalo, že Aurora B je nutná k destabilizaci nesprávného ukotvení kinetochore-MT, což upřednostňuje generování amfitelických spojení. Homolog Aurora B v kvasinkách (Ipl1p) fosforiluje některé kinetochoreové proteiny, jako je konstitutivní protein Ndc10p a členové komplexů Ndc80 a Dam1-DASH-DDD.[68] Fosforylace komplexních složek Ndc80 vede k destabilizaci kotvení kMTs. Bylo navrženo, že lokalizace Aurora B je důležitá pro svou funkci: protože se nachází ve vnitřní oblasti kinetochore (v centromerickém heterochromatinu), když je stanoveno centromerické napětí, sesterské kinetochory se oddělují a Aurora B nemůže dosáhnout svých substrátů, takže kMT jsou stabilizované. Aurora B je často nadměrně exprimována u několika typů rakoviny a v současné době je cílem vývoje protinádorových léků.[69]
Aktivace kontrolního bodu vřetena
Kontrolní bod vřetena nebo SAC (pro kontrolní bod sestavy vřetena), také známý jako mitotický kontrolní bod, je buněčný mechanismus odpovědný za detekci:
- správná montáž mitotického vřetene;
- připojení všech chromozomů k mitotickému vřetenu bipolárním způsobem;
- regrese všech chromozomů na metafázové desce.
Když během kongresu zůstane jen jeden chromozom (z jakéhokoli důvodu) zaostávající, strojní zařízení vřetenového kontrolního bodu generuje zpoždění v postupu buněčného cyklu: buňka je zatčena, což poskytuje čas mechanismům opravy k vyřešení zjištěného problému. Po nějaké době, pokud problém nebude vyřešen, bude buňka zaměřena apoptóza (programovaná buněčná smrt), bezpečnostní mechanismus, který zabrání tvorbě aneuploidie, situace, která má obecně dramatické důsledky pro organismus.
Zatímco strukturní centromerické proteiny (např CENP-B ), zůstávají stabilně lokalizovány během mitózy (včetně během telofáze ), komponenty vřetenového kontrolního bodu jsou sestaveny na kinetochore ve vysokých koncentracích v nepřítomnosti mikrotubulů a jejich koncentrace se snižují se zvyšujícím se počtem mikrotubulů připojených k kinetochore.[28]
V metafázi CENP-E, Bub3 a Bub1 hladiny se snižují 3 až 4krát ve srovnání s hladinami v nepřipojených kinetochorech, zatímco hladiny dynein / dynaktin, Mad1, Mad2 a BubR1 pokles> 10–100krát.[28][29][30][31] Takže v metafázi, když jsou všechny chromozomy zarovnány na metafázové desce, jsou všechny proteiny kontrolního bodu uvolněny z kinetochoru. Zmizení proteinů kontrolního bodu z kinetochorů naznačuje okamžik, kdy chromozom dosáhl metafázové desky a je pod bipolárním napětím. V tuto chvíli se proteiny kontrolního bodu váží na a inhibují CDC20 (Mad1-Mad2 a BubR1), uvolněte Cdc20, který se váže a aktivuje APC / CCDC20, a tento komplex spouští separaci sesterských chromatid a následně vstup anafáze.
Několik studií naznačuje, že komplex Ndc80 se podílí na regulaci stabilní asociace Mad1-Mad2 a dyneinu s kinetochory.[24][61][62] Přesto proteiny CENP-A, CENP-C, CENP-E, CENP-H a BubR1 spojené s kinetochory jsou nezávislé na Ndc80 / Hec1. Prodloužené zadržení prometafáze pozorované v buňkách s nízkou hladinou Ndc80 / Hec1 závisí na Mad2, i když tyto buňky vykazují nízké hladiny Mad1, Mad2 a dyneinu na kinetochorech (<10–15% ve vztahu k nepřipojeným kinetochorům). Pokud jsou však úrovně Ndc80 / Hec1 a Nuf2 sníženy, Mad1 a Mad2 úplně zmizí z kinetochore a kontrolní bod vřetena je deaktivován.[70]
Shugoshin (Sgo1, MEI-S332 v Drosophila melanogaster[71]) jsou centromerické proteiny, které jsou nezbytné k udržení kohesin vázán na centromery až do anafáze. Lidský homolog, hsSgo1, se během profáze spojuje s centromery a zmizí, když začne anafáze.[72] Když jsou hladiny Shugoshin sníženy o RNAi v HeLa buňky, cohesin nemůže zůstat na centromerech během mitózy a následně se sesterské chromatidy synchronizují synchronně před zahájením anafáze, což spustí dlouhou mitotickou zástavu.
Na druhou stranu Dasso a spolupracovníci zjistili, že bílkoviny podílející se na Běžel cyklus lze detekovat na kinetochorech během mitózy: RanGAP1 (protein aktivující GTPázu, který stimuluje přeměnu Ran-GTP na Ran-GDP) a protein vázající Ran zvaný RanBP2 / Nup358.[73] Během mezifáze jsou tyto proteiny umístěny na jaderné póry a podílet se na nukleo-cytoplazmatickém transportu. Kinetochoreová lokalizace těchto proteinů se jeví jako funkčně významná, protože některá ošetření, která zvyšují hladiny Ran-GTP, inhibují kinetochorové uvolňování Bub1, Bub3, Mad2 a CENP-E.[74]
Orc2 (protein, který patří do komplex rozpoznávání původu -ORC- zapojen do replikace DNA zahájení během S fáze ) je také lokalizován na kinetochorech během mitózy v lidských buňkách;[75] v souladu s touto lokalizací některé studie naznačují, že Orc2 v kvasinkách je zapojen do soudržnosti sesterských chromatid, a když je vylučován z buňky, kontrolní bod vřetena následuje aktivace.[76] Některé další komponenty ORC (například orc5 v S. pombe) bylo rovněž zjištěno, že se účastní soudržnosti.[77] Zdá se však, že proteiny ORC se účastní molekulární dráhy, která je aditivní kohesin cesta, a to je většinou neznámé.
Generování síly k pohonu pohybu chromozomů
Většina pohybů chromozomů ve vztahu k pólům vřetena je spojena s prodloužením a zkrácením kMT. Jeden z nejzajímavějších[podle koho? ] Charakteristikou kinetochorů je jejich schopnost modifikovat stav jejich přidružených kMT (kolem 20) z depolymerizačního stavu na jejich (+) konci do polymeračního stavu. To umožňuje kinetochorům z buněk na prometafázi ukázat „směrovou nestabilitu“,[78] změna mezi perzistentními fázemi pohybu směrem k pólu (směrem k pólu) nebo inverzní (proti pólu), které jsou spojeny se střídavými stavy depolymerizace kMTs a polymerace. Tato bistabilita kinetochorů se jeví jako součást mechanismu k vyrovnání chromozomů na rovníku vřetena, aniž by došlo ke ztrátě mechanického spojení mezi kinetochory a póly vřetena. Předpokládá se, že bistabilita kinetochore je založena na dynamické nestabilitě konce kMTs (+) a je částečně řízena napětím přítomným v kinetochore. V savčích kultivovaných buňkách nízké napětí na kinetochorech podporuje změnu směrem k depolymerizaci kMTs a vysoké napětí podporuje změnu směrem k polymeraci kMTs.[79][80]
Kinetochoreové proteiny a proteiny vázající se na MTs (+) konec (souhrnně označované jako + TIP) regulují pohyb kinetochore prostřednictvím regulace dynamiky konce kMTs (+).[81] Rozhraní kinetochore-mikrotubuly je však vysoce dynamické a některé z těchto proteinů se zdají být v dobré víře komponenty obou struktur. Obzvláště důležité se zdají být dvě skupiny proteinů: kinesiny které fungují jako depolymerázy, jako například KinI kinesiny; a proteiny vázané na MT (+) konce, + TIP, podporující polymeraci, možná antagonizující účinek depolymeráz.[82]
- KinI kinesiny jsou pojmenovány „I“, protože představují vnitřní motorickou doménu, která využívá ATP k podpoře depolymerace tubulinového polymeru, mikrotubulu. U obratlovců je nejdůležitějším kinesinem KinI řídícím dynamiku (+) koncové sestavy MCAK.[83] Zdá se však, že existují i jiné kinesiny.
- Existují dvě skupiny + TIP s funkcemi kinetochore.
- První obsahuje protein adenomatous polypóza coli (APC) a související protein EB1, které potřebují MT k lokalizaci na kinetochorech. Oba proteiny jsou vyžadovány pro správnou segregaci chromozomů.[84] EB1 se váže pouze na MT v polymeračním stavu, což naznačuje, že podporuje stabilizaci kMT během této fáze.
- Druhá skupina + TIP zahrnuje proteiny, které se mohou lokalizovat na kinetochory i v nepřítomnosti MT. V této skupině existují dva proteiny, které byly široce studovány: CLIP-170 a jejich přidružené proteiny CLASPs (Proteiny spojené s CLIP). Role CLIP-170 u kinetochorů není známa, ale exprese dominantního negativního mutanta vyvolává zpoždění prometafáze,[85] což naznačuje, že má aktivní roli ve srovnání chromozomů. CLASP proteiny jsou vyžadovány pro zarovnání chromozomů a údržbu bipolárního vřetene Drosophila, lidé a droždí.[86][87]
Reference
- ^ Santaguida, Stefano; Musacchio, Andrea (02.09.2009). „Život a zázraky kinetochorů“. Časopis EMBO. 28 (17): 2511–2531. doi:10.1038 / emboj.2009.173. ISSN 1460-2075. PMC 2722247. PMID 19629042.
- ^ Brooker, Robert J. (2016). Koncepty genetiky. New York: McGraw Hill Education.
- ^ Albertson, D.G .; Thomson, J.N. (1993), „Segregace holocentrických chromozomů při meióze u hlístice, Caenorhabditis elegans“, Chromozomový výzkum, 1 (1): 15–26, doi:10.1007 / BF00710603, PMID 8143084
- ^ Peter De Wulf, William C. Earnshaw, Kinetochore: Od molekulárních objevů k léčbě rakoviny
- ^ van Hooff, Jolien Je Tromer, Eelco van Wijk, Leny M. Snel, Berend Kops, Geert Jpl (září 2017). Evoluční dynamika sítě kinetochore u eukaryot, jak ji odhalila srovnávací genomika. Nature Publishing Group. OCLC 1130165006.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Vijay, Nagarjun (2020-09-29). „Ztráta vnitřních kinetochorových genů je spojena s přechodem na netradiční bodové centromery v nadějných kvasinkách“. PeerJ. 8: e10085. doi:10,7717 / peerj.10085. ISSN 2167-8359.
- ^ A b Maiato, H .; Deluca, J .; Salmon, E.D .; Earnshaw, W.C. (2004), „Dynamické rozhraní kinetochore-mikrotubuly“, Journal of Cell Science, 117 (22): 5461–5477, doi:10.1242 / jcs.01536, PMID 15509863
- ^ Mitchison, T .; Kirschner, M. (1984), „Dynamická nestabilita růstu mikrotubulů“ (PDF), Příroda, 312 (5991): 237–242, doi:10.1038 / 312237a0, PMID 6504138, archivovány z originál (PDF) dne 22.06.2010, vyvoláno 2010-08-23
- ^ Mehta, G.D .; Agarwal, M .; Ghosh, S.K. (2014), „Functional characterization of kinetochore protein, Ctf19 in meiosis I: an implication of different impact of Ctf19 on the assembly of mitotic and meiotic kinetochores in Saccharomyces cerevisiae“, Molekulární mikrobiologie, 91 (6): 1179–1199, doi:10,1111 / mmi.12527, PMID 24446862
- ^ Agarwal, Meenakshi; Mehta, Gunjan; Ghosh, Santanu K. (01.03.2015). „Role subkomplexů Ctf3 a COMA v meióze: implikace v udržování Cse4 na centromerech a numerických pólech vřetena“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1853 (3): 671–684. doi:10.1016 / j.bbamcr.2014.12.032. ISSN 0167-4889. PMID 25562757.
- ^ A b Brinkley, B.R .; Stubblefield, E. (1966), „Jemná struktura kinetochore savčí buňky in vitro“, Chromozom, 19 (1): 28–43, doi:10.1007 / BF00332792, PMID 5912064
- ^ Jokelainen, P.T. (1967), „Ultrastruktura a prostorová organizace metafázového kinetochore v mitotických krysích buňkách“, J Ultrastruct Res, 19 (1): 19–44, doi:10.1016 / S0022-5320 (67) 80058-3, PMID 5339062
- ^ Rieder, C.L. (1982), "Tvorba, struktura a složení savčího kinetochore a kinetochorového vlákna", Int Rev Cytol, Mezinárodní přehled cytologie, 79: 1–58, doi:10.1016 / S0074-7696 (08) 61672-1, ISBN 978-0-12-364479-4, PMID 6185450
- ^ McEwen, B.F .; Hsieh, C.E .; Mattheyses, A.L .; Rieder, C.L. (1998), „Nový pohled na kinetochorovou strukturu v somatických buňkách obratlovců pomocí vysokotlakého zmrazování a substituce zmrazením“, Chromozom, 107 (6): 366–375, doi:10.1007 / s004120050320, PMC 2905855, PMID 9914368
- ^ Brenner, S .; Pepper, D .; Berns, M.W .; Tan, E .; Brinkley, B.R. (1981), „Struktura, duplikace a distribuce kinetochorů v savčích buňkách: analýza lidskými autoprotilátkami od pacientů se sklerodermií“, The Journal of Cell Biology, 91 (1): 95–102, doi:10.1083 / jcb.91.1.95, PMC 2111947, PMID 7298727
- ^ Pluta, A.F .; MacKay, A.M .; Ainsztein, A.M .; Goldberg, I.G .; Earnshaw, W.C. (1995), „The Centromere: Hub of Chromosomal Activities“, Věda, 270 (5242): 1591–4, doi:10.1126 / science.270.5242.1591, PMID 7502067
- ^ Palmer, D.K .; O'Day, K .; Trong, HL; Charbonneau, H .; Margolis, R.L. (1991), „Čištění proteinu specifického pro centromery CENP-A a demonstrace, že se jedná o výrazný histon“, Sborník Národní akademie věd, 88 (9): 3734–3738, doi:10.1073 / pnas.88.9.3734, PMC 51527, PMID 2023923
- ^ Howman, E.V .; Fowler, K.J .; Newson, A.J .; Redward, S .; MacDonald, A.C .; Kalitsis, P .; Choo, K.H.A. (2000), „Early disruption of centromeric chromatin organization in centromere protein A (Cenpa) null myši“, Sborník Národní akademie věd, 97 (3): 1148–1153, doi:10.1073 / pnas.97.3.1148, PMC 15551, PMID 10655499
- ^ Oegema, K .; Desai, A .; Rybina, S .; Kirkham, M .; Hyman, A.A. (2001), „Functional Analysis of Kinetochore Assembly in Caenorhabditis elegans“, The Journal of Cell Biology, 153 (6): 1209–1226, doi:10.1083 / jcb.153.6.1209, PMC 2192036, PMID 11402065
- ^ Van Hooser, A.A .; Ouspenski, I.I .; Gregson, H.C .; Starr, D.A .; Yen, T.J .; Goldberg, M.L .; Yokomori, K .; Earnshaw, W.C .; Sullivan, K.F. (2001), "Specification of kinetochore-forming chromatin by the histone H3 variant CENP-A", Journal of Cell Science, 114 (19): 3529–3542, PMID 11682612
- ^ Fukagawa, T.; Mikami, Y.; Nishihashi, A.; Regnier, V.; Haraguchi, T.; Hiraoka, Y.; Sugata, N.; Todokoro, K.; Brown, W. (2001), "CENP-H, a constitutive centromere component, is required for centromere targeting of CENP-C in vertebrate cells", Časopis EMBO, 20 (16): 4603–4617, doi:10.1093/emboj/20.16.4603, PMC 125570, PMID 11500386
- ^ Goshima, G.; Kiyomitsu, T.; Yoda, K.; Yanagida, M. (2003), "Human centromere chromatin protein hMis12, essential for equal segregation, is independent of CENP-A loading pathway", The Journal of Cell Biology, 160 (1): 25–39, doi:10.1083/jcb.200210005, PMC 2172742, PMID 12515822
- ^ A b C d Wigge, Philip A.; Kilmartin, John V. (2001), "The Ndc80p Complex from Saccharomyces cerevisiae Contains Conserved Centromere Components and Has a Function in Chromosome Segregation", The Journal of Cell Biology, 152 (2): 349–360, doi:10.1083 / jcb.152.2.349, PMC 2199619, PMID 11266451
- ^ A b C d Deluca, J.G.; Moree, B.; Hickey, J.M.; Kilmartin, J.V.; Salmon, E.D. (2002), "hNuf2 inhibition blocks stable kinetochore–microtubule attachment and induces mitotic cell death in HeLa cells", The Journal of Cell Biology, 159 (4): 549–555, doi:10.1083 / jcb.200208159, PMC 2173110, PMID 12438418
- ^ A b Cheeseman, I.M.; Niessen, S.; Anderson, S .; Hyndman, F.; Yates, J.R.; Oegema, K.; Desai, A. (2004), "A conserved protein network controls assembly of the outer kinetochore and its ability to sustain tension", Geny a vývoj, 18 (18): 2255–2268, doi:10.1101 / gad.1234104, PMC 517519, PMID 15371340
- ^ Rattner, J.B.; Rao, A.; Fritzler, M.J.; Valencia, D.W.; Yen, T.J. (1993), "CENP-F is a. Ca 400 kDa kinetochore protein that exhibits a cell-cycle dependent localization", Cell Motil Cytoskeleton, 26 (3): 214–26, doi:10.1002/cm.970260305, PMID 7904902
- ^ Liao, H .; Winkfein, RJ; Mack, G; Rattner, JB; Yen, TJ (1995), "CENP-F is a protein of the nuclear matrix that assembles onto kinetochores at late G2 and is rapidly degraded after mitosis", The Journal of Cell Biology, 130 (3): 507–518, doi:10.1083/jcb.130.3.507, PMC 2120529, PMID 7542657
- ^ A b C d E Hoffman, DB; Hoffman, D.B.; Pearson, C.G.; Yen, T.J.; Howell, B.J.; Salmon, E.D. (2001), "Microtubule-dependent changes in assembly of microtubule motor proteins and mitotic spindle checkpoint proteins at PtK1 kinetochores", Molekulární biologie buňky, 12 (7): 1995–2009, doi:10.1091/mbc.12.7.1995, PMC 55648, PMID 11451998
- ^ A b King, S.M. (2000), "The dynein microtubule motor", Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk, 1496 (1): 60–75, doi:10.1016/S0167-4889(00)00009-4, PMID 10722877
- ^ A b Howell, B.J.; Moree, B.; Farrar, E.M.; Stewart, S.; Fang, G.; Salmon, E.D. (2004), "Spindle Checkpoint Protein Dynamics at Kinetochores in Living Cells", Aktuální biologie, 14 (11): 953–964, doi:10.1016/j.cub.2004.05.053, PMID 15182668
- ^ A b C Shah, J.V.; Botvinick, E.; Bonday, Z.; Furnari, F.; Berns, M.; Cleveland, D.W. (2004), "Dynamics of Centromere and Kinetochore Proteins Implications for Checkpoint Signaling and Silencing" (PDF), Aktuální biologie, 14 (11): 942–952, doi:10.1016/j.cub.2004.05.046, PMID 15182667
- ^ Tirnauer, Jennifer S.; Canman, Julie C.; Salmon, E.D.; Mitchison, Timothy J. (2002), "EB1 Targets to Kinetochores with Attached, Polymerizing Microtubules", Molekulární biologie buňky, 13 (12): 4308–4316, doi:10.1091/mbc.E02-04-0236, PMC 138635, PMID 12475954
- ^ Kaplan, K.B.; Burds, A.A.; Swedlow, J.R.; Bekir, S.S.; Sorger, P.K.; Näthke, I.S. (2001), "A role for the Adenomatous Polyposis Coli protein in chromosome segregation", Přírodní buněčná biologie, 3 (4): 429–432, doi:10.1038/35070123, PMID 11283619
- ^ Joseph, J .; Liu, S.T.; Jablonski, S.A.; Yen, T.J.; Dasso, M. (2004), "The RanGAP1-RanBP2 Complex is Essential for Microtubule-Kinetochore Interactions in Vivo", Aktuální biologie, 14 (7): 611–617, doi:10.1016 / j.cub.2004.03.031, PMID 15062103
- ^ Salina, Davide; Enarson, Paul; Rattner, J.B.; Burke, Brian (2003), "Nup358 integrates nuclear envelope breakdown with kinetochore assembly", The Journal of Cell Biology, 162 (6): 991–1002, doi:10.1083/jcb.200304080, PMC 2172838, PMID 12963708
- ^ Ohta S, Bukowski-Wills JC, Sanchez-Pulido L, Alves Fde L, Wood L, Chen ZA, Platani M, Fischer L, Hudson DF, Ponting CP, Fukagawa T, Earnshaw WC, Rappsilber J (September 2010), "The Protein Composition of Mitotic Chromosomes Determined Using Multiclassifier Combinatorial Proteomics", Buňka, 142 (5): 810–21, doi:10.1016/j.cell.2010.07.047, PMC 2982257, PMID 20813266
- ^ Tipton AR, Wang K, Oladimeji P, Sufi S, Gu Z, Liu ST (2012), "Identification of novel mitosis regulators through data mining with human centromere/kinetochore proteins as group queries", BMC Cell Biol, 13: 15, doi:10.1186/1471-2121-13-15, PMC 3419070, PMID 22712476
- ^ McEwen, B.F.; Heagle, A.B.; Cassels, G.O.; Buttle, K.F.; Rieder, C.L. (1997), "Kinetochore Fiber Maturation in PtK1 Cells and Its Implications for the Mechanisms of Chromosome Congression and Anaphase Onset", The Journal of Cell Biology, 137 (7): 1567–1580, doi:10.1083/jcb.137.7.1567, PMC 2137823, PMID 9199171
- ^ A b Nicklas, R.B.; Kubai, D.F. (1985), "Microtubules, chromosome movement, and reorientation after chromosomes are detached from the spindle by micromanipulation", Chromozom, 92 (4): 313–324, doi:10.1007/BF00329815, PMID 4042772
- ^ Mayor, T.; Meraldi, P.; Stierhof, Y.D.; Nigg, E.A.; Fry, A.M. (1999), "Protein kinases in control of the centrosome cycle", FEBS Dopisy, 452 (1–2): 92–95, doi:10.1016/S0014-5793(99)00534-7, PMID 10376685
- ^ A b Kirschner, M.; Mitchison, T. (1986), "Beyond self-assembly: from microtubules to morphogenesis", Buňka, 45 (3): 329–342, doi:10.1016/0092-8674(86)90318-1, PMID 3516413
- ^ Holy, T. E.; Leibler, S. (1994), "Dynamic instability of microtubules as an efficient way to search in space", Sborník Národní akademie věd Spojených států amerických, 91 (12): 5682–5685, doi:10.1073/pnas.91.12.5682, PMC 44060, PMID 8202548
- ^ Hayden, J.H.; Bowser, SS; Rieder, CL (1990), "Kinetochores capture astral microtubules during chromosome attachment to the mitotic spindle: direct visualization in live newt lung cells", The Journal of Cell Biology, 111 (3): 1039–1045, doi:10.1083/jcb.111.3.1039, PMC 2116290, PMID 2391359
- ^ Nicklas, R.B. (1997), "How Cells Get the Right Chromosomes", Věda, 275 (5300): 632–7, doi:10.1126/science.275.5300.632, PMID 9005842
- ^ Loncarek, J.; Kisurina-evgenieva, O.; Vinogradova, T.; Hergert, P.; La Terra, S.; Kapoor, T.M.; Khodjakov, A. (2007), "The centromere geometry essential for error-free mitosis is controlled by spindle forces", Příroda, 450 (7170): 745–9, doi:10.1038/nature06344, PMC 2586812, PMID 18046416
- ^ Dewar, H.; Tanaka, K .; Nasmyth, K.; Tanaka, T.U. (2004), "Tension between two kinetochores suffices for their bi-orientation on the mitotic spindle", Příroda, 428 (6978): 93–7, doi:10.1038/nature02328, PMID 14961024
- ^ Echeverri, C.J.; Paschal, B.M.; Vaughan, K.T.; Vallee, R.B. (1996), "Molecular characterization of the 50-kD subunit of dynactin reveals function for the complex in chromosome alignment and spindle organization during mitosis", The Journal of Cell Biology, 132 (4): 617–633, doi:10.1083/jcb.132.4.617, PMC 2199864, PMID 8647893
- ^ Sharp, D.J.; Rogers, G.C.; Scholey, J.M. (2000), "Cytoplasmic dynein is required for poleward chromosome movement during mitosis in Drosophila embryos", Přírodní buněčná biologie, 2 (12): 922–930, doi:10.1038/35046574, PMID 11146657
- ^ Banks, J.D.; Heald, R. (2001), "Chromosome movement: Dynein-out at the kinetochore", Aktuální biologie, 11 (4): 128–131, doi:10.1016/S0960-9822(01)00059-8, PMID 11250166
- ^ Howell, B.J.; McEwen, B.F.; Canman, J.C.; Hoffman, D.B.; Farrar, E.M.; Rieder, C.L.; Salmon, E.D. (2001), "Cytoplasmic dynein/dynactin drives kinetochore protein transport to the spindle poles and has a role in mitotic spindle checkpoint inactivation", The Journal of Cell Biology, 155 (7): 1159–1172, doi:10.1083/jcb.200105093, PMC 2199338, PMID 11756470
- ^ Cooke, C.A.; Schaar, B.; Yen, T.J.; Earnshaw, W.C. (1997), "LLocalization of CENP-E in the fibrous corona and outer plate of mammalian kinetochores from prometaphase through anaphase", Chromozom, 106 (7): 446–455, doi:10.1007/s004120050266, PMID 9391217
- ^ Weaver, Beth A.A.; Bonday, Zahid Q.; Putkey, Frances R.; Kops, Geert J.P.L.; Silk, Alain D.; Cleveland, Don W. (2003), "Centromere-associated protein-E is essential for the mammalian mitotic checkpoint to prevent aneuploidy due to single chromosome loss", The Journal of Cell Biology, 162 (4): 551–563, doi:10.1083/jcb.200303167, PMC 2173788, PMID 12925705
- ^ A b Maiato, H.; Rieder, C.L.; Khodjakov, A. (2004), "Kinetochore-driven formation of kinetochore fibers contributes to spindle assembly during animal mitosis", The Journal of Cell Biology, 167 (5): 831–840, doi:10.1083/jcb.200407090, PMC 2172442, PMID 15569709
- ^ Mitchison, T.J. (1988), "Microtubule Dynamics and Kinetochore Function in Mitosis", Annual Review of Cell Biology, 4 (1): 527–545, doi:10.1146/annurev.cb.04.110188.002523, PMID 3058165
- ^ A b C He, X.; Rines, D.R.; Espelin, C.W.; Sorger, P.K. (2001), "Molecular Analysis of Kinetochore-Microtubule Attachment in Budding Yeast", Buňka, 106 (2): 195–206, doi:10.1016/S0092-8674(01)00438-X, PMID 11511347
- ^ A b Westermann, Stefan; Cheeseman, Iain M.; Anderson, Scott; Yates, John R.; I. I. I., DG; Drubin, David G.; Barnes, Georjana (2003), "Architecture of the budding yeast kinetochore reveals a conserved molecular core", The Journal of Cell Biology, 163 (2): 215–22, doi:10.1083/jcb.200305100, PMC 2173538, PMID 14581449
- ^ A b De Wulf, P.; McAinsh, A.D.; Sorger, P.K. (2003), "Hierarchical assembly of the budding yeast kinetochore from multiple subcomplexes", Geny a vývoj, 17 (23): 2902–2921, doi:10.1101/gad.1144403, PMC 289150, PMID 14633972
- ^ Goh, P.Y.; Kilmartin, J.V. (1993), "NDC10: a gene involved in chromosome segregation in Saccharomyces cerevisiae", The Journal of Cell Biology, 121 (3): 503–12, doi:10.1083/jcb.121.3.503, PMC 2119568, PMID 8486732
- ^ Nabetani, A.; Koujin, T.; Tsutsumi, C.; Haraguchi, T.; Hiraoka, Y. (2001), "A conserved protein, Nuf2, is implicated in connecting the centromere to the spindle during chromosome segregation: a link between the kinetochore function and the spindle checkpoint", Chromozom, 110 (5): 322–334, doi:10.1007 / s004120100153, PMID 11685532
- ^ A b Howe, Mary; McDonald, Kent L.; Albertson, Donna G.; Meyer, Barbara J. (2001), "Him-10 Is Required for Kinetochore Structure and Function on Caenorhabditis elegans Holocentric Chromosomes", The Journal of Cell Biology, 153 (6): 1227–1238, doi:10.1083/jcb.153.6.1227, PMC 2192032, PMID 11402066
- ^ A b C Martin-lluesma, Silvia; Stucke, Volker M.; Nigg, Erich A. (2002), "Role of Hec1 in Spindle Checkpoint Signaling and Kinetochore Recruitment of Mad1/Mad2", Věda, 297 (5590): 2267–2270, doi:10.1126/science.1075596, PMID 12351790
- ^ A b C McCleland, M.L.; Gardner, R.D.; Kallio, M.J.; Daum, J.R.; Gorbsky, G.J.; Burke, D.J.; Stukenberg, P.T. (2003), "The highly conserved Ndc80 complex is required for kinetochore assembly, chromosome congression, and spindle checkpoint activity", Geny a vývoj, 17 (1): 101–114, doi:10.1101/gad.1040903, PMC 195965, PMID 12514103
- ^ Zheng, L .; Chen, Y .; Lee, W.H. (1999), "Hec1p, an Evolutionarily Conserved Coiled-Coil Protein, Modulates Chromosome Segregation through Interaction with SMC Proteins", Molekulární a buněčná biologie, 19 (8): 5417–5428, doi:10.1128/mcb.19.8.5417, PMC 84384, PMID 10409732
- ^ Wei, Ronnie R.; Al-bassam, Jawdat; Harrison, Stephen C. (2007), "The Ndc80/HEC1 complex is a contact point for kinetochore-microtubule attachment", Přírodní strukturní a molekulární biologie, 14 (1): 54–59, doi:10.1038/nsmb1186, PMID 17195848
- ^ Courtwright, A.M.; He, X. (2002), "Dam1 is the Right One Phosphoregulation of Kinetochore Biorientation", Vývojová buňka, 3 (5): 610–611, doi:10.1016/S1534-5807(02)00332-5, PMID 12431367
- ^ A b Cimini, D.; Moree, B.; Canman, J.C.; Salmon, E.D. (2003), "Merotelic kinetochore orientation occurs frequently during early mitosis in mammalian tissue cells and error correction is achieved by two different mechanisms", Journal of Cell Science, 116 (20): 4213–4225, doi:10.1242/jcs.00716, PMID 12953065
- ^ Adams, R.R.; Carmena, M.; Earnshaw, W.C. (2001), "Chromosomal passengers and the (aurora) ABCs of mitosis", Trendy v buněčné biologii, 11 (2): 49–54, doi:10.1016/S0962-8924(00)01880-8, PMID 11166196
- ^ Cheeseman, I.M.; Anderson, S .; Jwa, M.; Green, E.M.; Kang, J .; Yates, J.R.; Chan, C.S.M.; Drubin, D.G.; Barnes, G. (2002), "Phospho-Regulation of Kinetochore-Microtubule Attachments by the Aurora Kinase Ipl1p", Buňka, 111 (2): 163–172, doi:10.1016/S0092-8674(02)00973-X, PMID 12408861
- ^ Gautschi, Oliver; Heighway, Jim; Mack, Philip C.; Purnell, Phillip R.; Lara, Primo N.; Jr, .; Gandara, David R. (2008), "Aurora Kinases as Anticancer Drug Targets", Klinický výzkum rakoviny, 14 (6): 1639–48, doi:10.1158/1078-0432.CCR-07-2179, PMID 18347165CS1 maint: číselné názvy: seznam autorů (odkaz)
- ^ Meraldi, P.; Draviam, V.M.; Sorger, P.K. (2004), "Timing and Checkpoints in the Regulation of Mitotic Progression", Vývojová buňka, 7 (1): 45–60, doi:10.1016 / j.devcel.2004.06.006, PMID 15239953
- ^ Tang, T.T.L.; Bickel, S.E.; Young, L.M.; Orr-weaver, T.L. (1998), "Maintenance of sister-chromatid cohesion at the centromere by the Drosophila MEI-S332 protein", Geny a vývoj, 12 (24): 3843–3856, doi:10.1101/gad.12.24.3843, PMC 317262, PMID 9869638
- ^ McGuinness, B.E.; Hirota, T.; Kudo, N.R.; Peters, J.M.; Nasmyth, K. (2005), "Shugoshin Prevents Dissociation of Cohesin from Centromeres During Mitosis in Vertebrate Cells", PLOS Biol, 3 (3): e86, doi:10.1371/journal.pbio.0030086, PMC 1054882, PMID 15737064
- ^ Joseph, Jomon; Tan, Shyh-Han; Karpova, Tatiana S.; McNally, James G.; Dasso, Mary (2002), "SUMO-1 targets RanGAP1 to kinetochores and mitotic spindles", The Journal of Cell Biology, 156 (4): 595–602, doi:10.1083 / jcb.200110109, PMC 2174074, PMID 11854305
- ^ Arnaoutov, A.; Dasso, M. (2003), "The Ran GTPase Regulates Kinetochore Function", Vývojová buňka, 5 (1): 99–111, doi:10.1016/S1534-5807(03)00194-1, PMID 12852855
- ^ Prasanth, S.G.; Prasanth, K.V.; Siddiqui, K.; Spector, D.L.; Stillman, B. (2004), "Human Orc2 localizes to centrosomes, centromeres and heterochromatin during chromosome inheritance", Časopis EMBO, 23 (13): 2651–2663, doi:10.1038/sj.emboj.7600255, PMC 449767, PMID 15215892
- ^ Shimada, K.; Gasser, S.M. (2007), "The Origin Recognition Complex Functions in Sister-Chromatid Cohesion in Saccharomyces cerevisiae", Buňka, 128 (1): 85–99, doi:10.1016/j.cell.2006.11.045, PMID 17218257
- ^ Kato, H; Matsunaga, F; Miyazaki, S; Yin, L; D'urso, G; Tanaka, K; Murakami, Y (2008), "Schizosaccharomyces pombe Orc5 plays multiple roles in the maintenance of genome stability throughout the cell cycle", Buněčný cyklus, 7 (8): 1085–96, doi:10.4161/cc.7.8.5710, PMID 18414064
- ^ Skibbens, R.V.; Skeen, V.P.; Salmon, E.D. (1993), "Directional instability of kinetochore motility during chromosome congression and segregation in mitotic newt lung cells: a push-pull mechanism", The Journal of Cell Biology, 122 (4): 859–875, doi:10.1083/jcb.122.4.859, PMC 2119582, PMID 8349735
- ^ Rieder, C.L.; Salmon, E.D. (1994), "Motile kinetochores and polar ejection forces dictate chromosome position on the vertebrate mitotic spindle", The Journal of Cell Biology, 124 (3): 223–33, doi:10.1083/jcb.124.3.223, PMC 2119939, PMID 8294508
- ^ Skibbens, RV; Rieder, CL; Salmon, ED (1995), "Kinetochore motility after severing between sister centromeres using laser microsurgery: evidence that kinetochore directional instability and position is regulated by tension", Journal of Cell Science, 108 (7): 2537–48, PMID 7593295
- ^ Askham, J. M.; Vaughan, K. T.; Goodson, H. V.; Morrison, E. E. (2002), "Evidence That an Interaction between EB1 and p150Glued Is Required for the Formation and Maintenance of a Radial Microtubule Array Anchored at the Centrosome", Molekulární biologie buňky, 13 (10): 3627–3645, doi:10.1091/mbc.E02-01-0061, PMC 129971, PMID 12388762
- ^ Schuyler, S.C.; Pellman, D. (2001), "Microtubule "Plus-End-Tracking Proteins" the End is Just the Beginning", Buňka, 105 (4): 421–424, doi:10.1016/S0092-8674(01)00364-6, PMID 11371339
- ^ Howard, J .; Hyman, A.A. (2003), "Dynamics and mechanics of the microtubule plus end: cytoskeleton", Příroda, 422 (6933): 753–758, doi:10.1038/nature01600, PMID 12700769
- ^ Green, R.A.; Wollman, R.; Kaplan, K.B. (2005), "APC and EB1 Function Together in Mitosis to Regulate Spindle Dynamics and Chromosome Alignment", Molekulární biologie buňky, 16 (10): 4609–4622, doi:10.1091/mbc.E05-03-0259, PMC 1237068, PMID 16030254
- ^ Dujardin, D.; Wacker, U.I.; Moreau, A.; Schroer, T.A.; Rickard, J.E.; De Mey, J.R. (1998), "Evidence for a Role of CLIP-170 in the Establishment of Metaphase Chromosome Alignment", The Journal of Cell Biology, 141 (4): 849–862, doi:10.1083/jcb.141.4.849, PMC 2132766, PMID 9585405
- ^ Maiato, H.; Khodjakov, A.; Rieder, C.L. (2004), "Drosophila CLASP is required for the incorporation of microtubule subunits into fluxing kinetochore fibres", Přírodní buněčná biologie, 7 (1): 42–47, doi:10.1038/ncb1207, PMC 2596653, PMID 15592460
- ^ Maiato, H.; Fairley, E.A.L.; Rieder, C.L.; Swedlow, J.R.; Sunkel, C.E.; Earnshaw, W.C. (2003), "Human CLASP1 is an Outer Kinetochore Component that Regulates Spindle Microtubule Dynamics", Buňka, 113 (7): 891–904, doi:10.1016/S0092-8674(03)00465-3, hdl:10216/53832, PMID 12837247

