Glutamát - prefenátaminotransferáza - Glutamate—prephenate aminotransferase
| Glutamát-prefenátaminotransferáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.6.1.79 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
v enzymologie, glutamát-prefenátaminotransferáza (ES 2.6.1.79, také známý jako prefenát-transamináza, PAT a L-glutamát: prefenátaminotransferáza) je enzym že katalyzuje the chemická reakce
- L-arogenát + 2-oxoglutarát prefenát + L-glutamát
Tedy dva substráty tohoto enzymu jsou L-arogenát a 2-oxoglutarát, zatímco jeho dva produkty jsou prefenovat a L-glutamát. U většiny druhů rostlin využívajících tento enzym je však levá strana reakce silně upřednostňována. Proto se glutamát používá jako donor aminoskupiny k přeměně prefenátu na arogenát.
Nomenklatura
Tento enzym patří do rodiny transferázy, konkrétně transaminázy, které přenášejí dusíkaté skupiny. The systematické jméno této třídy enzymů je L-arogenát: 2-oxoglutarátaminotransferáza. Mezi další běžně používaná jména patří prefenát transamináza (nejednoznačný), PAT (nejednoznačný), a L-glutamát: prefenátaminotransferáza. Působí v fenylalanin a tyrosin biosyntetická cesta.
Distribuce druhů
Gen, který kóduje tento enzym, byl nedávno identifikován u různých druhů rostlin a mikroorganismů, což znamená, že všechny geny v cestě byly nyní identifikovány a zahrnuty. Tato cesta se vyskytuje u mnoha různých druhů rostlin. Protože fenylalanin je esenciální aminokyselina „Lidé (a další zvířata) ztratili schopnost sami si je vyrábět, a proto je musí získávat ze své stravy. Aktivita tohoto enzymu jako takového ovlivňuje také přežití zvířat. U těchto zvířat je tyrosin syntetizován z fenylalaninu prostřednictvím enzymu fenylalaninhydroxyláza zatímco rostliny mají vlastní metodu syntézy tyrosinu.
Funkce
Glutamát-prefanátaminotransferáza katalyzuje reverzibilní reakci uvedenou níže:
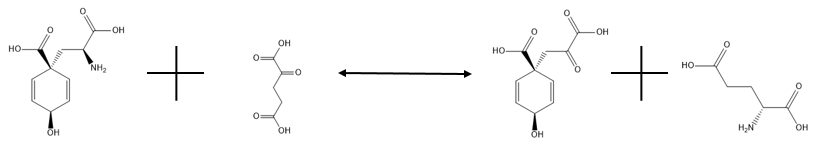 ,
,
a jeho primárním účelem je přeměna prefenátu na arogenát transaminací za použití glutamátu jako dárce aminoskupiny. Jak již bylo uvedeno, levá strana reakce je silně upřednostňována. Toto je nezbytný proces pro každý organismus, který potřebuje přeměnit arogenát na fenylalanin nebo tyrosin, protože arogenát je meziproduktem při reakcích, které syntetizují tyto aminokyseliny, což je alternativní cesta k fenylpyruvátu a hydroxyfenylpyruvátu. Při absenci glutamátu může aspartát působit jako donor aminoskupiny při reakci bez nutnosti použití jiného enzymu, ale tato reakce probíhá pomaleji. Podrobnosti o aktivitě tohoto enzymu jsou stále poněkud záhadné.
Struktura
O struktuře glutamát-prefenátaminotransferázy je známo málo. Některá data však naznačují, že enzym může mít α2-β2 struktura podjednotky.
Odkazy a další čtení
- Bonner CA, Jensen RA (1985). "Nové rysy prefenátaminotransferázy z buněčných kultur Nicotiana silvestris". Oblouk. Biochem. Biophys. 238 (1): 237–46. CiteSeerX 10.1.1.410.8500. doi:10.1016/0003-9861(85)90161-4. PMID 3985619.
- Bonner C, Jensen R. (1987). Prephenate aminotransferase. Metody Enzymol. Metody v enzymologii. 142. 479–87. doi:10.1016 / S0076-6879 (87) 42059-4. ISBN 9780121820428. PMID 3298985.
- Siehl DL, Connelly JA, Conn EE (1986). „Biosyntéza tyrosinu v Sorghum bicolor: charakteristika prefenátaminotransferázy“. Z. Naturforsch. C. 41 (1–2): 79–86. doi:10.1515 / znc-1986-1-213. PMID 2939644.
- Graindorge M, Giustini C, Jacomin AC, Kraut A, Curien G, Matringe M (2010). „Identifikace rostlinného genu kódujícího glutamát / aspartát-prefenát aminotransferázu: poslední bezdomovcový enzym biosyntézy aromatických aminokyselin“. FEBS Lett. 584 (20): 4357–60. doi:10.1016 / j.febslet.2010.09.037. PMID 20883697.
- Maeda H, Yoo H, Dudareva N (2011). „Prefenátaminotransferáza řídí biosyntézu rostlinného fenylalaninu prostřednictvím arogenátu“. Nat. Chem. Biol. 7 (1): 19–21. doi:10.1038 / nchembio.485. PMID 21102469.
- De-Eknamkul W, Ellis BE (1988). „Čištění a charakterizace prefenátaminotransferázy z buněčných kultur Anchusa officinalis“. Oblouk. Biochem. Biophys. 267 (1): 87–94. doi:10.1016/0003-9861(88)90011-2. PMID 3196038.
- Dal Cin V, Tieman DM, Tohge T, McQuinn R, de Vos RC, Osorio S, Schmelz EA, Taylor MG, Smits-Kroon MT, Schuurink RC, Haring MA, Giovannoni J, Fernie AR, Klee HJ (2011). „Identifikace genů v metabolické cestě fenylalaninu ektopickou expresí transkripčního faktoru MYB v rajčatovém ovoci“. Rostlinná buňka. 23 (7): 2738–53. doi:10.1105 / tpc.111.086975. PMC 3226207. PMID 21750236.
- Graindorge M, Giustini C, Kraut A, Moyet L, Curien G, Matringe M (2014). „U tří různých tříd aminotransferáz se vyvinula funkce prefenátaminotransferázy v mikroorganizmech schopných působit na arogenát“. J. Biol. Chem. 289 (6): 3198–208. doi:10,1074 / jbc.M113.486480. PMC 3916524. PMID 24302739.
- „Orthology: K15849“. Integrovaný systém načítání databáze DBGET. Citováno 25. října 2020.

