Elektronová skořápka - Electron shell
v chemie a atomová fyzika, an elektronový obal lze považovat za obíhat následován elektrony kolem atom je jádro. Nejbližší skořápka jádru se nazývá „1 shell "(také nazývaný" K shell "), následovaný"2 shell "(nebo" L shell "), poté"3 skořápka "(nebo" skořápka M ") atd. dále a dále od jádra. Mušle odpovídají hlavní kvantová čísla (n = 1, 2, 3, 4 ...) nebo jsou označeny abecedně písmeny použitými v Rentgenová notace (K, L, M, ...).
Každá skořápka může obsahovat pouze pevný počet elektronů: První skořápka pojme až dva elektrony, druhá skořápka pojme až osm (2 + 6) elektronů, třetí skořápka pojme až 18 (2 + 6 + 10) ) a tak dále. Obecný vzorec je, že nth shell může v zásadě pojmout až 2 (n2 ) elektrony.[1] Vysvětlení, proč v těchto skořápkách existují elektrony, viz elektronová konfigurace.[2]
Každá skořápka se skládá z jednoho nebo více dílčí skořápkya každé subshell se skládá z jednoho nebo více atomové orbitaly.
Dějiny
Terminologie prostředí pochází z Arnold Sommerfeld modifikace Bohrův model. Sommerfeld udržel Bohrov planetární model, ale přidal mírně eliptické dráhy (charakterizované dalšími kvantová čísla ℓ a m) k vysvětlení pokuty spektroskopická struktura některých prvků.[3] Několik elektronů se stejným hlavním kvantovým číslem (n) měl blízké dráhy, které místo nekonečně tenké kruhové dráhy Bohrova modelu tvořily „skořápku“ kladné tloušťky.
Existence elektronových obalů byla poprvé experimentálně pozorována v roce Charles Barkla a Henry Moseley je rentgen absorpční studie.[není nutný primární zdroj ] Barkla je označil písmeny K, L, M, N, O, P a Q.[4] Původ této terminologie byl abecední. Byla také podezřelá řada „J“, ačkoli pozdější experimenty ukázaly, že absorpční linie K jsou produkovány nejvnitřnějšími elektrony. Později bylo zjištěno, že tyto dopisy odpovídají n hodnoty 1, 2, 3 atd. Používají se ve spektroskopii Siegbahnova notace.
Dílčí skořápky

Každá skořápka se skládá z jedné nebo více dílčích skořápek, z nichž se skládá atomové orbitaly. Například první (K) shell má jeden subshell, tzv 1 s; druhá (L) skořápka má dvě podsloupce, tzv 2 s a 2 s; třetí shell má 3 s, 3p, a 3d; čtvrtá skořápka má 4 s, 4p, 4d a 4f; pátá skořápka má 5 s, 5p, 5 d, a 5f a teoreticky může obsahovat více 5 g subshell, který není obsazen v základní elektronové konfiguraci jakéhokoli známého prvku.[2] V následující tabulce jsou uvedeny různé možné podsloupce:
| Štítek subshell | ℓ | Max elektrony | Mušle, které ho obsahují | Historický název |
|---|---|---|---|---|
| s | 0 | 2 | Každá skořápka | sharfa |
| p | 1 | 6 | 2. skořápka a vyšší | principal |
| d | 2 | 10 | 3. skořápka a vyšší | diffuse |
| F | 3 | 14 | 4. skořápka a vyšší | Fnepoškozený |
| G | 4 | 18 | 5. skořápka a vyšší (teoreticky) | (další v abecedě po F, kromě i)[5] |
- První sloupec je „popisek subshell“, štítek malého písmene pro typ subshell. Například „4 s subshell "je subshell čtvrtého (N) shellu s typem (s) popsané v prvním řádku.
- Druhý sloupec je azimutální kvantové číslo (ℓ) subshell. Přesná definice zahrnuje kvantová mechanika, ale je to číslo, které charakterizuje subshell.
- Třetí sloupec je maximální počet elektronů, které lze vložit do subshellu tohoto typu. Například horní řádek říká, že každý s-typ subshell (1 s, 2 satd.) může obsahovat maximálně dva elektrony. V každém případě je číslo o 4 větší než číslo nad ním.
- Čtvrtý sloupec uvádí, které skořápky mají subshell tohoto typu. Například při pohledu na horní dva řádky má každý shell znak s subshell, zatímco pouze druhý shell a vyšší mají a p subshell (tj. neexistuje subshell „1p“).
- Poslední sloupec uvádí historický původ štítků s, p, d, a F. Pocházejí z raných studií atomové spektrální čáry. Ostatní štítky, jmenovitě G, h a i, jsou abecední pokračování následující po posledním historicky vzniklém štítku F.
Počet elektronů v každé skořápce
Každý subshell je nucen držet 4ℓ + 2 elektrony maximálně:
- Každý s subshell drží maximálně 2 elektrony
- Každý p subshell drží maximálně 6 elektronů
- Každý d subshell drží maximálně 10 elektronů
- Každý F subshell drží maximálně 14 elektronů
- Každý G subshell drží maximálně 18 elektronů
Proto K shell, který obsahuje pouze s subshell, může pojmout až 2 elektrony; skořápka L, která obsahuje s a a p, může pojmout až 2 + 6 = 8 elektronů atd.; obecně nth shell může pojmout až 2n2 elektrony.[1]
| Shell název | Subshell název | Subshell max elektrony | Shell max elektrony |
|---|---|---|---|
| K. | 1 s | 2 | 2 |
| L | 2 s | 2 | 2 + 6 = 8 |
| 2 s | 6 | ||
| M | 3 s | 2 | 2 + 6 + 10 = 18 |
| 3p | 6 | ||
| 3d | 10 | ||
| N | 4 s | 2 | 2 + 6 + 10 + 14 = 32 |
| 4p | 6 | ||
| 4d | 10 | ||
| 4f | 14 | ||
| Ó | 5 s | 2 | 2 + 6 + 10 + 14 + 18 = 50 |
| 5p | 6 | ||
| 5 d | 10 | ||
| 5f | 14 | ||
| 5 g | 18 |
Ačkoli tento vzorec v zásadě udává maximum, ve skutečnosti je toto maximum pouze dosaženo (známými prvky) pro první čtyři granáty (K, L, M, N). Žádný známý prvek nemá v jedné skořápce více než 32 elektronů.[6][7] Důvodem je, že podslupky jsou vyplněny podle Aufbauův princip. První prvky, které mají více než 32 elektronů v jedné skořápce, by patřily k g-blok z období 8 z periodická tabulka. Tyto prvky by měly v sobě nějaké elektrony 5 g subshell a tedy mají více než 32 elektronů v O shellu (pátý hlavní shell).
Energie subshellu a plnění objednávky

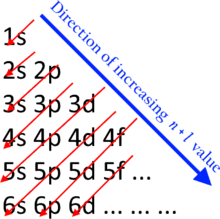
Ačkoli se někdy uvádí, že všechny elektrony ve skořápce mají stejnou energii, jedná se o přibližný odhad. Elektrony v jednom subshell mají přesně stejnou hladinu energie, přičemž novější podslity mají více energie na elektron než ty předchozí. Tento efekt je dostatečně velký, aby se energetické rozsahy spojené se skořápkami mohly překrývat.
Plnění skořápek a podškrupin elektrony probíhá od podškrticí s nižší energií k podškrupinám s vyšší energií. Toto následuje pravidlo n + ℓ který je také běžně známý jako Madelungovo pravidlo. Podškrty s nižší n + ℓ hodnoty jsou vyplněny před těmi s vyšší n + ℓ hodnoty. V případě rovnosti n + ℓ hodnoty, subshell s nižší n hodnota je vyplněna jako první.
Seznam prvků s elektrony na skořápku
Níže uvedený seznam uvádí prvky uspořádané podle zvyšujícího se atomového čísla a ukazuje počet elektronů na skořápku. Na první pohled podmnožiny seznamu ukazují zjevné vzory. Zejména každá sada pěti prvků (v elektrická modrá) před každým ušlechtilý plyn (skupina 18, v žlutá) těžší než hélium mají po sobě jdoucí počty elektronů v nejvzdálenějším plášti, jmenovitě tři až sedm. (Tento vzorec se však může rozpadnout v sedmé období kvůli relativistické efekty.)
Třídění tabulky podle chemikálií skupina ukazuje další vzory, zejména s ohledem na poslední dvě nejvzdálenější skořápky. (Prvky 57 až 71 patří do lanthanoidy, zatímco 89 až 103 jsou aktinidy.)
Níže uvedený seznam je primárně v souladu s Aufbauův princip. Existuje však řada výjimek z pravidla; například palladium (atomové číslo 46) nemá v páté skořápce žádné elektrony, na rozdíl od jiných atomů s dolní protonové číslo. Pokud nejsou k dispozici experimentální údaje, jsou některé položky v tabulce nejisté. (Například prvky kolem 108 mají takové krátké hodnoty poločasy že jejich elektronové konfigurace ještě nebyly změřeny.)
| Z | Živel | Počet elektronů / obal | Skupina |
|---|---|---|---|
| 1 | Vodík | 1 | 1 |
| 2 | Hélium | 2 | 18 |
| 3 | Lithium | 2, 1 | 1 |
| 4 | Berýlium | 2, 2 | 2 |
| 5 | Bor | 2, 3 | 13 |
| 6 | Uhlík | 2, 4 | 14 |
| 7 | Dusík | 2, 5 | 15 |
| 8 | Kyslík | 2, 6 | 16 |
| 9 | Fluor | 2, 7 | 17 |
| 10 | Neon | 2, 8 | 18 |
| 11 | Sodík | 2, 8, 1 | 1 |
| 12 | Hořčík | 2, 8, 2 | 2 |
| 13 | Hliník | 2, 8, 3 | 13 |
| 14 | Křemík | 2, 8, 4 | 14 |
| 15 | Fosfor | 2, 8, 5 | 15 |
| 16 | Síra | 2, 8, 6 | 16 |
| 17 | Chlór | 2, 8, 7 | 17 |
| 18 | Argon | 2, 8, 8 | 18 |
| 19 | Draslík | 2, 8, 8, 1 | 1 |
| 20 | Vápník | 2, 8, 8, 2 | 2 |
| 21 | Scandium | 2, 8, 9, 2 | 3 |
| 22 | Titan | 2, 8, 10, 2 | 4 |
| 23 | Vanadium | 2, 8, 11, 2 | 5 |
| 24 | Chrom | 2, 8, 13, 1 | 6 |
| 25 | Mangan | 2, 8, 13, 2 | 7 |
| 26 | Žehlička | 2, 8, 14, 2 | 8 |
| 27 | Kobalt | 2, 8, 15, 2 | 9 |
| 28 | Nikl | 2, 8, 16, 2 | 10 |
| 29 | Měď | 2, 8, 18, 1 | 11 |
| 30 | Zinek | 2, 8, 18, 2 | 12 |
| 31 | Gallium | 2, 8, 18, 3 | 13 |
| 32 | Germanium | 2, 8, 18, 4 | 14 |
| 33 | Arsen | 2, 8, 18, 5 | 15 |
| 34 | Selen | 2, 8, 18, 6 | 16 |
| 35 | Bróm | 2, 8, 18, 7 | 17 |
| 36 | Krypton | 2, 8, 18, 8 | 18 |
| 37 | Rubidium | 2, 8, 18, 8, 1 | 1 |
| 38 | Stroncium | 2, 8, 18, 8, 2 | 2 |
| 39 | Yttrium | 2, 8, 18, 9, 2 | 3 |
| 40 | Zirkonium | 2, 8, 18, 10, 2 | 4 |
| 41 | Niob | 2, 8, 18, 12, 1 | 5 |
| 42 | Molybden | 2, 8, 18, 13, 1 | 6 |
| 43 | Technecium | 2, 8, 18, 13, 2 | 7 |
| 44 | Ruthenium | 2, 8, 18, 15, 1 | 8 |
| 45 | Rhodium | 2, 8, 18, 16, 1 | 9 |
| 46 | Palladium | 2, 8, 18, 18 | 10 |
| 47 | stříbrný | 2, 8, 18, 18, 1 | 11 |
| 48 | Kadmium | 2, 8, 18, 18, 2 | 12 |
| 49 | Indium | 2, 8, 18, 18, 3 | 13 |
| 50 | Cín | 2, 8, 18, 18, 4 | 14 |
| 51 | Antimon | 2, 8, 18, 18, 5 | 15 |
| 52 | Telur | 2, 8, 18, 18, 6 | 16 |
| 53 | Jód | 2, 8, 18, 18, 7 | 17 |
| 54 | Xenon | 2, 8, 18, 18, 8 | 18 |
| 55 | Cesium | 2, 8, 18, 18, 8, 1 | 1 |
| 56 | Baryum | 2, 8, 18, 18, 8, 2 | 2 |
| 57 | Lanthan | 2, 8, 18, 18, 9, 2 | 3 |
| 58 | Cer | 2, 8, 18, 19, 9, 2 | |
| 59 | Praseodymium | 2, 8, 18, 21, 8, 2 | |
| 60 | Neodym | 2, 8, 18, 22, 8, 2 | |
| 61 | Promethium | 2, 8, 18, 23, 8, 2 | |
| 62 | Samarium | 2, 8, 18, 24, 8, 2 | |
| 63 | Europium | 2, 8, 18, 25, 8, 2 | |
| 64 | Gadolinium | 2, 8, 18, 25, 9, 2 | |
| 65 | Terbium | 2, 8, 18, 27, 8, 2 | |
| 66 | Dysprosium | 2, 8, 18, 28, 8, 2 | |
| 67 | Holmium | 2, 8, 18, 29, 8, 2 | |
| 68 | Erbium | 2, 8, 18, 30, 8, 2 | |
| 69 | Thulium | 2, 8, 18, 31, 8, 2 | |
| 70 | Ytterbium | 2, 8, 18, 32, 8, 2 | |
| 71 | Lutetium | 2, 8, 18, 32, 9, 2 | |
| 72 | Hafnium | 2, 8, 18, 32, 10, 2 | 4 |
| 73 | Tantal | 2, 8, 18, 32, 11, 2 | 5 |
| 74 | Wolfram | 2, 8, 18, 32, 12, 2 | 6 |
| 75 | Rhenium | 2, 8, 18, 32, 13, 2 | 7 |
| 76 | Osmium | 2, 8, 18, 32, 14, 2 | 8 |
| 77 | Iridium | 2, 8, 18, 32, 15, 2 | 9 |
| 78 | Platina | 2, 8, 18, 32, 17, 1 | 10 |
| 79 | Zlato | 2, 8, 18, 32, 18, 1 | 11 |
| 80 | Rtuť | 2, 8, 18, 32, 18, 2 | 12 |
| 81 | Thalium | 2, 8, 18, 32, 18, 3 | 13 |
| 82 | Vést | 2, 8, 18, 32, 18, 4 | 14 |
| 83 | Vizmut | 2, 8, 18, 32, 18, 5 | 15 |
| 84 | Polonium | 2, 8, 18, 32, 18, 6 | 16 |
| 85 | Astat | 2, 8, 18, 32, 18, 7 | 17 |
| 86 | Radon | 2, 8, 18, 32, 18, 8 | 18 |
| 87 | Francium | 2, 8, 18, 32, 18, 8, 1 | 1 |
| 88 | Rádium | 2, 8, 18, 32, 18, 8, 2 | 2 |
| 89 | Actinium | 2, 8, 18, 32, 18, 9, 2 | 3 |
| 90 | Thorium | 2, 8, 18, 32, 18, 10, 2 | |
| 91 | Protactinium | 2, 8, 18, 32, 20, 9, 2 | |
| 92 | Uran | 2, 8, 18, 32, 21, 9, 2 | |
| 93 | Neptunium | 2, 8, 18, 32, 22, 9, 2 | |
| 94 | Plutonium | 2, 8, 18, 32, 24, 8, 2 | |
| 95 | Americium | 2, 8, 18, 32, 25, 8, 2 | |
| 96 | Kurium | 2, 8, 18, 32, 25, 9, 2 | |
| 97 | Berkelium | 2, 8, 18, 32, 27, 8, 2 | |
| 98 | Kalifornium | 2, 8, 18, 32, 28, 8, 2 | |
| 99 | Einsteinium | 2, 8, 18, 32, 29, 8, 2 | |
| 100 | Fermium | 2, 8, 18, 32, 30, 8, 2 | |
| 101 | Mendelevium | 2, 8, 18, 32, 31, 8, 2 | |
| 102 | Nobelium | 2, 8, 18, 32, 32, 8, 2 | |
| 103 | Lawrencium | 2, 8, 18, 32, 32, 8, 3 | |
| 104 | Rutherfordium | 2, 8, 18, 32, 32, 10, 2 | 4 |
| 105 | Dubnium | 2, 8, 18, 32, 32, 11, 2 | 5 |
| 106 | Seaborgium | 2, 8, 18, 32, 32, 12, 2 | 6 |
| 107 | Bohrium | 2, 8, 18, 32, 32, 13, 2 | 7 |
| 108 | Draslík | 2, 8, 18, 32, 32, 14, 2 | 8 |
| 109 | Meitnerium | 2, 8, 18, 32, 32, 15, 2 (?) | 9 |
| 110 | Darmstadtium | 2, 8, 18, 32, 32, 16, 2 (?) | 10 |
| 111 | Roentgenium | 2, 8, 18, 32, 32, 17, 2 (?) | 11 |
| 112 | Copernicium | 2, 8, 18, 32, 32, 18, 2 (?) | 12 |
| 113 | Nihonium | 2, 8, 18, 32, 32, 18, 3 (?) | 13 |
| 114 | Flerovium | 2, 8, 18, 32, 32, 18, 4 (?) | 14 |
| 115 | Moscovium | 2, 8, 18, 32, 32, 18, 5 (?) | 15 |
| 116 | Livermorium | 2, 8, 18, 32, 32, 18, 6 (?) | 16 |
| 117 | Tennessine | 2, 8, 18, 32, 32, 18, 7 (?) | 17 |
| 118 | Oganesson | 2, 8, 18, 32, 32, 18, 8 (?) | 18 |
Viz také
Reference
- ^ A b Re: Proč mají elektronové skořápky stanovené limity? madsci.org, 17. března 1999, Dan Berger, fakulta chemie / přírodních věd, Bluffton College
- ^ A b Elektronové dílčí skořápky. Zdroj koroze.
- ^ Donald Sadoway, Úvod do chemie pevných látek, Přednáška 5
- ^ Barkla, Charles G. (1911). "XXXIX. Spektra fluorescenčního záření Röntgen" (PDF). Filozofický časopis. Řada 6. 22 (129): 396–412. doi:10.1080/14786440908637137.
Dříve označeny písmeny B a A (...). Písmena K a L jsou však upřednostňována, protože je vysoce pravděpodobné, že existuje řada záření absorbovatelnějších i pronikavějších.
- ^ Jue, T. (2009). „Kvantová mechanika - základní až biofyzikální metody“. Základní pojmy v biofyzice. Berlín: Springer. str. 33. ISBN 978-1-58829-973-4.
- ^ Orbitály. Chem4Kids. Citováno dne 1. prosince 2011.
- ^ Konfigurace elektronů a skořápek Archivováno 28. prosince 2018 v Wayback Machine. Chemistry.patent-invent.com. Citováno dne 1. prosince 2011.

