Objev a vývoj bisfosfonátů - Discovery and development of bisphosphonates - Wikipedia

Bisfosfonáty jsou důležitou třídou drog původně zavedenou před půl stoletím. Používají se k léčbě osteoporóza a další poruchy kostí, které způsobují křehkost kostí a nemoci, kde kostní resorpce je nadměrná. Osteoporóza je běžná u postmenopauzální ženy a pacienti v kortikosteroidy léčba, kde se ukázalo, že bifosfonáty jsou cennou léčbou a také úspěšně používány proti Pagetova nemoc, myelom, kost metastázy a hyperkalcémie. Bisfosfonáty snižují rozpad kostí inhibicí osteoklasty, mají dlouhou historii používání a dnes je na trhu po celém světě několik různých druhů bisfosfonátových léků.
Objev
Bisfosfonáty byly původně syntetizovány v 19. století a byly použity v průmyslu k jejich výrobě antiscaling a antikorozní vlastnosti. Na konci 60. let se projevil jejich potenciál k léčbě nemocí souvisejících s metabolizmem kostí. Zahrnuta první generace bisfosfonátů kyselina etidronová a kyselina klodronová které byly zavedeny v 70. a 80. letech. Byly to první bisfosfonátové léky, které se na klinice úspěšně používaly.[1] Od té doby byly vyvinuty dále s úmyslem zvýšit jejich účinnost, zlepšit jejich distribuci uvnitř kosti a prodloužit dobu působení. To umožnilo dát zoledronát, nejnovější bisfosfonátový lék, který má být uveden na trh, v jedné roční dávce intravenózní infuzí.[2]
Rozvoj
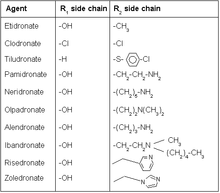
Původní bisfosfonáty (první generace) byly jednoduché molekuly s malými skupinami jednotlivých atomů nebo alkyl řetězy v poloze R1 a R.2. Měli jen poměrně slabý inhibiční účinek na resorpci kostí. Zahrnutí aminoskupiny znamenalo začátek druhé generace bisfosfonátů s vyšší účinností. První byl pamidronát a podobné analogy následovaly, kde poloha dusíku v postranním řetězci byla klíčem k účinnějšímu léku. Později se ukázalo, že dusík nemusí být nutně připojen k alkylovému řetězci, ale místo toho pomocí a heterocyklický skupina. Bylo vyvinuto několik takových léků a uvedeny na trh, kde je nejvýznamnější zoledronát. Kyselina minodronová je ještě účinnější a byl uveden na trh v Japonsku. Jejich účinnost je taková, že je účinná i v pikomolární koncentraci.[3]
Další vývoj nevedl k uvedení sloučenin se stejnou účinností na trh. Arylalkylové náhražky pamidronátu patří k nejnovějším klinicky použitým bisfosfonátům, kde hydroxylová skupina v poloze R2 byl vynechán, aby byla zajištěna stabilita.[1]
Nedávný výzkum v této oblasti otevřel příležitost vyvinout nové léčby bisfosfonáty.
Bisfosfonáty s více lipofilní byly vyvinuty a vykazovaly potenciál jako tumor potlačující. Fungují mírně odlišným mechanismem, ve kterém nejen inhibují klíčový enzym farnesylpyrofosfát syntázu (FPPS) mevalonátová cesta ale také geranylgeranylpyrofosfát syntáza (GGPS), enzym také lokalizovaný v mevalonátové dráze. Nemají stejnou afinitu k kostní minerály.[4]
GGPS byl od té doby úspěšně inhibován novou bisfosfonátovou sloučeninou s a triazol skupina v R2 a methylovou skupinu v R1. To může být užitečné při terapii proti malignity jako mnohočetný myelom.[5]
V roce 2018 dendritický Byl zaveden bisfosfonát obsahující tři bisfosfonátové jednotky. Ukázal potenciál pro kostní specifické dodání velkých terapeutických molekul využitím vysoké afinity bisfosfonátů ke kostním minerálům [6]
Mechanismus účinku

The mechanismus účinku bifosfonátů (BP) se vyvinulo s vývojem nových generací léků. Funkce bisfosfonátů první generace se liší od novějších dusík obsahující BP, ale oba jsou zjevně internalizováni endocytóza vezikuly vázané na membránu, kde je droga s největší pravděpodobností v a komplex s Ca.2+ ionty. To se netýká ostatních buněk v kosti, protože k tomu dochází selektivním příjmem osteoklastů.[3]
Společnou funkcí, která platí pro všechna léčiva bisfosfonáty, je fyzikálně-chemická interakce s kostním minerálem, aby se zabránilo fyzické resorpci kosti osteoklasty. To platí zejména na místech, kde přestavba kostí je nejaktivnější.[7][8] Bisfosfonáty mají vnitřní afinitu k iontům vápníku (hydroxyapatit ) kostního minerálu stejně jako endogenní pyrofosfáty. Rozdíl spočívá v nehydrolyzovatelné vazbě uhlík-fosfor bisfosfonátů, která zabraňuje jejich metabolismu a současně zajišťuje efektivní vstřebávání z gastrointestinální trakt.[9]
Primární inhibiční účinek první generace bisfosfonátů na osteoklasty je indukcí apoptóza. Mechanismus účinku je zjevně tvorbou analogu ATP nebo metabolitu bisfosfonátů, jako je kyselina etidronová a kyselina clodronová. Analog ATP se hromadí v cytosol osteoklastu s cytotoxickým účinkem.[10]
Primárním mechanismem účinku rozvinutějších bisfosfonátů obsahujících dusík je však buněčný účinek na osteoklasty prostřednictvím inhibice mevalonátové dráhy a zejména následné tvorby isoprenoid lipidy. Inhibice probíhá v klíčovém bodě odbočky v dráze katalyzované farnesylpyrofosfát syntázou (FPPS).[11] Isoprenoidové lipidy jsou nezbytné pro posttranslační úpravy malých regulačních proteinů vázajících GTP, jako jsou Rac, Rho a Ras z Ras nadčeleď. Funkce osteoklastů na nich závisí u různých buněčných procesů, jako je apoptóza.[12]
Vztah aktivity a struktury
Farmakofor
Bisfosfonáty napodobují endogenní anorganické pyrofosfát Kde kyslík páteř je nahrazena uhlík (P-C-P pro P-O-P). Dvě další skupiny nebo boční řetězy na uhlíkové páteři se obvykle označují jako R1 a R.2. R1 je obvykle a hydroxyl skupina, která zvyšuje afinitu k vápník vytvořením a tridentátní ligand spolu s fosfátovými skupinami. Sloučeninu lze vylepšit optimalizací struktura z R.2 skupinu, která nejlépe inhibuje kostní resorpce.[13]
Fosfonát
Fosfonát skupiny v chemické struktuře jsou důležité pro vazbu léčiva na cílový enzym. Studie ukázaly, že odstranění nebo nahrazení fosfonátové skupiny a karboxylová kyselina způsobuje drastickou ztrátu účinnosti drogy a inhibitor enzymu již nejde do izomerizovaný stav.[14]
Hydroxylová skupina (R.1 boční řetěz)
Modifikace R.1 postranní řetězec na bisfosfonátech je dnes velmi malý, zdá se, že jediná hydroxylová skupina v této poloze poskytuje nejlepší výsledky z hlediska aktivity. Hydroxylová skupina hraje roli při vytváření vazby indukované vodou glutamin (Gln240) na cílovém enzymu. Léky, které nemají hydroxylovou skupinu, zpočátku způsobují lepší inhibici než mateřské sloučeniny, bez hydroxylové skupiny se zdá, že lék snáze zapadá do otevřeného prostoru Aktivní stránky. Absence hydroxylové skupiny však snižuje schopnost udržet cílový enzymový komplex v izomerizovaném stavu. Biologická aktivita bisfosfonátů s hydroxylovou skupinou se tedy objevuje po delší dobu.[14]
Dusík (R.2 boční řetěz)
Dusík obsahující bisfosfonáty jsou v současné době nejpoužívanějšími léky ve třídě kvůli jejich potence.[15] Studie prokázaly, že se dusík na bisfosfonátech tvoří vodíková vazba s threonin (Thr201) a karbonyl část Lysin (Lys200) na cílovém enzymu, čímž se zvyšuje vazba komplexu. Změna polohy dusíku může významně změnit schopnost dusíkové vodíkové vazby.[14]
| Bisfosfonát | potence (relativní) |
|---|---|
| Alendronát | 1-5 |
| Risedronát | 10 |
| Zoledronát (IV) | 50 |
Modifikace postranního řetězce obsahujícího dusík (R.2 boční řetěz)
Prodloužená délka uhlíku dusíku R2 postranní řetězec mění aktivitu. Boční řetěz, který je vyroben ze tří uhlíky se ukázala jako nejideálnější délka z hlediska aktivity, zvětšení nebo zmenšení délky řetězce odtud má negativní vliv na biologickou aktivitu. Alendronát, běžné bisfosfonátové léčivo, má například boční řetězec se třemi uhlíky.[17] Risedronát má heterocyklickou strukturu obsahující dusík. Heterocyklický bisfosfonáty obsahující dusík odhalily lepší výsledky z hlediska aktivity ve srovnání s dřívějšími bisfosfonáty s dusíkem vázaným na uhlíkový řetězec. Studie na risedronátu analogickém s odlišným umístěním dusíku na kruhu neprokázaly žádné měřitelné rozdíly v biologické aktivitě. Prodloužená délka uhlíkového řetězce připojeného k prstenci odhalila negativní výsledky.[18] Zoledronát je nejúčinnější bisfosfonátový lék dnes dostupný pouze jako intravenózní injekce. Je to jediný bisfosfonátový lék, který má v postranním řetězci dvě dusíkové skupiny, a proto má svou účinnost a způsob podání se liší od ostatních léků ve stejné třídě.[16]
Reference
- ^ A b Widler, Leo; Jaeggi, Knut A .; Glatt, Markus; Müller, Klaus; Bachmann, Rolf; Bisping, Michael; Born, Anne-Ruth; Cortesi, Reto; Guiglia, Gabriela; Jeker, Heidi; Klein, Rémy (01.08.2002). "Vysoce účinné geminální bisfosfonáty. Od pamidronátu disodného (Aredia) po kyselinu zoledronovou (Zometa)". Journal of Medicinal Chemistry. 45 (17): 3721–3738. doi:10.1021 / jm020819i. ISSN 0022-2623. PMID 12166945.
- ^ Reid, Ian R .; Brown, Jacques P .; Burckhardt, Peter; Horowitz, Zebulun; Richardson, Peter; Trechsel, Ulrich; Widmer, Albert; Devogelaer, Jean-Pierre; Kaufman, Jean-Marc; Jaeger, Philippe; Tělo, Jean-Jacques (2002-02-28). "Intravenózní kyselina zoledronová u postmenopauzálních žen s nízkou kostní minerální hustotou". New England Journal of Medicine. 346 (9): 653–661. doi:10.1056 / NEJMoa011807. ISSN 0028-4793.
- ^ A b Thompson, Keith; Rogers, Michael J. (01.09.2007). "Molekulární mechanismy působení bisfosfonátů". Klinické hodnocení kostního a minerálního metabolismu. 5 (3): 130–144. doi:10.1007 / s12018-007-9004-0. ISSN 1559-0119.
- ^ [1] „„ Bisfosfonátové sloučeniny a metody se zvýšenou účinností pro více cílů včetně FPPS, GGPPS a DPPS “, vydáno 11. dubna 2008
- ^ Matthiesen, Robert A .; Varney, Michelle L .; Xu, Pauline C .; Rier, Alex S .; Wiemer, David F .; Holstein, Sarah A. (leden 2018). „α-methylace zvyšuje účinnost isoprenoidních triazol-bisfosfonátů jako inhibitorů geranylgeranyldifosfát syntázy“. Bioorganická a léčivá chemie. 26 (2): 376–385. doi:10.1016 / j.bmc.2017.10.023. PMC 5752576. PMID 29248353.
- ^ Shimoda, Kazuma; Mitsuoka, Takahiro; Ueda, Kenta; Suemune, Hiroshi; Hirai, Go; Aso, Mariko (2018-12-19). "Syntéza dendritických bisfosfonátů jako kostních ligandů". Čtyřstěn dopisy. 59 (51): 4528–4531. doi:10.1016 / j.tetlet.2018.11.028. ISSN 0040-4039.
- ^ Masarachia, P .; Weinreb, M .; Balena, R .; Rodan, G. A. (01.09.1996). "Porovnání distribuce 3H-alendronátu a 3H-etidronátu v kostech potkana a myši". Kost. 19 (3): 281–290. doi:10.1016/8756-3282(96)00182-2. ISSN 8756-3282. PMID 8873969.
- ^ Sato, M; Grasser, W; Endo, N; Akins, R; Simmons, H; Thompson, D D; Golub, E; Rodan, GA (01.12.1991). „Působení bisfosfonátů. Lokalizace alendronátu v kosti krysy a účinky na ultrastrukturu osteoklastů“. Journal of Clinical Investigation. 88 (6): 2095–2105. doi:10.1172 / JCI115539. ISSN 0021-9738. PMC 295810. PMID 1661297.
- ^ Benford, Helena L .; Frith, Julie C .; Auriola, Seppo; Mönkkönen, Jukka; Rogers, Michael J. (01.07.1999). „Farnesol a Geranylgeraniol zabraňují aktivaci kaspáz aminobisfosfonáty: biochemický důkaz pro dvě odlišné farmakologické třídy bisfosfonátových léčiv“. Molekulární farmakologie. 56 (1): 131–140. doi:10,1124 / mol. 56.1.131. ISSN 0026-895X. PMID 10385693.
- ^ Selander, K. S .; Mönkkönen, J .; Karhukorpi, E. K .; Härkönen, P .; Hannuniemi, R .; Väänänen, H. K. (01.11.1996). „Vlastnosti apoptózy vyvolané klodronáty v osteoklastech a makrofágech“. Molekulární farmakologie. 50 (5): 1127–1138. ISSN 0026-895X. PMID 8913344.
- ^ Ebetino, Frank H .; Hogan, Anne-Marie L .; Sun, Shuting; Tsoumpra, Maria K .; Duan, Xuchen; Triffitt, James T .; Kwaasi, Aaron A .; Dunford, James E .; Barnett, Bobby L .; Oppermann, Udo; Lundy, Mark W. (01.07.2011). "Vztah mezi chemií a biologickou aktivitou bisfosfonátů". Kost. Bisfosfonáty. 49 (1): 20–33. doi:10.1016 / j.bone.2011.03.774. ISSN 8756-3282. PMID 21497677.
- ^ Coxon, F.P .; Rogers, M. J. (01.01.2003). "Úloha prenylovaných malých proteinů vázajících GTP v regulaci funkce osteoklastů". Kalcifikovaná tkáňová mezinárodní. 72 (1): 80–84. doi:10.1007 / s00223-002-2017-2. ISSN 0171-967X. PMID 12370802.
- ^ Widler, Leo; Jaeggi, Knut A .; Glatt, Markus; Müller, Klaus; Bachmann, Rolf; Bisping, Michael; Born, Anne-Ruth; Cortesi, Reto; Guiglia, Gabriela; Jeker, Heidi; Klein, Rémy (srpen 2002). „Vysoce účinné geminální bisfosfonáty. Od dvojsodného pamidronátu (Aredia) po kyselinu zoledronovou (Zometa)“. Journal of Medicinal Chemistry. 45 (17): 3721–3738. doi:10.1021 / jm020819i. ISSN 0022-2623.
- ^ A b C Dunford, James E .; Kwaasi, Aaron A .; Rogers, Michael J .; Barnett, Bobby L .; Ebetino, Frank H .; Russell, R. Graham G .; Oppermann, Udo; Kavanagh, Kathryn L. (duben 2008). „Vztahy mezi strukturou a aktivitou mezi dusíkem obsahujícím bisfosfonáty v klinickém použití a jinými analogy: časově závislá inhibice lidské farnesylpyrofosfátsyntázy“. Journal of Medicinal Chemistry. 51 (7): 2187–2195. doi:10.1021 / jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ Dunford, James E .; Kwaasi, Aaron A .; Rogers, Michael J .; Barnett, Bobby L .; Ebetino, Frank H .; Russell, R. Graham G .; Oppermann, Udo; Kavanagh, Kathryn L. (01.04.2008). „Vztahy mezi strukturou a aktivitou mezi dusíkem obsahujícím bisfosfonáty v klinickém použití a jinými analogy: časově závislá inhibice lidské farnesylpyrofosfátsyntázy“. Journal of Medicinal Chemistry. 51 (7): 2187–2195. doi:10.1021 / jm7015733. ISSN 0022-2623. PMID 18327899.
- ^ A b Tripathi, KD (2013), „Kapitola 09 adrenergní systém a drogy“, Základy lékařské farmakologieJaypee Brothers Medical Publishers (P) Ltd., str. 124–139, doi:10 5005 / jp / knihy / 12021_10, ISBN 9789350259375
- ^ Fleisch, Herbert (2002). „Vývoj bisfosfonátů“. Výzkum rakoviny prsu. 4 (1): 30–34. doi:10.1186 / bcr414. ISSN 1465-5411. PMC 138713. PMID 11879557.
- ^ van Beek, E. R .; Löwik, C. W. G. M .; Ebetino, F. H .; Papapoulos, S.E. (01.11.1998). "Vazebné a antiresorpční vlastnosti analogů bisfosfonátů obsahujících heterocykly: vztahy mezi strukturou a aktivitou". Kost. 23 (5): 437–442. doi:10.1016 / S8756-3282 (98) 00120-3. ISSN 8756-3282. PMID 9823450.
