Koenzym F420 - Coenzyme F420
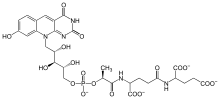
Struktura koenzymu F420
Koenzym F420 nebo 8-hydroxy-5-deazaflavin je koenzym (někdy nazývaný kofaktor) zapojený do redox reakce v methanogeny,[1] v mnoha Aktinobakterie a sporadicky v jiných bakteriálních liniích. Je to flavin derivát. Koenzym je substrátem pro koenzym F420 hydrogenáza,[2] 5,10-methylenetetrahydromethanopterin reduktáza a methylenetetrahydromethanopterin dehydrogenáza.[3][4]
Obzvláště bohatý přírodní zdroj F.420 je Mycobacterium smegmatis, ve kterém několik desítek enzymů používá F420 místo souvisejícího kofaktoru FMN používaný homologními enzymy u většiny ostatních druhů.[5] Eukaryoty včetně ovocné mušky Drosophila melanogaster a řasy Ostreococcus tauri také použít předchůdce tohoto kofaktoru.[6]
Biosyntéza
Koenzym F420 je syntetizován vícestupňovou cestou:
- 7,8-didemethyl-8-hydroxy-5-deazariboflavin syntáza produkuje koenzym FO (také psaný F0), který je sám kofaktorem DNA fotolyáza (anténa). Toto je hlavní část molekuly.[6]
- 2-fosfo-L-laktát transferáza produkuje koenzym F.420-0, část obsahující hlavu, difosfátový můstek a končící skupinou karboxylové kyseliny.
- Koenzym F420-0: L-glutamát ligáza umístí glutamátový zbytek na konec -COOH za vzniku koenzymu F.420-1.
- Koenzym F420-1: gama-L-glutamát ligáza umístí zbytek gama-glutamátu na konec -COOH a produkuje koenzym F.420-2, konečná sloučenina (v oxidované formě).
Viz také
Reference
- ^ Deppenmeier U (září 2002). „Redoxní translokace protonů v methanogenní Archaei“. Buněčné a molekulární biologické vědy. 59 (9): 1513–33. doi:10.1007 / s00018-002-8526-3. PMID 12440773.
- ^ Fox JA, Livingston DJ, Orme-Johnson WH, Walsh CT (červenec 1987). „8-Hydroxy-5-deazaflavin redukující hydrogenáza z Methanobacterium thermoautotrophicum: 1. Čištění a charakterizace“. Biochemie. 26 (14): 4219–27. doi:10.1021 / bi00388a007. PMID 3663585.
- ^ Hagemeier CH, Shima S, Thauer RK, Bourenkov G, Bartunik HD, Ermler U (říjen 2003). „Methylenetetrahydromethanopterin dehydrogenáza (Mtd) závislá na koenzymu F420 z Methanopyrus kandleri: methanogenní enzym s neobvyklou kvartérní strukturou“. Journal of Molecular Biology. 332 (5): 1047–57. doi:10.1016 / S0022-2836 (03) 00949-5. PMID 14499608.
- ^ te Brömmelstroet BW, Geerts WJ, Keltjens JT, van der Drift C, Vogels GD (září 1991). „Čištění a vlastnosti 5,10-methylenetetrahydromethanopterin dehydrogenázy a 5,10-methylenetetrahydromethanopterin reduktázy, dvou enzymů závislých na koenzymu F420, z Methanosarcina barkeri.“ Biochimica et Biophysica Acta (BBA) - proteinová struktura a molekulární enzymologie. 1079 (3): 293–302. doi:10.1016/0167-4838(91)90072-8. PMID 1911853.
- ^ Selengut JD, Haft DH (listopad 2010). „Neočekávané množství enzymů závislých na koenzymu F (420) u Mycobacterium tuberculosis a dalších aktinobakterií“. Journal of Bacteriology. 192 (21): 5788–98. doi:10.1128 / JB.00425-10. PMC 2953692. PMID 20675471.
- ^ A b Glas AF, Maul MJ, Cryle M, Barends TR, Schneider S, Kaya E, Schlichting I, Carell T (červenec 2009). „Archaeal cofactor F0 je anténní chromofor pro eukaryoty získávající světlo“. Sborník Národní akademie věd Spojených států amerických. 106 (28): 11540–5. doi:10.1073 / pnas.0812665106. PMC 2704855. PMID 19570997.
externí odkazy
| Tento biochemie článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
