Jodid kademnatý - Cadmium iodide
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Jodid kademnatý (II) | |
| Ostatní jména Jodid kademnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.294 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| CdI2 | |
| Molární hmotnost | 366,22 g / mol |
| Vzhled | bílé až světle žluté krystaly |
| Hustota | 5,640 g / cm3, pevný |
| Bod tání | 387 ° C (729 ° F; 660 K) |
| Bod varu | 742 ° C (1368 ° F; 1015 K) |
| 787 g / L (0 ° C) 847 g / L (20 ° C) 1250 g / l (100 ° C) | |
| Rozpustnost | rozpustný v ethanol, aceton, éter a amoniak |
| -117.2·10−6 cm3/ mol | |
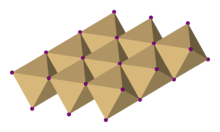
| Struktura | |
| Trigonální, hP3, vesmírná skupina P3ml, č. 164 | |
| osmistěn | |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H301, H331, H351, H373, H400, H410 | |
| P260, P280, P301 + 330 + 331, P310, P304 + 340, P311, P403 + 233 | |
| NFPA 704 (ohnivý diamant) | |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | TWA 0,005 mg / m3 (jako Cd)[1] |
REL (Doporučeno) | Ca.[1] |
IDLH (Okamžité nebezpečí) | Ca [9 mg / m3 (jako Cd)][1] |
| Související sloučeniny | |
jiný anionty | fluorid kademnatý chlorid kademnatý bromid kademnatý |
jiný kationty | jodid zinečnatý jodid rtuťnatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Jodid kademnatý, CdI2, je chemická sloučenina z kadmium a jód. Je pozoruhodný jeho Krystalická struktura, což je typické pro sloučeniny formy MX2 se silným polarizace účinky.
Příprava
Jodid kademnatý se připravuje přidáním kovu kadmia nebo jeho oxidu, hydroxidu nebo uhličitanu do kyselina jodovodíková.
Sloučenina může být také vyrobena zahříváním kadmia jodem.
Krystalická struktura

V jodidu kademnatém jodid anionty tvoří hexagonální těsně zabalené uspořádání, zatímco kadmium kationty vyplňte všechna osmistěnná místa ve střídavých vrstvách. Výsledná struktura se skládá z vrstvené mřížky. Stejná základní struktura se nachází v mnoha dalších soli a minerály. Jodid kademnatý je většinou iontově vázaný ale s částečným kovalentní charakter.[2]
Krystalová struktura jodidu kademnatého je prototypem, na kterém lze považovat za základ krystalové struktury mnoha dalších sloučenin. Sloučeniny s kteroukoli z následujících charakteristik mají tendenci přijímat CdI2 struktura:[Citace je zapotřebí ]
- Jodidy mírně polarizující kationty; bromidy a chloridy silně polarizujících kationtů
- Hydroxidy sloučenin, tj. sloučenin obecného vzorce M (OH)2
- Sulfidy, selenidy a teluridy (chalkogenidy ) tetrakationací, tj. sloučenin obecného vzorce MX2, kde X = S, Se, Te
Reference
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0087". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. s. 1211–1212. ISBN 978-0-08-037941-8.

