Funkční skupina vinyljodidu - Vinyl iodide functional group
tento článek příliš se zaměřuje na konkrétní příklady bez vysvětlovat jejich důležitost k jeho hlavnímu předmětu. (prosinec 2013) |

v organická chemie, a vinyljodid (také známý jako jodalken) funkční skupina je alken s jedním nebo více jodid substituenty. Vinyljodidy jsou univerzální molekuly, které slouží jako důležité stavební kameny a prekurzory v organické syntéze. Obvykle se používají při reakcích vytvářejících uhlík-uhlík v přechodně kovových katalyzovanýchvazebné reakce, jako Stilleho reakce, Heck reakce, Sonogashira spojka, a Spojka Suzuki.[1] Syntéza dobře definované geometrie nebo složitosti vinyljodidu je důležitá stereoselektivní syntéza přírodní produkty a léky.
Vlastnosti
Vinyljodidy jsou obecně stabilní pod nukleofilní podmínky. V S.N2 reakce, zpětný útok je obtížný kvůli sterickému střetu R skupin na sousedním uhlíku elektrofilní střed (viz obrázek 1a).[2] Osamocený pár na jodidu navíc daruje do ╥ * alkenu, což snižuje elektrofilní charakter uhlíku v důsledku sníženého kladného náboje. Také tohle stereoelektronický efekt posiluje vazbu C-I, čímž ztěžuje odstranění jodidu (viz obrázek 1b).[3] V S.N1 případ, disociace je obtížná kvůli zesílené vazbě C-I a ztráta jodidu způsobí nestabilitu karbokace (viz obrázek 1c)[2]

V kříživazebné reakce, typicky vinyljodidy reagují rychleji a za mírnějších podmínek než vinylchlorid a vinylbromid. Pořadí reaktivity je založeno na síle vazby uhlík-halogen. Vazba C-I je nejslabší z halogenů, energie disociace vazby C-I je 57,6 kcal / mol, zatímco fluorid, chlorid a bromid jsou 115, 83,7, 72,1 kcal / mol.[4] Vinyljodid v důsledku slabší vazby nepolymeruje tak snadno jako jeho vinylhalogenid protějšky, ale spíše se rozloží a uvolní jodid.[5]Obecně se věří, že vinyljodid nemůže přežít běžně snížení podmínek, které redukují vinyljodid na olefin nebo nenasycené alkanu.[6] V literatuře však existují důkazy, ve kterých a propargylalkohol je alkyn byla redukována v přítomnosti vinyljodidu pomocí vodíku nad Pd / CaCO3 nebo Crabtreeův katalyzátor.[7]

Další aplikace

Kromě použití vinyljodidů jako užitečných substrátů při křížovém přechoduvazebná reakce, mohou také podstoupit odstranění se silnou základnou dát odpovídající alkyn a mohou být převedeny na vhodný vinyl Grignardova činidla. Vinyljodidy se převádějí na Grignardova činidla výměnou hořčík-halogen (viz schéma la).[8] Rozsah této syntetické metody je omezený, protože vyžaduje vyšší teploty a delší reakční dobu, což ovlivňuje toleranci funkční skupiny. Avšak vinyljodid s skupina pro výběr elektronů může zvýšit směnný kurz (viz schéma 1b).[8] Také přidání chlorid lithný pomáhá zlepšit výměnu hořčík-halogen (viz schéma 1c). Předpokládá se, že chlorid lithný štěpí agregáty v organomagnéziových činidlech.[9]
Metody syntézy
Vinyljodidy se syntetizují způsoby, jako je například jodování a substituční reakce. Vinyljodidy s dobře definovanou geometrií (regiochemie a stereochemie ) jsou důležité při syntéze, protože mnoho přírodní produkty a léky které mají specifickou strukturu a rozměr. Příklad regiochemie je to, zda je jodid umístěn na alfa nebo beta pozici na olefinu. Stereochemie jako Zápis EZ nebo cis-trans alkenová geometrie je důležitá, protože některé přechodové kovyvazebné reakce, tak jako Spojka Suzuki, může zachovat geometrii olefinů. Při syntéze je užitečné zavést vinyljodid do různých poloh, které se nastaví pro kopulační reakci v dalším syntetickém kroku. Níže jsou uvedeny různé způsoby a metody při zavádění a syntéze vinyljodidů.
Syntéza z alkynů
Běžným a nejjednodušším přístupem k výrobě vinyljodidu je přidání jednoho ekvivalentu AHOJ na alkyn. Toto obecně dělá 2-jod-1-alkeny nebo a-vinyljodid Markovnikovovo pravidlo. Tato reakce se však neděje při dobrých rychlostech nebo velmi vysokých stereoselektivně.[10] Výsledkem je, že většina syntetických metod často zahrnuje a hydrometalace krok před přidáním zdroje I +.
α-vinyljodidy
Zavedení a-vinyljodidu z koncové polohy alkynu je obtížný krok. kromě toho může být vinylový kovový meziprodukt mírně nukleofilní, například vinylaluminium, může za katalytických podmínek vytvářet vazby C-C. Skupina Hoveyda však prokázala použití katalyzátoru na bázi niklu (Ni (dppp) Cl2), DIBAL-H s N-jodosukcinimid (NIS), selektivně upřednostňují α-vinyljodid s malými až žádnými vedlejšími produkty.[11] Také pozorovali reverzní selektivitu pro β s Ni (PPh3)2Cl2 v jejich hydroaluminace reakce za stejných podmínek s malým nebo žádným vedlejším produktem. Výhodou této metody je, že je levná (a komerčně dostupná), škálovatelná a reakce v jedné nádobě.

Jiná metoda nezahrnuje hydrometalace ale hydrojodace se mnou2/ hydrofosfinový binární systém, který vyvinula skupina Ogawa.[12]

Hydrojodace probíhá aduktem typu Markovnikovova typu, bez přidání hydrofosfinu není pozorována žádná reakce. V přijatelném mechanismu navrženém Ogawovou skupinou reaguje hydrofosfin s HI za vzniku intermediárního komplexu, který koordinuje HI za účelem provedení Markovnikovovy hydrojodace na alkenu. Výhodou tohoto systému je, že podmínky jsou mírné, snáší širokou škálu funkčních skupin.

β-vinyljodidy
Obvykle se jedná o více způsobů výroby β-vinyljodidů oproti použití α-vinyljodidů hydrometalace (s hliníkem s DIBAL-H (hydroaluminace ), s borem (hydroborace ), s HZrCp2Cl (hydrozirkonace )).[13] Nicméně, hydrometalace s alkynem s různými funkčními skupinami často špatně reagují s vedlejšími produkty. Skupiny Chong prokázaly použití hydrostanace pomocí Bu3SnH s palladiovým katalyzátorem s vysokou stereoselektivitou E.[13] Pozorovali pomocí stericky objemných ligandů, které poskytly vyšší regioselektivitu pro β-vinyljodid. Výhodou této techniky je, že tato technika může tolerovat širokou škálu funkčních skupin.
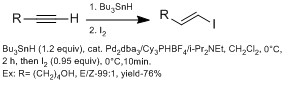
Zavádění Z-selektivních p-vinyljodidů je o něco obtížnější než u E-p-vinyljodidů, které často vyžadují více než jeden krok. Hydroaluminace a hydroborace obvykle postupují způsobem syn, proto selektivně upřednostňují E geometrii. Skupina Oshima prokázala použití hydroindikace s HInCl selektivně upřednostňuje geometrii Z.[14] Navrhli, že reakce probíhá radikálním mechanismem. Předpovídají, že HInCl se přidává k alkynu radikálním přidáním v geometrii Z. Neizomeruje se na E geometrii kvůli nízké reaktivitě radikálu InCl2 s intermediárním komplexem (bez druhého přidání). Pokud dojde k druhému přidání, pak dojde k izomerizaci diindium středně pokročilí. Potvrzují radikální mechanismus v mechanistické studii s cyklizací alkinu a alkenu.

Střídání
Střídání je možná nejužitečnější způsob zavedení vinyljodidu do molekuly. Výměna halogenů může být užitečná, protože vinyljodidy jsou reaktivnější než jiné vinylhalogenidy. Skupina Buchwald prokazuje za mírných podmínek výměnu halogenu z vinylbromidu na vinyljodid s měděným katalyzátorem.[15] Je možné, že tato metoda může tolerovat různé funkční skupiny protože tyto podmínky byly testovány arylhalogenidy zpočátku. Rozsah této výměny za regiochemie a stereochemie je v současné době neprozkoumaná.

Halogenovou výměnu lze provést také s deriváty zirkonia, které si zachovávají olefin Geometrie[16]

Marekova skupina dále zkoumala použití zirkoniového katalyzátoru na E nebo Z vinylethery, který je selektivní pro E-vinylethery.[16] Zirkonium oxofilní příroda umožňuje eliminaci alkoxy skupina v poloze β za vzniku intermediárního komplexu vinylzirkonia. Selektivita geometrie E není způsobena steriky, ale spíše sama reakce není koordinovaná. V mechanistické studii to pozorovali izomerizace, což naznačuje, že produkt geometrie E je výhodnější než geometrie Z. Rozdíl ve výsledcích mezi výměnou halogenu a reakcí s E-vinyletherem je ten, že pouze pokud je přítomna oxonium střední, je izomerizace pozorováno.


Zajímavou substituční reakcí je kyselina vinylboritá na vinyljodid provedená Brownovou skupinou.[17] V závislosti na pořadí přidání jodidu nebo báze, vinylu borát může přinést různé stereoizomery vinyljodidu (viz schéma 2a). Whitingova skupina si však všimla, že Brownova metoda není použitelná pro více stéricky bráněné boronové estery (žádná reakce).[18] Navrhli, aby zdroj jodidu nebyl dostatečně elektropozitivní. Rozhodli se tedy použít ICl což je polárnější než já2, ve kterém pozorovali podobné výsledky (viz schéma 2b).
Radikální substituce karboxylové kyseliny na jodid je prokázána modifikovanou Hunsdieckerova reakce.[19] Homolytický štěpení vazby O-I generuje CO2 a vinylový radikál. Vinyl radikál rekombinuje s jodidovým radikálem za vzniku vinyljodidu.
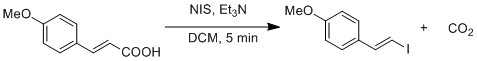
Jododilylace
Jododilylace je substituční reakce silyl skupina pro jodid. Výhodou jododesilylace je, že se vyhýbá toxickému činidlu cínu a meziproduktu vinylsilylu jsou stabilní, netoxické a snadno se s ním manipuluje a skladuje se. Vinyl silyl může být vyroben terminálním alkynem nebo jinými způsoby.
Skupina Kishi uvedla mírnou přípravu vinyljodidu z vinyl silylu pomocí NIS ve směsi acetonitril a chloracetonitril.[20] Pozorovali retenci geometrie olefinů v některých vinylových silylových substrátech, zatímco v jiných inverzi. Usoudili, že velikost skupiny R měla vliv na geometrii olefinů. Pokud je skupina R malá, je to rozpouštědlo acetonitril se mohou podílet na reakci vedoucí k inverzi geometrie olefinů. Pokud je skupina R velká, rozpouštědlo se nemůže účastnit, což vede k zachování geometrie olefinů

Zakarianova skupina se poté rozhodla provést reakci HFIP, což poskytlo vysokou retenci geometrie olefinů.[21] Usoudili, že HFIP je nízký nukleofilita na rozdíl od rozpouštědla acetonitril. Kromě toho pozorovali zrychlenou reakční rychlost, protože HFIP aktivoval NIS do vodíkové vazby.

Bohužel jododilylace za těchto podmínek (výše) může potenciálně poskytnout více vedlejších produktů ve vysoce funkcionalizovaných molekulách s kyslíkem funkční skupiny. Skupina Vilarrasa a Costa to předpokládali radikální reakce produkující AHOJ a já2 pomáhají usnadnit štěpení v alkoholu chránící skupina a může se přidat do dalších alkenových vazeb.[22] Experimentovali s využitím stříbrný návykové, jako je octan stříbrný a uhličitan stříbrný ve kterém může stříbro reagovat s přebytečným jodidem za vzniku jodid stříbrný. Nezaznamenali žádné vedlejší produkty se 100% přeměnou na produkty a zvýšenými výnosy.
Pojmenujte reakce
Některé slavné způsoby syntézy vinyljodidu zahrnují konverzi aldehyd nebo keton na vinyljodid. Barton hydrazonová jodace metoda zahrnuje přidání hydraziny na aldehyd nebo keton tvořit hydrazon. Pak hydrazon se převádí na vinyljodid přidáním jodidu a DBU.[23][24] Tato metoda byla použita při syntéze přírodních produktů Taxol od Danishefsky[25] a Kortistatin A od Shaira.[26]Další metodou je Takai olefinace který používá jodoform a chlorid chromitý k výrobě vinyljodidu z aldehydu s vysokým obsahem stereoselektivita pro geometrii E.[27] Pro vysoké stereoselektivita pro geometrii Z, Olefinace čáp-čao výtěžek Wittig -jako reakce. Vysoké výnosy a Z stereoselektivita došlo při nízké teplotě a za přítomnosti HMPA.[28]
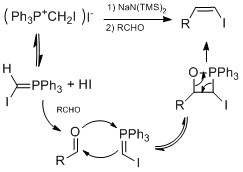
Níže je uveden příklad použití jak olefinace Takai, tak olefinace Stork-Zhao v celkové syntéze (+) - 3- (E) - a (+) - 3- (Z) -pinnatifidenynu.[29]

Metoda eliminace
Vinyljodidy jsou zřídka prováděny eliminační reakcí vicinální dijodid protože má tendenci se rozkládat na alken a jodid.[30] Bakerova skupina prokázala použití dekarboxylace, může dojít k eliminaci.[31]

Reference
- ^ Xie, Meihua a kol. „Regio- a stereospecifická syntéza vinylhalogenidů prostřednictvím karbozinace acetylenových sulfonů s následnou halogenací.“ Journal of Organometallic Chemistry 694,14 (2009): 2258-2262.
- ^ A b Klein, David. Organická chemie. John Wiley & Sons, 15. června 2011. Kniha Google. Čt 28. listopadu 2013. https://books.google.com/books?id=SsX9pbarkQkC&source=gbs_navlinks_s
- ^ Bhupinder, Mehta; Manju, Mehta. Organická chemie. PHI Learning Pvt. Ltd., 1. ledna 2005. Kniha Google. Čt 28. listopadu 2013. https://books.google.com/books?id=QV6cwXA9XkEC&source=gbs_navlinks_s
- ^ Blanksby, Stephen J. a G. Barney Ellison. „Bond disociační energie organických molekul.“ Účty chemického výzkumu 36,4 (2003): 255-263
- ^ Herman, Jan A. a Pierre Roberge. „Rentgenová polymerace vinyljodidu v roztoku.“ Journal of Polymer Science 62,174 (1962): S116-S118.
- ^ Zhang, Xing a kol. „Účinná cis-redukce alkinu na alken v přítomnosti vinyljodidu: stereoselektivní syntéza fragmentu C22-C31 leiodolidu A.“ Tetrahedron (2012).
- ^ Denton, Richard W. a Kathlyn A. Parker. "Kompatibilita funkčních skupin. Snížení propargylalkoholu v přítomnosti vinyljodidu." Organické dopisy 11.13 (2009): 2722-2723.
- ^ A b Rottlander, M .; Boymond, L .; Cahiez, G .; Knochel, P. J. Org. Chem. 1999. 64, 1080
- ^ Ren, H .; Krasovskiy, A .; Knochel, P. Org. Lett. 2004, 6, 4215
- ^ Kropp, P. J .; Crawford, S. D. J. Org. Chem. 1994, 59, 3102.
- ^ Gao, Fang a Amir H. Hoveyda. „α-Selektivní Ni-Katalyzovaná Hydroaluminace Aryl- a Alkylem Substituovaných Terminálních Alkynů: Praktická Syntéza Interních Vinylových Aluminií, halogenidů nebo Boronátů.“ Journal of the American Chemical Society 132,32 (2010): 10961-10963.
- ^ Kawaguchi, Shin-ichi a Akiya Ogawa. „Vysoce selektivní hydrojodace alkylů pomocí binárního systému jod-hydrofosfin.“ Organic Letters 12.9 (2010): 1893-1895.
- ^ A b Chong, J .; Darwish, Allo. Tetrahedron, svazek 68, vydání 2, 14. ledna 2012, strany 654-658
- ^ Takami, Kazuaki a kol. „Hydrogalace a hydroindikace zprostředkovaná triethylboranem: nový přístup k organogáliu a organoindiu.“ The Journal of Organic Chemistry 68,17 (2003): 6627-6631.
- ^ Klapars, Artis a Stephen L. Buchwald. „Měď katalyzovaná výměna halogenů v arylhalogenidech: aromatická Finkelsteinova reakce.“ Journal of the American Chemical Society 124,50 (2002): 14844-14845.
- ^ A b Liard, Annie a Ilan Marek. „Stereoselektivní příprava derivátů E vinylzirkonia z E nebo Z enol etherů.“ The Journal of organic chemistry 65.21 (2000): 7218-7220.
- ^ Brown, H. C; Hamaoka, T .; a Ravindran, N .; J. Am. Chem. Soc., 1973, 95, 5786
- ^ Stewart, Sarah K. a Andrew Whiting. „Stereoselektivní syntéza vinyljodidů z esterů vinylboronátu pinacolu pomocí ICI.“ Tetrahedron letters 36.22 (1995): 3929-3932.
- ^ Das, Jaya Prakash a Sujit Roy. „Katalytická Hunsdieckerova reakce α, β-nenasycených karboxylových kyselin: jak efektivní je katalyzátor?“ The Journal of Organic Chemistry 67,22 (2002): 7861-7864.
- ^ Stamos, D. P .; Taylor, A. G.; Kishi, Y; Tetrahedron Lett. 1996, 37 (48), 8647-8650
- ^ Ilardi, E. A .; Stivala, C.E .; Zakarian, A., Organic Letters. 2008, 10 (9), 1727-1730
- ^ Vilarrasa, J; Sidera M; Organic Letters, 2012, 13, 4934-4937
- ^ Barton, D. H. R., R. E. O'Brien a S. Sternhell Journal of the Chemical Society, 1962, 470 - 476
- ^ Barton, D. H. R .; Bashiardes, G .; Fourrey, J.-L. Tetrahedron 1988, 44, 147
- ^ Danishefsky, Samuel J. a kol. „Celková syntéza baccatinu III a taxolu.“ Journal of the American Chemical Society 118.12 (1996): 2843-2859
- ^ Lee, Hong Myung, Cristina Nieto-Oberhuber a Matthew D. Shair. „Enantioselektivní syntéza (+) - kortistatinu A, silného a selektivního inhibitoru proliferace endoteliálních buněk.“ Journal of the American Chemical Society 130.50 (2008): 16864-16866
- ^ Jednoduchá a selektivní metoda pro konverzi aldehydů (RCHO) -> (E) -haloalkenů (RCH: CHX) pomocí chloridového systému haloform-chromatý K. Takai, K. Nitta, K. Utimoto J. Am. Chem. Soc .; 1986; 108 (23); 7408–7410
- ^ Čáp, Gilbert a Kang Zhao. „Stereoselektivní syntéza (Z) -1-jod-1-alkenů.“ Tetrahedron Letters 30.17 (1989): 2173-2174.
- ^ Kim, Hyoungsu a kol. „Konstrukce osmičlenných etherových kruhů interní alkylací závislou na geometrii olefinů: První asymetrické celkové syntézy (+) - 3- (E) - a (+) - 3- (Z) -pinnatifidenynu.“ Journal of the American Chemical Society 125.34 (2003): 10238-10240.
- ^ Ley, Steven. Syntéza: Carbon with One Heteroatom Attached by a Single Bond, Volume 2. Elsevier, 1995. Kniha Google. Čt 28. listopadu 2013. https://books.google.com/books?id=BPcxrmIgLKMC
- ^ 30. Baker, Raymond a Jose L. Castro. "Celková syntéza (+) - makbecinu I." J. Chem. Soc., Perkin Trans. 11 (1990): 47-65.

