Arylhalogenid - Aryl halide
v organická chemie, an arylhalogenid (také známý jako haloaren nebo halogenaren) je aromatická sloučenina, ve které je jeden nebo více atomů vodíku přímo navázáno na aromatický prsten jsou nahrazeny a halogenid. Haloaren se liší od halogenalkany protože vykazují mnoho rozdílů ve způsobech přípravy a vlastnostech. Nejdůležitějšími členy jsou arylchloridy, ale třída sloučenin je tak široká, že mnoho derivátů má specializované aplikace.
Příprava
Dvěma hlavními způsoby přípravy arylhalogenidů jsou přímá halogenace a diazoniové soli.[1]
Přímá halogenace
V Friedel-Craftsova halogenace, Lewisovy kyseliny sloužit jako katalyzátory. Používá se mnoho chloridů kovů, například příklady chlorid železitý nebo chlorid hlinitý. Nejdůležitější arylhalogenid, chlorbenzen je produkován touto cestou. Monochlorace benzenu je vždy doprovázena tvorbou derivátů dichlorbenzenu.[2]
Areny se skupinami poskytujícími elektrony reagují s halogeny i v nepřítomnosti Lewisových kyselin. Například fenoly a aniliny rychle reagují s chlorem a bromovou vodou za vzniku více halogenovaných produktů.[3] Odbarvování bromové vody areny bohatými na elektrony se používá v bromový test.
Přímá halogenace arenů je možná za přítomnosti světla nebo při vysoké teplotě. U alkylbenzenových derivátů mají alkylové polohy tendenci být halogenovány nejprve při halogenaci volných radikálů. K halogenaci kruhu jsou nutné Lewisovy kyseliny a je třeba vyloučit světlo, aby se zabránilo konkurenční reakci.[1]
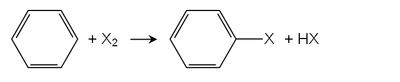
Sandmeyerovy, Balz-Schiemannovy a Gattermannovy reakce
Druhou hlavní trasou je Sandmeyerova reakce. Aniliny (arylaminy) se převádějí na jejich diazoniové soli použitím kyselina dusitá. Například, chlorid měďnatý převádí diazoniové soli na arylchlorid. Plynný dusík je odstupující skupina, což činí tuto reakci velmi příznivou. Podobný Schiemannova reakce používá tetrafluorborát anion jako donor fluoridů. Gattermanovu reakci lze také použít k přeměně diazoniové soli na chlorbenzen nebo brombenzen použitím měděného prášku místo chloridu měďnatého nebo bromidu měďnatého. To však musí být provedeno v přítomnosti HCl a HBr.
Halogenace v přírodě
Arylhalogenidy se v přírodě vyskytují široce, nejčastěji je produkují mořské organismy, které využívají chlorid a bromid ve vodách oceánu. Četné jsou také chlorované a bromované aromatické sloučeniny, např. deriváty tyrosinu, tryptofanu a různých derivátů pyrrolu. Některé z těchto přirozeně se vyskytujících arylhalogenidů vykazují užitečné léčivé vlastnosti.[4][5]


Strukturální trendy
Vzdálenosti C-X pro arylhalogenidy sledují očekávaný trend. Tyto vzdálenosti pro fluorobenzen, chlorbenzen, brombenzen a methyl-4-jodbenzoát jsou 135,6 (4), 173,90 (23), 189,8 (1) a 209,9 odpoledne, resp.[6]
Reakce
Střídání
Na rozdíl od typických alkylhalogenidů se arylhalogenidy konvenčně neúčastní SN2 reakce, protože útok na zadní stranu je vyžadován pro S.N2 reakce je nemožná kvůli plošné struktuře arylové skupiny. SN1 reakce jsou teoreticky možné, ale nejsou obecně pozorovány, protože tvorba arylového kationtu není energeticky příznivá.
Avšak arylhalogenidy se skupinami přitahujícími elektrony v ortho a odst pozic, může podstoupit SNAr reakce. Například 2,4-dinitrochlorbenzen může reagovat s vodou v zásaditém roztoku za vzniku fenolu:

Na rozdíl od většiny ostatních substitučních reakcí je fluorid nejlepší odstupující skupinou a jodid nejhorší kvůli vysoké elektronegativitě fluoridu, která umožňuje lepší stabilizaci přechodového stavu určujícího rychlost, což vede k záporně nabitému Meisenheimerovu meziproduktu. Práce v roce 2016 navrhla, aby společný mechanismus posunu (podobný přední straně SN2 vytěsnění) je možné v případě fluoridového vytěsnění odstupující skupiny aktivovaného kyslíku. V tomto mechanismu je Meisenheimerův „meziprodukt“ ve skutečnosti pouze přechodovým stavem, nikoli skutečným meziproduktem.[7] Dokument z roku 2018 naznačuje, že tato situace může být ve skutečnosti poměrně běžná, vyskytující se v systémech, u nichž se dříve předpokládalo, že budou postupovat prostřednictvím S.NAr mechanismy.[8]
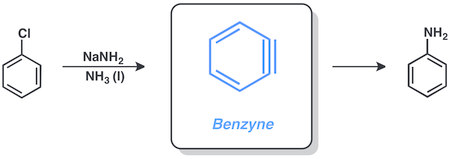
Benzyně
Arylhalogenidy jsou schopné provádět reakce prostřednictvím benzyně mechanismus, zahrnující amid sodný v kapalině amoniak. Chlorbenzen lze například převést na anilin za těchto podmínek.
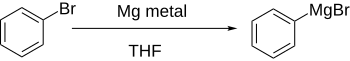
Tvorba organokovového činidla
Arylhalogenidy obecně reagují s kovy lithium nebo hořčík, za vzniku reaktivnějších derivátů, které se chovají jako zdroje arylových aniontů.
Přímá tvorba Grignardova činidla přidáním hořčíku k arylhalogenidu v etherickém roztoku funguje dobře, pokud aromatický kruh není významně deaktivován skupinami, které přitahují elektrony.
Sloučeniny, jako je para-bromnitrobenzen, nemohou přímo vytvářet stabilní Grignardovy sloučeniny, protože jejich aromatické kruhy jsou příliš deaktivované. Pokud je takový Grignard potřebný, obvykle se vyrábí výměnou hořčík-halogen zahrnující isopropylmagnesiumchlorid při -78 ° C. Tato reakce probíhá, protože pKA aromatických protonů je mnohem nižší - obvykle kolem 45, zatímco u alifatického alkanu přesahuje 50. Grignardovy reakce vyrobené tímto způsobem se obvykle používají okamžitě, aby se zabránilo rozkladu.
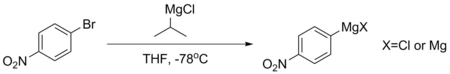
Další reakce
Halogenidy mohou být nahrazeny silnými nukleofily reakcemi zahrnujícími radikální anionty. Alternativně podléhají arylhalogenidy, zejména bromidy a jodidy oxidační přísada, a tedy podléhají Aminace Buchwald-Hartwig - reakce typu.
Chlorbenzen byl kdysi jeho předchůdcem fenol, který se nyní vyrábí oxidací kumen. Při vysokých teplotách arylové skupiny reagují s amoniakem za vzniku anilinů.[2]
Biologický rozklad
Rhodococcus phenolicus je druh bakterie schopný degradovat dichlorbenzen jako jediný zdroj uhlíku.[9]
Aplikace
Arylhalogenidy produkované v největším měřítku jsou chlorbenzen a izomery dichlorbenzenu. Jednou z hlavních, ale přerušených aplikací bylo použití chlorbenzenu jako rozpouštědla pro dispergování herbicidu Lasso. Celkově produkce arylchloridů (také naftylových derivátů) od 80. let 20. století klesá, částečně kvůli problémům s životním prostředím.[2] Trifenylfosfin se vyrábí z chlorbenzenu:
- 3 C.6H5Cl + PCl3 + 6 Na → P (C.6H5)3 + 6 NaCl
Arylbromidy jsou široce používány jako retardéry hoření. Nejvýznamnějším členem je tetrabrombisfenol-A, který se připravuje přímou bromací difenolu.[10]
Reference
- ^ A b Boyd, Robert W .; Morrison, Robert (1992). Organická chemie. Englewood Cliffs, NJ: Prentice Hall. str. 947. ISBN 978-0-13-643669-0.
- ^ A b C Beck, U .; Löser, E. (2011). „Chlorované benzeny a jiné aromatické uhlovodíky chlorované na jádro“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.o06_o03. ISBN 978-3527306732.
- ^ Ilustrativní postup chlorace aromatické sloučeniny:Edward R. Atkinson; Donald M. Murphy; James E. Lufkin (1951). "kyselina dl-4,4 ', 6,6'-tetrachlorodifenová". Organické syntézy.; Kolektivní objem, 4, str. 872
- ^ Fujimori, Danica Galonić; Walsh, Christopher T. (2007). „Co je nového v enzymatických halogenacích“. Aktuální názor na chemickou biologii. 11 (5): 553–60. doi:10.1016 / j.cbpa.2007.08.002. PMC 2151916. PMID 17881282.
- ^ Gribble, Gordon W. (2004). „Přírodní organohalogeny: nová hranice pro léčivé látky?“. Journal of Chemical Education. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. doi:10.1021 / ed081p1441.
- ^ Oberhammer, Heinz (2009). "Strukturní chemie uhlík-halogenových vazeb". Chemie funkčních skupin PATai. doi:10.1002 / 9780470682531.pat0002. ISBN 978-0-470-68253-1.
- ^ Ritter, Tobias; Hooker, Jacob M .; Neumann, Constanze N. (červen 2016). „Koncentrovaná nukleofilní aromatická substituce s 19F− a 18F−“. Příroda. 534 (7607): 369–373. Bibcode:2016Natur.534..369N. doi:10.1038 / příroda17667. ISSN 1476-4687. PMC 4911285. PMID 27281221.
- ^ Jacobsen, Eric N .; Harrison A. Besser; Zeng, Yuwen; Kwan, Eugene E. (září 2018). "Sloučené nukleofilní aromatické substituce". Přírodní chemie. 10 (9): 917–923. doi:10.1038 / s41557-018-0079-7. ISSN 1755-4349. PMC 6105541. PMID 30013193.
- ^ Rehfuss, Marc; Urban, James (2005). "Rhodococcus phenolicus sp. nov., nový bioprocesor izolovaný aktinomycety se schopností odbourávat chlorbenzen, dichlorbenzen a fenol jako jediný zdroj uhlíku “. Systematická a aplikovaná mikrobiologie. 28 (8): 695–701. doi:10.1016 / j.syapm.2005.05.011. PMID 16261859.
- ^ Ioffe, D .; Kampf, A. (2002). "Brom, organické sloučeniny". Kirk-Othmer Encyclopedia of Chemical Technology. doi:10.1002 / 0471238961.0218151325150606.a01. ISBN 978-0471238966.
