Tris (bipyridin) ruthenium (II) chlorid - Tris(bipyridine)ruthenium(II) chloride
 | |
 | |
 | |
| Jména | |
|---|---|
| Ostatní jména Ru-Bpy Ruthenium-tris (2,2’-bipyridyl) dichlorid | |
| Identifikátory | |
| |
| Informační karta ECHA | 100.034.772 |
| Číslo RTECS |
|
Řídicí panel CompTox (EPA) | |
| Vlastnosti | |
| C30H24N6Cl2Ru · 6H2Ó | |
| Molární hmotnost | 640,53 g / mol (bezvodý) 748,62 g / mol (hexahydrát) |
| Vzhled | červená pevná látka |
| Hustota | pevný |
| Bod tání | > 300 ° C |
| málo rozpustný ve vodě; rozpustný v acetonu | |
| Struktura | |
| Osmistěn | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | mírně toxický |
| Bezpečnostní list | Externí bezpečnostní list |
| R-věty (zastaralý) | žádný |
| S-věty (zastaralý) | S22 S24 / 25 |
| Související sloučeniny | |
Související sloučeniny | Chlorid ruthenitý 2,2'-bipyridin |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tris (bipyridin) ruthenium (II) chlorid je chloridová sůl koordinační komplex se vzorcem [Ru (bpy)3]2+. Tato červená krystalická sůl se získá jako hexahydrát, ačkoli všechny zájmové vlastnosti jsou v kation [Ru (bpy)3]2+, kterému byla věnována velká pozornost kvůli jeho výrazným optickým vlastnostem. Chloridy lze nahradit jinými anionty, jako PF6−.
Syntéza a struktura

Tato sůl se připravuje zpracováním vodného roztoku chlorid ruthenitý s 2,2'-bipyridin. V této konverzi se Ru (III) redukuje na Ru (II) a kyselina fosforná se obvykle přidává jako redukční činidlo.[1] [Ru (bpy)3]2+ je oktaedrický, obsahující centrální nízký spin d6 Ru (II) ion a tři bidentátní bpy ligandy. Vzdálenosti Ru-N jsou 2,053 (2), kratší než vzdálenosti Ru-N pro [Ru (bpy)3]3+.[2] Komplex je chirální, s D.3 symetrie. Bylo vyřešeno do svého enantiomery. Předpokládá se, že ve svém excitovaném stavu s nejnižším ležícím tripletem dosahuje molekula nižší C2 symetrie, protože excitovaný elektron je lokalizován primárně na jediném bipyridylovém ligandu.[3][4]
Fotochemie [Ru (bpy)3]2+
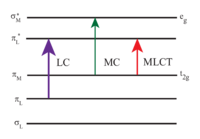
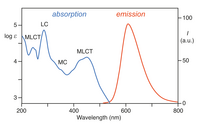
[Ru (bpy)3]2+ absorbuje ultrafialový a viditelné světlo. Vodné roztoky [Ru (bpy)3] Cl2 jsou oranžové kvůli silné MLCT absorpce při 452 ± 3 nm (koeficient zániku 14 600 M−1cm−1). Další absorpční pásy se nacházejí při 285 nm, což odpovídá ligandu se středem π*← π přechody a slabý přechod kolem 350 nm (přechod d-d).[5] Absorpce světla vede k tvorbě vzrušený stav mají relativně dlouhou životnost 890 ns v acetonitrilu[6] a 650 ns ve vodě.[6] Vzrušený stav se uvolňuje základní stav podle emise a foton nebo neradiační relaxace. The kvantový výnos je 2,8% ve vodě nasycené vzduchem při 298 K a emisním maximu vlnová délka je 620 nm.[7] Dlouhá životnost vzrušeného stavu je přičítána skutečnosti, že je trojice zatímco základní stav je a stav singletu a částečně kvůli skutečnosti, že struktura molekuly umožňuje oddělení náboje. Přechody singlet-triplet jsou zakázány, a proto často pomalý.
Stejně jako všechny molekulární excitované stavy, i triplet excitovaný stav [Ru (bpy)3]2+ má silnější oxidační i redukční vlastnosti než základní stav. Tato situace nastává, protože vzrušený stav lze popsat jako Ru3+ komplex obsahující bpy·− radikální anion jako ligand. Fotochemické vlastnosti [Ru (bpy)3]2+ připomínají fotosyntetická montáž, což zahrnuje také oddělení elektron a a otvor.[8]
[Ru (bpy)3]2+ byl zkoumán jako fotosenzibilizátor pro oxidaci i redukci vody. Po absorpci fotonu [Ru (bpy)3]2+ konvertuje do výše uvedeného stavu tripletů, označeno [Ru (bpy)3]2+*. Tento druh přenáší elektron umístěný na jednom ligandu bpy na obětní oxidant, jako je např peroxodisíran (S.2Ó82−). Výsledný [Ru (bpy)3]3+ je silný oxidant a oxiduje vodu na O2 a protony přes a katalyzátor.[9] Alternativně může být redukční síla [Ru (bpy)3]2+* lze využít ke snížení methylviologen, recyklovatelný nosič elektronů, který zase snižuje protony v a Platina katalyzátor. Aby byl tento proces katalytický, obětavé redukční činidlo, jako je např EDTA4− nebo triethanolamin je poskytována k vrácení Ru (III) zpět do Ru (II).
Deriváty [Ru (bpy)3]2+ je jich mnoho.[10][11] Takové komplexy jsou široce diskutovány pro aplikace v biodiagnostice, fotovoltaika a organická světelná dioda, ale žádný derivát nebyl komercializován. Aplikace [Ru (bpy)3]2+ a jeho deriváty k výrobě optické chemikálie senzory je pravděpodobně jednou z dosud nejúspěšnějších oblastí.[12]
[Ru (bpy)3]2+ a katalýza fotoredoxem
Katalýza fotoredoxem pomocí kombinace [Ru (bpy)3]2+ katalyzátor a viditelné světlo je strategie pro organickou syntézu.[13] Od roku 2008 vývoj těchto reakcí tvořících vazby.[14][13][15][16][17]
Bezpečnost
Kovový bipyridin, stejně jako příbuzné fenanthrolin komplexy jsou obecně bioaktivní, protože mohou působit jako interkalační činidla.
Reference
- ^ Broomhead J. A .; Mladý C. G. (1990). Tris (2,2'-bipyridin) ruthenium (II) dichlorid hexahydrát. Anorganické syntézy. 28. str. 338–340. doi:10.1002 / 9780470132593.ch86. ISBN 9780470132593.
- ^ Biner, M .; Buergi, H. B .; Ludi, A .; Roehr, C. (1. června 1992). "Krystalické a molekulární struktury [Ru (bpy) 3] (PF6) 3 a [Ru (bpy) 3] (PF6) 2 při 105 K". J. Am. Chem. Soc. 114 (13): 5197–5203. doi:10.1021 / ja00039a034.
- ^ Yeh, Alvin T .; Charles V. Shank; James K. McCusker (2000). „Ultrarychlá dynamika lokalizace elektronů po přenosu náboje vyvolaného fotografiemi“. Věda. 289 (5481): 935–938. CiteSeerX 10.1.1.612.8363. doi:10.1126 / science.289.5481.935. PMID 10937993.
- ^ Thompson, David W .; Ito, Akitaka; Meyer, Thomas J. (30. června 2013). „[Ru (bpy) 3] 2 + * a další významné vzrušené stavy přenosu náboje kov na ligand (MLCT)“. Čistá a aplikovaná chemie. 85 (7): 1257–1305. doi:10.1351 / PAC-CON-13-03-04. S2CID 98792207.
- ^ Kalyanasundaram, K. (1982). „Fotofyzika, fotochemie a přeměna sluneční energie s tris (bipyridyl) rutheniem (II) a jeho analogy“. Recenze koordinační chemie. 46: 159–244. doi:10.1016/0010-8545(82)85003-0.
- ^ A b Montalti, Marco; Alberto Cedi; Luca Prodi; M. Teresa Gandolfi (2006). Příručka fotochemie (3. vyd.). 6000 Broken Sound Prkway NW, Suite 200 Boca Raton, FL: CRC press Taylor & Francis Group. str.379 –404. ISBN 978-0-8247-2377-4.CS1 maint: umístění (odkaz)
- ^ Nakamaru, Katsumi (1982). „Syntéza, kvantové výtěžky luminiscence a doby životnosti komplexů trischelovaného ruthenia (II) se smíšeným ligandem, včetně 3,3'-dimethy1-2,2'-bipyridylu“. Bulletin of the Chemical Society of Japan. 55 (9): 2697. doi:10,1246 / bcsj.55.2697.
- ^ A. J. Bard a M. A. Fox (1995). "Umělá fotosyntéza: sluneční štěpení vody na vodík a kyslík". Acc. Chem. Res. 28 (3): 141–145. doi:10.1021 / ar00051a007.
- ^ M. Hara; C. C. Waraksa; J. T. Lean; B. A. Lewis a T. E. Mallouk (2000). „Photocatalytic Water Oxidation in a Buffered Tris (2,2'-bipyridyl) ruthenium Complex-Colloidal IrO2 System“. J. Phys. Chem. A. 104 (22): 5275–5280. CiteSeerX 10.1.1.547.1886. doi:10.1021 / jp000321x.
- ^ A. Juris; V. Balzani; F. Barigelletti; S. Campagna; P. Belser a A. von Zelewsky (1988). „Ru (II) polypyridinové komplexy - fotofyzika, fotochemie, elektrochemie a chemiluminiscence“. Coord. Chem. Rev. 84: 85–277. doi:10.1016/0010-8545(88)80032-8.
- ^ S. Campagna; F. Puntoriero; F. Nastasi; G. Bergamini a V. Balzani (2007). Fotochemie a fotofyzika koordinačních sloučenin: ruthenium. Horní. Curr. Chem. Témata ze současné chemie. 280. 117–214. doi:10.1007/128_2007_133. ISBN 978-3-540-73346-1.
- ^ G. Orellana a D. Garcia-Fresnadillo (2004). Environmentální a průmyslové optosenzování s přizpůsobenými luminiscenčními Ru (II) polypyridyl komplexy. Springer Ser. Chem. Sens. Biosens. 1. 309–357. doi:10.1007/978-3-662-09111-1_13. ISBN 978-3-642-07421-9.
- ^ A b F. Teply (2011). "Photoredoxová katalýza pomocí [Ru (bpy) 3] 2+ ke spuštění transformací organických molekul. Organická syntéza pomocí fotokatalýzy ve viditelném světle a jejích kořenů 20. století". Sbírat. Czech Chem. Commun. 76 (7): 859–917. doi:10.1135 / cccc2011078.
- ^ D. A. Nicewicz; D. W. C. MacMillan (2008). „Sloučení katalýzy fotoredoxu s organokatalýzou: přímá asymetrická alkylace aldehydů“. Věda. 322 (5898): 77–80. doi:10.1126 / science.1161976. PMC 2723798. PMID 18772399.
- ^ J. M. R. Narayanam; C. R. J. Stephenson (2011). "Katalýza fotoredoxem ve viditelném světle: aplikace v organické syntéze". Chem. Soc. Rev. 40 (1): 102–113. doi:10.1039 / b913880n. PMID 20532341.
- ^ T. P. Yoon; M. A. Ischay; J. Du (2010). "Viditelné světlo fotokatalýza jako zelenější přístup k fotochemické syntéze". Nat. Chem. 2 (7): 527–532. doi:10,1038 / nchem.687. PMID 20571569.
- ^ Romero, Nathan A .; Nicewicz, David A. (10. června 2016). „Organic Photoredox Catalysis“. Chemické recenze. 116 (17): 10075–10166. doi:10.1021 / acs.chemrev.6b00057. PMID 27285582.
