Nukleosid fosforamidit - Nucleoside phosphoramidite

Nukleosidové fosforamidity jsou deriváty přírodních nebo syntetických nukleosidy. Jsou zvyklí syntetizovat oligonukleotidy, relativně krátké fragmenty nukleová kyselina a jejich analogy. Nukleosidové fosforamidity poprvé zavedly v roce 1981 Beaucage a Caruthers.[1] Aby se zabránilo nežádoucím vedlejším reakcím, jsou odpovídajícím způsobem chráněny reaktivní hydroxy a exocyklické aminoskupiny přítomné v přírodních nebo syntetických nukleosidech. Pokud nukleosidový analog obsahuje alespoň jednu hydroxyskupinu, použití vhodné ochranné strategie umožňuje převést jej na příslušný fosforamidit a začlenit jej do syntetických nukleových kyselin. Aby mohl být nukleosidový analog začleněn do středu oligonukleotidového řetězce pomocí fosforamiditové strategie, musí obsahovat dvě hydroxyskupiny nebo méně často hydroxyskupinu a jinou nukleofilní skupinu (amino nebo merkapto). Mezi příklady patří mimo jiné: alternativní nukleotidy, LNA, morfolino, nukleosidy modifikované v 2'-poloze (OMe, chráněný NH2, F), nukleosidy obsahující nekanonické báze (hypoxanthin a xanthin obsažené v přírodních nukleosidech inosin a xanthosin tricyklické báze, jako je G-clamp,[2] atd.) nebo báze derivatizované fluorescenční skupinou nebo linkerovým ramenem.
Příprava
Existují tři hlavní způsoby přípravy nukleosidových fosforamiditů.
- Běžná metoda zahrnuje zpracování chráněného nukleosidu nesoucího jednu volnou hydroxyskupinu fosforodiamiditem za katalytického působení slabé kyseliny.[3][4] Ačkoli byly některé bisamidity označovány jako tepelně nestabilní sloučeniny,[5] 2-kyanoethyl N, N, N ', N'-tetraisopropylfosforodiamidit, amidit používaný k přípravě komerčních nukleosidových fosforamiditů je relativně stabilní. Může být syntetizován pomocí dvoustupňového postupu v jedné nádobě a čištěn pomocí vakuum destilace.[6] Vynikající přehled podrobně popisuje použití posledně uvedeného činidla při přípravě nukleosidových a nenukleosidových fosforamiditů.[7]
 DMT = 4,4'-dimethoxytrityl; B = volitelně chráněná nukleová báze; R = skupina chránící fosfát
DMT = 4,4'-dimethoxytrityl; B = volitelně chráněná nukleová báze; R = skupina chránící fosfát
- Ve druhé metodě je chráněný nukleosid zpracován fosforochloriditem v přítomnosti organické báze, nejčastěji N-ethyl-N, N-diisopropylamin (Hunigova základna).[8]

- Ve třetí metodě[9] chráněný nukleosid se nejprve zpracuje chlor-N, N, N ', N'-tetraisopropylfosforodiamiditem v přítomnosti organické báze, nejčastěji N-ethyl-N, N-diisopropylaminu (Hunigova báze) za vzniku chráněného nukleosidového diamiditu. Ten se zpracuje s alkoholem odpovídajícím požadované skupině chránící fosforitany, například 2-kyanoethanolem, v přítomnosti slabé kyseliny.

Nukleosidové fosforamidity se čistí pomocí sloupcová chromatografie na silikonový gel. Aby se zajistila stabilita fosforamiditové části, doporučuje se kolonu ekvilibrovat eluentem obsahujícím 3 až 5% triethylaminu a udržovat tuto koncentraci v eluentu po celou dobu dělení. Čistotu fosforamiditu lze hodnotit pomocí 31P NMR spektroskopie. Protože atom P (III) v nukleosidovém fosforamiditu je chirální, vykazuje dva píky při přibližně 149 ppm, což odpovídá dvěma diastereomerům sloučeniny. Potenciálně přítomná nečistota fosfit triesteru vykazuje maximum 138–140 ppm. Nečistoty H-fosfonátu vykazují vrcholy při 8 a 10 ppm.
Chemické vlastnosti fosforamiditové skupiny
Nukleosidové fosforamidity jsou relativně stabilní sloučeniny s prodlouženou skladovatelností, pokud jsou skladovány jako prášky za bezvodých podmínek v nepřítomnosti vzduchu při teplotách pod 4 ° C. Amidity vydrží mírné základní podmínky. Naproti tomu v přítomnosti dokonce mírných kyselin fosforamidity téměř okamžitě zahynou. Fosforamidity jsou relativně stabilní vůči hydrolýze za neutrálních podmínek. Například, poločas rozpadu 2-kyanoethyl 5'-Ó- (4,4'-dimethoxytrityl)thymidin -3'-Ó- (N, N-diisopropylamino) fosfit v 95% vodném roztoku acetonitril při 25 ° C je 200 h.[10]
- Nejdůležitější vlastností fosforamiditů je jejich schopnost podstoupit fosforamiditovou kopulační reakci, tj. Reagovat s nukleofilními skupinami v přítomnosti kyselé azol katalyzátor, 1H-tetrazol, 2-ethylthiotetrazol,[11] 2-benzylthiotetrazol,[12][13] 4,5-dikyanoimidazol,[14] nebo řada podobných sloučenin. Reakce probíhá extrémně rychle. Právě díky této vlastnosti jsou nukleosidové fosforamidity užitečné meziprodukty syntéza oligonukleotidů. Stereochemicky vede fosforamiditová vazba k epimerizace (formování diastereomery ) v chirálním centru P (III).
 X = O, S, NH.
X = O, S, NH.
Když se voda podává jako nukleofil, je produktem H-fosfonát diester, jak je uvedeno ve schématu výše. Vzhledem k přítomnosti zbytkové vody v rozpouštědlech a činidlech je tvorba druhé sloučeniny nejčastější komplikací při přípravném použití fosforamiditů, zejména při syntéze oligonukleotidů.
- Fosforamidity se snadno oxidují slabými oxidačními činidly, například vodným jodem v přítomnosti slabých zásad nebo peroxid vodíku[15] za vzniku příslušných fosforamidátů.
 X = S, Se.
X = S, Se.
Podobně fosforamidity reagují s jinými chalkogeny. Při kontaktu s roztokem síry[15][16] nebo řada sloučenin souhrnně označovaných jako sirné látky,[17][18] fosforamidity kvantitativně tvoří fosforothioamidáty. Reakce se selenem[15][16] nebo deriváty selenu[19] produkuje fosforoselenoamidáty. U všech reakcí tohoto typu je zachována konfigurace na atomu fosforu.
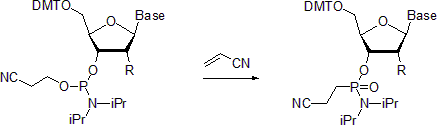
- Nukleosidové fosforamidity podléhají Michaelis-Arbuzovova reakce za vzniku příslušných fosfonamidátů. Jeden příklad popisuje přípravu fosfonamidátů v přítomnosti akrylonitrilu.[20] Údajně je při teplotě místnosti reakce stereoselektivní se zachováním konfigurace ve středu fosforu. Naproti tomu při provádění při 55 ° C vede reakce k racemizovaný produkty.
- Podobně jako fosfiny a terciární fosfity snadno podléhají fosforamidity Staudingerova reakce.
(RO)2P-N (R.1)2 + R.2-N3 + H2O ---- (RO)2P (= O) -N (R.1)2 + R.2-NH2 + N2;
Strategie ochrany
Přirozeně se vyskytující nukleotidy (nukleosid-3'- nebo 5'-fosfáty) a jejich fosfodiesterové analogy nejsou dostatečně reaktivní, aby poskytly rychlou syntetickou přípravu oligonukleotidů ve vysokých výtěžcích. Selektivita a rychlost tvorby internukleosidových vazeb se dramaticky zlepšují použitím 3'-Ó-(N,N-diisopropylfosforamidit) deriváty nukleosidů (nukleosidové fosforamidity), které slouží jako stavební kameny v metodice triesteru fosfitů. Aby se zabránilo nežádoucím vedlejším reakcím, musí být všechny ostatní funkční skupiny přítomné v nukleosidech znehodnoceny (chráněny) připojením chránící skupiny. Po dokončení sestavení oligonukleotidového řetězce jsou odstraněny všechny chránící skupiny za získání požadovaných oligonukleotidů. Níže jsou chránící skupiny běžně používané komerčně dostupné[21][22][23][24][25] a nejběžnější stavební bloky nukleosid fosforamiditu jsou stručně shrnuty:
- 5'-hydroxylová skupina je chráněna vůči kyselině labilní DMT (4,4'-dimethoxytrityl) skupina.
- Tymin a uracil, nukleové báze thymidin a uridin neobsahují exocyklické aminoskupiny, a proto nevyžadují žádnou ochranu. Naproti tomu nukleové báze adenin, cytosin, a guanin nesou exocyklické aminoskupiny, které reagují s aktivovanými fosforamidity za podmínek kopulační reakce. Ačkoli na úkor dalších kroků syntetického cyklu může být sestava oligonukleotidového řetězce provedena za použití fosforamiditů s nechráněnými aminoskupinami,[26] nejčastěji jsou trvale chráněny po celé délce sestavy oligonukleotidového řetězce. Ochrana exocyklických aminoskupin musí být ortogonální k ochraně 5'-hydroxyskupiny, protože ta je odstraněna na konci každého syntetického cyklu. Nejjednodušší implementací, a tudíž nejpoužívanější, je strategie, při které exocyklické aminoskupiny nesou bazálně labilní ochranu. Nejčastěji se používají dvě schémata ochrany.
- V prvním je standardní a robustnější schéma (obrázek), B z (benzoyl) ochrana se používá pro A, dA, C, dC, G a dG jsou chráněny isobutyrylovou skupinou. Poslední dobou, Ac (acetyl) skupina se často používá k ochraně C a dC, jak je znázorněno na obrázku.[27]
- Ve druhém schématu mírné ochrany jsou A a dA chráněny isobutyrylem[28] nebo fenoxyacetylové skupiny (PAC).[29] C a dC nesou acetylovou ochranu,[27] a G a dG jsou chráněny 4-isopropylfenoxyacetylem (i-Pr-PAC)[30] nebo dimethylformamidino (dmf)[31] skupiny. Mírné chránící skupiny jsou odstraněny snadněji než standardní chránící skupiny. Fosforamidity nesoucí tyto skupiny jsou však při skladování v roztoku méně stabilní.
- Fosfitová skupina je chráněna vůči labilitě vůči zásadám 2-kyanoethyl skupina.[32] Jakmile byl fosforamidit navázán na oligonukleotid vázaný na pevný nosič a fosfitové části byly převedeny na P (V) druh, není přítomnost ochrany fosfátu nutná pro úspěšné provedení dalších vazebných reakcí.[33]

- Při syntéze RNA je 2'-hydroxyskupina chráněna TBDMS (t-butyldimethylsilyl) skupina.[34][35][36][37] nebo s TOM (tri-iso-propylsilyloxymethyl) skupina,[38][39] oba jsou odstranitelné zpracováním fluoridovým iontem.
- Fosfitová část také nese diisopropylamino (iPr2N) skupina reaktivní za kyselých podmínek. Při aktivaci diisopropylaminoskupina opouští substituci 5'-hydroxyskupinou oligonukleotidu vázaného na nosič.
Viz také
Reference
- ^ Beaucage, S.L .; Caruthers M.H. (1981). „Deoxynukleosid fosforamidity - nová třída klíčových meziproduktů pro syntézu deoxypolynukleotidů“. Čtyřstěn dopisy. 22 (20): 1859–1862. doi:10.1016 / S0040-4039 (01) 90461-7.
- ^ Lin, K.-Y., Matteucci, M. D. (1998). "Cytosinový analog schopný vazebné vazby na guanin ve spirálových nukleových kyselinách". J. Am. Chem. Soc. 120 (33): 8531–8532. doi:10.1021 / ja981286z.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Nielsen, J .; Marugg, J. E.; Taagaard, M .; Van Boom, J. H .; Dahl, O. (1986). „Polymerem podporovaná syntéza deoxyoligonukleotidů s použitím in situ připravených deoxynukleosidů 2-kyanoethylfosforamiditů“. Rec. Trav. Chim. Pays-Bas. 105 (1): 33–34. doi:10.1002 / recl.19861050106.
- ^ Nielsen, J .; Taagaard, M .; Marugg, J. E.; Van Boom, J. H .; Dahl, O. (1986). „Aplikace 2-kyanoethyl-N, N, N ', N'-tetraisopropylfosforodiamiditu pro přípravu deoxyribonukleosid fosforamiditů in situ a jejich použití při syntéze oligodeoxyribonukleotidů na polymeru“. Nucleic Acids Res. 14 (18): 7391–7403. doi:10.1093 / nar / 14.18.7391. PMC 311758. PMID 3763407.
- ^ Nielsen, J .; Marugg, J. E.; Van Boom, J. H .; Honnens, J .; Taagaard, M .; Dahl, O. (1986). "Tepelná nestabilita některých alkylfosforodiamidů". J. Chem Res. Synopse (1): 26–27.
- ^ Nielsen, J .; Dahl, O. (1987). „Vylepšená syntéza 2-kyanoethyl-N, N, N ', N'-tetraisopropylfosforodiamiditu (iPr2N) 2POCH2CH2CN)“. Nucleic Acids Res. 15 (8): 3626. doi:10.1093 / nar / 15.8.3626. PMC 340760. PMID 3575107.
- ^ Beaucage, S.L. (2001). „2-Kyanoethyl tetraisopropylfosforodiamidit“. E-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002 / 047084289X.rn00312. ISBN 0471936235.
- ^ Sinha, N. D .; Biernat, J .; Koester, H. (1983). „β-Kyanoethyl-N, N-dialkylamino / N-morfolinomonochlorfosfoamidity, nová fosfitylační činidla usnadňující odstranění deprotekce a zpracování syntetizovaných oligonukleotidů“. Tetrahedron Lett. 24 (52): 5843–5846. doi:10.1016 / S0040-4039 (00) 94216-3.
- ^ Marugg, J. E.; Burik, A .; Tromp, M .; Van der Marel, G. A. & Van Boom, J. H. (1986). „Nový a univerzální přístup k přípravě cenných deoxynukleosidových 3'-fosfitových meziproduktů“. Tetrahedron Lett. 24 (20): 2271–22274. doi:10.1016 / S0040-4039 (00) 84506-2.
- ^ Guzaev, A. P .; Manoharan, M. (2001). „2-Benzamidoethyl skupina - nový typ chránící skupiny fosfátů pro syntézu oligonukleotidů“. J. Am. Chem. Soc. 123 (5): 783–793. doi:10.1021 / ja0016396. PMID 11456611.
- ^ Sproat, B .; Colonna, F .; Mullah, B .; Tsou, D .; Andrus, A .; Hampel, A .; Vinayak, R. (únor 1995). "Účinná metoda pro izolaci a čištění oligoribonukleotidů". Nukleosidy a nukleotidy. 14 (1&2): 255–273. doi:10.1080/15257779508014668. ISSN 0261-3166.
- ^ Stutz, A .; Hobartner, C .; Pitsch, S. (září 2000). „Nové skupiny chránící nukleobáze labilní vůči fluoridům pro syntézu 3 '(2') - O-amino-acylované RNA sekvence“. Helv. Chim. Acta. 83 (9): 2477–2503. doi:10.1002 / 1522-2675 (20000906) 83: 9 <2477 :: aid-hlca2477> 3.0.co; 2-9. ISSN 0018-019X.
- ^ Welz, R .; Muller, S. (leden 2002). „5- (benzylmerkapto) -1H-tetrazol jako aktivátor 2'-O-TBDMS fosforamiditových stavebních bloků při syntéze RNA“. Čtyřstěn dopisy. 43 (5): 795–797. doi:10.1016 / S0040-4039 (01) 02274-2. ISSN 0040-4039.
- ^ Vargeese, C .; Carter, J .; Yegge, J .; Krivjansky, S .; Settle, A .; Kropp, E .; Peterson, K .; Pieken, W. (1998). "Efektivní aktivace nukleosidových fosforamiditů s 4,5-dikyanoimidazolem během syntézy oligonukleotidů". Nucleic Acids Res. 26 (4): 1046–1050. doi:10.1093 / nar / 26.4.1046. ISSN 0305-1048. PMC 147346. PMID 9461466.
- ^ A b C Gacs-Baitz, E .; Sipos, F .; Egyed, O .; Sagi, G. (2009). „Syntéza a strukturní studie různě oxidovaných diastereomerních 5'-dimethoxytritylthymidin-3'-O- [0- (2-kyanoethyl) -N, N-diisopropyl] fosforamiditových derivátů. Porovnání účinků P = O, Funkce P = S a P = Se na NMR spektrálních a chromatografických vlastnostech ". Chirality. 21 (7): 663–673. doi:10,1002 / chir.20653. PMID 18937288.
- ^ A b Nemer, M. J .; Ogilvie, K. K. (1980). "Fosforamidátové analogy diribonukleosidmonofosfátů". Tetrahedron Lett. 21 (43): 4153–4154. doi:10.1016 / s0040-4039 (00) 93675-x.
- ^ Wilk, A .; Uznanski, B .; Stec, W. J. (1991). "Přiřazení absolutní konfigurace na fosforu v dithymidylyl (3 ', 5') fosformorfolidátech a -fosformorfolidothioátech". Nukleosidy a nukleotidy. 10 (1–3): 319–322. doi:10.1080/07328319108046469.
- ^ Guzaev, A. P. (2011). „Reaktivita 3H-1,2,4-dithiazol-3-thionů a 3H-1,2-dithiole-3-thionů jako sirných činidel pro syntézu oligonukleotidů“. Čtyřstěn dopisy. 52 (3): 434–437. doi:10.1016 / j.tetlet.2010.11.086.
- ^ Holloway, G. A .; Pavot, C .; Scaringe, S. A .; Lu, Y .; Rauchfuss, T. B. (2002). "Organokovová cesta k oligonukleotidům obsahujícím fosforoselenoát". ChemBioChem. 3 (11): 1061–1065. doi:10.1002 / 1439-7633 (20021104) 3:11 <1061 :: aid-cbic1061> 3.0.co; 2-9. PMID 12404630.
- ^ Ravikumar, V. T .; Kumar, R. K. (2004). „Stereoselektivní syntéza alkylfosfonátů: snadná změna uspořádání kyanoethyl-chráněných nukleosidových fosforamiditů“. Org. Process Res. Dev. 8 (4): 603–608. doi:10.1021 / op030035u.
- ^ „Beta-kyanoetylfosforamidity“. Products.appliedbiosystems.com. Citováno 2009-05-12.
- ^ „Biosearch Technologies“. Biosearchtech.com. Citováno 2009-05-12.
- ^ „ChemGenes Corporation, biotechnologická společnost“. Chemgenes.com. Citováno 2009-05-12.
- ^ M. Powell (2008-01-17). „Applied Biosystems Instruments“. Glenresearch.com. Citováno 2009-05-12.
- ^ „Syntéza a označování nukleových kyselin“. Thermo.com. 2008-08-16. Archivovány od originál 28. února 2009. Citováno 2009-05-12.
- ^ Gryaznov, S. M .; Letsinger, R.L. (1991). "Syntéza oligonukleotidů prostřednictvím monomerů s nechráněnými bázemi". J. Am. Chem. Soc. 113 (15): 5876–5877. doi:10.1021 / ja00015a059.
- ^ A b Reddy, M. P .; Hanna, N. B .; Farooqui, F. (1997). „Ultrarychlé štěpení a deprotekce syntézy oligonukleotidů a použití C.Ac Deriváty “. Nukleosidy a nukleotidy. 16 (7–9): 1589–1598. doi:10.1080/07328319708006236.
- ^ McMinn, D. (1997). „Syntéza oligonukleotidů obsahujících 3'-alkylaminy s použitím N-isobutyrylem chráněného deoxyadenosin fosforamiditu“. Tetrahedron Lett. 38 (18): 3123. doi:10.1016 / S0040-4039 (97) 00568-6.
- ^ Schulhof, J. C .; Molko, D .; Teoule, R. (1987). „Konečný krok deprotekce v syntéze oligonukleotidů je redukován na mírné a rychlé zpracování amoniakem za použití labilních skupin chránících báze“. Nucleic Acids Res. 15 (2): 397–416. doi:10.1093 / nar / 15.2.397. PMC 340442. PMID 3822812.
- ^ Zhu, Q. (2001). "Pozorování a eliminace N-acetylace oligonukleotidů připravených s použitím rychle deprotekčních fosforamiditů a ultrajemné deprotekce". Bioorg. Med. Chem. Lett. 11 (9): 1105–7. doi:10.1016 / S0960-894X (01) 00161-5. PMID 11354354.
- ^ McBride, L. J .; Kierzek, R .; Beaucage, S.L .; Caruthers, M. H. (1986). "Nukleotidová chemie. 16. Amidinové chránící skupiny pro syntézu oligonukleotidů". J. Am. Chem. Soc. 108 (8): 2040. doi:10.1021 / ja00268a052.
- ^ Sinha, N. D .; Biernat, J .; McManus, J .; Koester, H. (1984). „Polymer support oligonukleotide syntéza. XVIII: Použití β-kyanoethyl-N, N-dialkylamino- / N-morfolino fosforamiditu deoxynukleosidů pro syntézu fragmentů DNA, což zjednodušuje deprotekci a izolaci konečného produktu.“. Nucleic Acids Res. 12 (11): 4539–4557. doi:10.1093 / nar / 12.11.4539. PMC 318857. PMID 6547529.
- ^ Guzaev, A. P .; Manoharan, M. (2001). "Fosforamiditová vazba na oligonukleotidy nesoucí nechráněné internukleosidové fosfátové skupiny". J. Org. Chem. 66 (5): 1798–1804. doi:10.1021 / jo001591e. PMID 11262130.
- ^ Ogilvie, K. K .; Theriault, N .; Sadana, K.L. (1977). "Syntéza oligoribonukleotidů". J. Am. Chem. Soc. 99 (23): 7741–7743. doi:10.1021 / ja00465a073. PMID 915168.
- ^ Usman, N .; Ogilvie, K. K .; Jiang, M. Y .; Cedergren, R. J. (1987). „Automatizovaná chemická syntéza dlouhých oligoribunkleotidů s použitím 2'-O-silylovaného ribonukleosidu 3'-O-fosforamiditů na skleněné podložce s řízenými póry: syntéza 43-nukleotidové sekvence podobné 3'-polovině molekuly formylmethioninu Escherichia coli tRNA ". J. Am. Chem. Soc. 109 (25): 7845–7854. doi:10.1021 / ja00259a037.
- ^ Usman, N .; Pon, R. T .; Ogilvie, K. K. (1985). "Příprava ribonukleosidu 3'-O-fosforamiditů a jejich aplikace na automatizovanou syntézu oligonukleotidů v pevné fázi". Tetrahedron Lett. 26 (38): 4567–4570. doi:10.1016 / S0040-4039 (00) 98753-7.
- ^ Scaringe, S. A .; Francklyn, C .; Usman, N. (1990). „Chemická syntéza biologicky aktivních oligoribonukleotidů s použitím β-kyanoethyl chráněných ribonukleosidových fosforamiditů“. Nucleic Acids Res. 18 (18): 5433–5441. doi:10.1093 / nar / 18.18.5433. PMC 332221. PMID 2216717.
- ^ Pitsch, S .; Weiss, P. A .; Wu, X .; Ackermann, D .; Honegger, T. (1999). „Rychlá a spolehlivá automatizovaná syntéza RNA a částečně 2'-O-chráněných prekurzorů („ klecová RNA “) na základě dvou nových, ortogonálních 2'-O-chránících skupin.“ Helv. Chim. Acta. 82 (10): 1753–1761. doi:10.1002 / (SICI) 1522-2675 (19991006) 82:10 <1753 :: AID-HLCA1753> 3.0.CO; 2-Y.
- ^ Pitsch, S .; Weiss, P. A .; Jenny, L .; Stutz, A .; Wu, X. (2001). "Spolehlivá chemická syntéza oligoribonukleotidů (RNA) s 2'-O - [(triisopropylsilyl) oxy] methyl (2'-O-tom) chráněnými fosforamidity". Helv. Chim. Acta. 84 (12): 3773–3795. doi:10.1002 / 1522-2675 (20011219) 84:12 <3773 :: AID-HLCA3773> 3.0.CO; 2-E.
Další čtení
- Comprehensive Natural Products Chemistry, svazek 7: DNA a aspekty molekulární biologie. Kool, Eric T .; Editor. Neth. (1999), 733 s. Vydavatel: (Elsevier, Amsterdam, Neth.)
- Beaucage S. L., Iyer R. P. (1992). „Pokroky v syntéze oligonukleotidů fosforamiditovým přístupem“. Čtyřstěn. 48 (12): 2223–2311. doi:10.1016 / s0040-4020 (01) 88752-4.
- Beaucage S. L., Iyer R. P. (1993). „Funkcionalizace oligonukleotidů prostřednictvím derivátů fosforamiditu“. Čtyřstěn. 49 (10): 1925–1963. doi:10.1016 / s0040-4020 (01) 86295-5.
- Beaucage S. L., Iyer R. P. (1993). „Syntéza modifikovaných oligonukleotidů fosforamiditovým přístupem a jejich aplikace“. Čtyřstěn. 49 (28): 6123–6194. doi:10.1016 / s0040-4020 (01) 87958-8.
- Beaucage, S L. "Syntéza oligodeoxyribonukleotidů. Fosforamiditový přístup. Metody v molekulární biologii (Totowa, NJ, USA) (1993), 20 (Protokoly pro oligonukleotidy a analogy), 33–61.
- Reese C. B. (2002). „Chemická syntéza oligo- a poly-nukleotidů: osobní komentář“. Čtyřstěn. 58 (44): 8893–8920. doi:10.1016 / s0040-4020 (02) 01084-0.
- Brown T., Brown D. J. S. 1991. In Oligonukleotides and Analogues. Praktický přístup, ed. F Eckstein, s. 1 - 24. Oxford: IRL






