Značka velikosti molekulové hmotnosti - Molecular-weight size marker

A marker velikosti molekulové hmotnosti, označovaný také jako a protein žebřík, DNA žebříknebo RNA žebřík, je sada standardy které se používají k identifikaci přibližný velikost a molekula běžet na a gel v době elektroforéza, za použití zásada že molekulární váha je nepřímo úměrný rychlosti migrace přes gelovou matrici. Proto při použití v Gelová elektroforéza, markery účinně poskytují a logaritmická stupnice kterým lze odhadnout velikost dalších fragmentů (za předpokladu, že jsou známy velikosti fragmentů markeru).
Proteinové, DNA a RNA markery s předem určenými velikostmi a koncentracemi fragmentů jsou komerčně dostupné. Ty lze spustit v obou agaróza nebo polyakrylamidové gely. Značky jsou načteny do jízdních pruhů sousedících s jízdními pruhy před zahájením jízdy.
Markery DNA

Rozvoj
Přestože se koncept markerů molekulové hmotnosti zachoval, techniky vývoje se v průběhu let lišily. Nové vynálezy markerů molekulové hmotnosti jsou distribuovány v soupravách specifických pro typ markeru.
Prvním problémem ve vývoji markerů bylo dosažení vysokého rozlišení po celé délce markeru.[1] V závislosti na provozních podmínkách gelové elektroforézy mohly být fragmenty komprimovány, což narušilo čistotu. K řešení tohoto problému je sada pro Southern Blot analýza byla vyvinuta v roce 1990 a poskytla první marker kombinující cílovou DNA a sondovou DNA. Tato technika využila výhod logaritmického rozestupu a mohla být použita k identifikaci cílových pásem v délce přes 20 000 nukleotidy.[2]
Design
Existují dva běžné způsoby, jak konstruovat marker velikosti molekulové hmotnosti DNA.[3] Jedna taková metoda využívá techniku částečné ligace.[3] Ligace DNA je proces, kterým jsou lineární části DNA navzájem spojeny kovalentní vazby; konkrétněji tyto vazby jsou fosfodiesterové vazby.[4] Zde je 100bp duplexní DNA část částečně ligována. Důsledkem toho je, že se vytvoří dimery 200 bp, trimery 300 bp, tetramery 400 bp, pentamery 500 bp atd. Kromě toho zůstane část dsDNA 100 bp. Výsledkem je „žebřík“ DNA složený ze známých kousků DNA molekulová hmotnost je vytvořen na gelu.[3]
Druhá metoda využívá použití restrikční enzymy a rozpoznaná sekvence DNA.[3] DNA je strávený konkrétním restrikčním enzymem, což má za následek kousky DNA různých molekulových hmot. Jednou z výhod této metody je, že lze snadno vytvořit více markerů jednoduše strávením více známé DNA.[3] Na druhou stranu velikost kousků DNA závisí na místech, kde se restrikční enzym štěpí. To ztěžuje kontrolu velikosti fragmentů v markeru.[5]
V poslední době se v laboratořích používá jiný způsob konstrukce markerů velikosti molekulové hmotnosti DNA. Tato strategie zahrnuje použití Polymerázová řetězová reakce (PCR).[5] Toho je dosaženo jedním nebo dvěma způsoby: 1) cíl DNA je amplifikován současně prostřednictvím primer sady, nebo 2) různé cíle DNA jsou amplifikovány nezávisle prostřednictvím konkrétních primerů.[5]
Účinky gelových podmínek
Stejně jako u experimentálních vzorků mohou podmínky gelu ovlivnit marker velikosti molekulové hmotnosti, který běží vedle nich. Faktory jako nárazník, nabít/Napětí, a koncentrace gelu může ovlivnit mobilita a / nebo vzhled vašeho značkovače / žebříku / standardu. Tyto prvky je třeba vzít v úvahu při výběru markeru a při analýze konečných výsledků na gelu.

- Nárazníky
- Pufry působí na 1) stanovení pH a 2) zajištění ionty na podporu vodivosti. v DNA elektroforéza, TAE (tris-acetát-EDTA) a TBE (Tris-borate-EDTA) jsou obvyklé vyrovnávací paměti volby.[6] TBE pufr je výhodný pro malé kousky DNA, zatímco TAE je vhodnější pro fragmenty větší než 1 500 párů bází. Pokud jde o vyrovnávací kapacitu, TAE je nižší ve srovnání s TBE; obecně to vede k pomalejší mobilitě DNA. TBE je také schopen lepšího rozlišení.[7]
- Je třeba poznamenat, že voda nemůže působit jako náhrada za jeden z těchto pufrů, protože DNA nebude migrovat po gelu.[6] Kromě toho použití vody místo pufru povede ke vzniku gelu tání.[8]
- Nabíjení / napětí
- Pokud jde o napětí, doporučený rozsah je mezi 4 a 10 V / cm (tj. Volty / cm).[8] Agarózové gely jsou obvykle provozovány při napětí 5 V / cm.[3][6] Jednotka vzdálenosti, cm, označuje vzdálenost mezi elektrody (tj anoda a katoda ), nikoli délku samotného gelu.[3][6]
- Napětí příliš hluboko pod nebo nad tímto rozsahem ovlivní mobilitu a rozlišení pásem. Nízké napětí sníží pohyblivost a způsobí rozšíření pásem. Na druhé straně vysoké napětí sníží rozlišení pásem. To je do značné míry způsobeno skutečností, že příliš vysoká napětí mohou způsobit přehřátí a dokonce roztavení gelu.[8]
- Koncentrace
- Při výběru markeru je třeba vzít v úvahu koncentraci agarózy. Gel procento ovlivňuje migraci DNA.[3][6] Obecně platí, že čím vyšší je koncentrace gelu, tím pomaleji se bude DNA pohybovat gelem. To je navíc k roli, kterou hraje molekulová hmotnost při migraci DNA markeru nebo vzorku, to znamená, že čím vyšší je molekulová hmotnost, tím pomaleji bude DNA migrovat.[3][6]
- Koncentrace gelu také ovlivňuje schopnost vizualizovat pruhy vybité na gelu. Menší pruhy se lépe rozlišují na gelu s vyšším procentem, zatímco pruhy se zvýšenou molekulovou hmotností se snáze vizualizují na gelu s nižším procentem.[6]
Markery bílkovin
Rozvoj
Dříve byly proteinové markery vyvinuty za použití různých celých proteinů. Vývoj soupravy obsahující marker velikosti molekulové hmotnosti založený na proteinových fragmentech začal v roce 1993. Tento proteinový marker složený ze 49 různých aminokyselina sekvence, včetně vícedoménové proteiny, a umožnil analýzu proteinů štěpených na různých místech.[9]
Současná vylepšení techniky v proteinových markerech zahrnují použití automatického vývoje. První automaticky vyvinutý proteinový marker s pravidelnou hmotností byl vyvinut v roce 2012.[10]
Design
Podobně jako markery DNA jsou tyto markery obvykle složeny z purifikovaných proteinů, jejichž molekulové hmotnosti jsou již známy.[3] Níže uvedený seznam uvádí některé proteiny a také molekulovou hmotnost, které se běžně používají při konstrukci proteinového markeru.

| Protein | Molekulová hmotnost (kDa ) |
| Beta-galaktosidáza | 120[11] |
| Fosforyláza B | 94[3][12] |
| Bovinní sérový albumin (BSA) | 67[3][12] |
| Ovalbumin | 43[3] |
| krocan Albumin | 40[12] |
| Uhličitá anhydráza | 30[3][12] |
| Sójové boby Trypsin Inhibitor | 20.1[3][12] |
| a-laktalbumin | 14.4[3][12] |
| Lyzozym | 14[13] |
Výběr správného proteinového markeru
Markery velikosti molekulové hmotnosti lze rozdělit do dvou kategorií: markery molekulové hmotnosti vs. markery molekulárního žebříku.[14] Značky jsou buď obarvené, nebo nebarvené a v závislosti na okolnostech může být jedna vhodnější než jiná. Markery velikosti molekulové hmotnosti lze také biochemicky změnit.[15] Konjugace s biotin je nejčastější. Značkovače velikosti molekulové hmotnosti se nejčastěji používají v Elektroforéza na SDS-polyakrylamidovém gelu a western blot U všech různých typů a použití markerů velikosti molekulové hmotnosti je důležité zvolit vhodný proteinový standard. Kromě nejběžnějšího použití, jako způsob výpočtu molekulové hmotnosti vzorků, patří další použití umožňující vizuální důkaz migrace a účinnosti přenosu proteinů a někdy se dokonce používají pro pozitivní kontrolu.[16]
- MW marker vs proteinové žebříky
- Marker molekulové hmotnosti je jedním typem proteinového standardu. Mohou být před načtením předbarveny nebo nezašpiněny; v závislosti na typu experimentu může být jeden výhodnější. V obou případech jsou obvykle vedeny na vnějším pruhu gelu, zatímco vzorek je vložen do středních pruhů.[14] Molekulární markery se liší od proteinových žebříků tím, že jsou složeny ze směsi rodák proteiny, jejichž specifikace jsou dobře kategorizovány, ale neodpovídají celému počtu.[14] Obecně jsou mnohem levnější, ale analýza umožňuje pouze přibližnou hodnotu proteinů oddělených elektroforézou.[14]
- Proteinový žebřík je dalším typem proteinového standardu. Jsou téměř vždy obarvené.[14] Proteinové žebříky se liší od molekulárních markerů tím, že jsou složeny ze směsi vysoce purifikovaných proteinů, jejichž specifikace jsou známé a odpovídají celému počtu.[14] Obecně se proteinové žebříčky skládají z 10–12 proteinů.[14] Na konci experimentu, po migraci velikosti, bude jeden pás představovat velikost každého proteinu obsaženého v žebříčku.[17] Markery jsou rovnoměrně rozmístěny a analýza velikosti pomocí těchto markerů umožňuje přesnou hodnotu sledovaného proteinu. V některých případech se jako metoda molekulární konfirmace používají markery MW s proteinovými žebříky pro ověření.[14]
- Předbarvené a nezašpiněné značky
- Markery bílkovin mohou přijít nepoškozené nebo předbarvené, ale oba mají své výhody i nevýhody.[18] Jednoduchá vizualizace separace a přenosu proteinů je umožněna použitím předbarvených markerů.[18] Obvykle se používají jak v elektroforéze na SDS-polyakrylamidovém gelu, tak ve Western blotu. V SDS-PAGE umožňuje monitorování migrace proteinů, protože se proteinové pásy oddělí a lze je vidět během elektroforetického běhu. Při westernovém přenosu zabarvené proteinové standardy umožňují přenos vizualizačního proteinu na membránu.[17] Stanovení velikosti však nejsou taková přesný s těmito markery (další vysvětlení viz část Rekombinantní a přírodní markery).[18]
- Zatímco nezašpiněné značky umožňují přesnější stanovení velikosti, nelze je zobrazit, když gel běží. Z tohoto důvodu musí být gel zbarven, aby byly pruhy vizualizovány.[19]
- Rekombinantní a přírodní markery
- Kromě obarvených a nezbarvených markerů lze proteinové markery považovat za rekombinantní a přirozené.[18] Rekombinantní markery sestávají z rekombinantních proteinů, které byly značně purifikovány. Tyto značky jsou navrženy tak, aby zvýrazňovaly konkrétní vlastnosti.[18] Mezi příklady těchto charakteristik patří afinitní značky a molekulární hmotnosti, které jsou vzájemně rovnoměrně umístěny.[18]
- Přírodní markery, jak název napovídá, jsou směsí proteinů, které se vyskytují přirozeně.[18] Předobrazené přírodní markery fungují dobře pro vizualizaci separace gelu. Tyto markery však mají tendenci vázat se na skvrnu v a kovalentní způsobem v různých množstvích a na různých pozicích.[18] V důsledku toho mohou být výsledná pásma širší. To platí zejména při porovnávání s předbarvenými rekombinantními markery. Kvůli tomuto efektu je pravděpodobné, že stanovení molekulové hmotnosti bude u předbarvených přírodních markerů méně přesné.[18]
- Biochemicky změněno
- Proteinové standardy lze také chemicky změnit. Běžnou změnou je použití biotin. Biotin má velmi vysokou afinitu k streptavidin, a proto vazba tvoří velmi silný komplex. Pro vizualizaci je ke streptavidinu připojena barevná značka.[15]
Účinky gelových podmínek
Stejně jako u elektroforézy DNA je třeba při výběru proteinového markeru vzít v úvahu podmínky, jako jsou pufry, náboj / napětí a koncentrace.
- Nárazníky
- Vyrovnávací paměti mohou ovlivnit pohyblivost markeru i vzorků. PH pufru se mění podle použitého systému a následně bude mít každý pufrovací systém jiný účinek na náboj proteinu nebo proteinů.[20] Navíc, v případě SDS-PAGE, vazebná afinita pro SDS může být ovlivněn systémem ukládání do vyrovnávací paměti.[20] I při použití stejného procento a typ gelu, stejné proteiny budou migrovat různými rychlostmi v závislosti na použitém pufru.[20]
- Nabíjení / napětí
- Napětí hraje roli v mobilitě proteinů na gelu. Proteiny budou migrovat rychleji při vyšším napětí. V důsledku toho bude doba chodu gelu kratší. Naopak vyšší napětí může vést k větší difúzi pásma.[20] Pokud je napětí příliš vysoké, hodnota teplota v elektroforetické komoře se může stát takovým, že se gel začne tát.[20]
- Napětí, na které by měl gel běžet, závisí na typu gelu. U některých gelů zůstává napětí po celou dobu konstantní, zatímco u jiných gelů může počáteční napětí zůstat konstantní po určitou dobu, než se zvýší.[20] Toto druhé napětí se poté použije pro konkrétní časový rámec, po kterém může být také zvýšeno.[20]
- Koncentrace
- Z hlediska procenta lze gely používané pro elektroforézu proteinů rozdělit na jednoprocentní gely a gradientové gely.[18] Jednopercentní gely se také označují jako lineární gely.[20] U lineárních gelů zvolené procento obvykle klesá mezi 7,5% a 20%.[18] Běžné procentuální rozmezí pro gradientové gely je 4–15% a 10–20%. Každý typ gelu má své vlastní výhody.[18] Například lineární gely jsou výhodné, když několik proteinů má podobné molekulové hmotnosti; lepší separace mezi těmito proteiny bude zobrazena lineárním gelem.[18] Na druhou stranu jsou gradientní gely lepší volbou, když sledované vzorky obsahují proteiny s výrazně odlišnými molekulovými hmotnostmi nebo pokrývají velký rozsah molekulárních hmotností.[18][20]
RNA markery
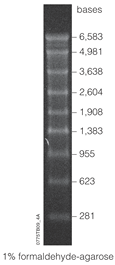
Rozvoj
Žebříky RNA složené z markerů velikosti molekulové hmotnosti RNA byly původně vyvinuty pomocí metody syntetického kruhu[21] k výrobě značkovačů různých velikostí. Tuto techniku vylepšil vynálezce Eric T. Kool pro použití kruhové DNA vektory jako způsob produkce markerů velikosti molekulové hmotnosti RNA. Jak se nazývá metoda klouzavého kruhu, vylepšení této techniky pramení z její účinnosti při syntéze RNA oligonukleotidy. Z kruhové šablony DNA jednovláknová RNA lze vyrábět různé délky od 4 do 1 500 bp bez nutnosti použití primerů a recyklace nukleotid trifosfát. DNA může být také syntetizována z kruhové šablony, což zvyšuje univerzálnost této techniky. Ve srovnání s transkripce odtoku, metoda syntetického kruhu produkuje RNA oligonukleotidy bez odtoku. Ve srovnání s PCR, metoda syntetického kruhu produkuje RNA oligonukleotidy bez nutnosti polymerázy ani a termální cyklovač. Tato metoda je také nákladově efektivní, pokud jde o její schopnost syntetizovat velké množství produktu při nižší chybovosti než strojové syntetizátory.[21]
Design
Markery RNA se skládají z transkriptů RNA různých přírůstkových délek. Například značka Lonza 0,5-9 kbp[22] má pásy značení 0,5, 1, 1,5, 2, 2,5, 3, 4, 5, 6 a 9 kilobase páry. Značky jsou rozpuštěny v úložném pufru, například EDTA, a může mít skladovatelnost až 2 roky při skladování při -80 ° C. Chcete-li použít značku, například pro analýzu Northern blot, je to první rozmrazeno a poté obarveno tak, aby bylo detekovatelné na gelové elektroforéze. Jedno z nejběžnějších barviv používaných pro značkovače je ethidiumbromid.
Rozsah konkrétního markeru se týká různých pásem, které může mapovat. „Vysoký" rozsah označuje relativně velké fragmenty (měřeno v kb), zatímco „nízký" rozsah označuje markery, které rozlišují mezi malými fragmenty (měřeno v bp). Některé markery lze dokonce popsat jako „ultra-low range“,[16] ale ještě přesnější je značka microRNA. Marker microRNA může být použit k měření fragmentů RNA v tuctu nukleotidů, jako je marker microRNA 17-25 nt.[23]
Použití
Při ekvivalentní molekulové hmotnosti bude RNA migrovat rychleji než DNA. Jak RNA, tak DNA však mají negativní lineární sklon mezi jejich migrační vzdáleností a logaritmický molekulární váha.[24] To znamená, že vzorky s nižší hmotností jsou schopné migrovat na větší vzdálenost. Tento vztah je třeba vzít v úvahu při výběru markerů RNA nebo DNA jako standardu.
Při spouštění markerů RNA a vzorků RNA na gelu je důležité tomu zabránit nukleáza kontaminace, na kterou je RNA velmi citlivá ribonukleáza Odbourávání (RNázy) prostřednictvím katalýza.[25][26] Je tedy třeba vzít v úvahu všechny materiály, které mají být při postupu použity. Veškeré sklo, které má přijít do styku s RNA, by mělo být předem ošetřeno diethylpyrokarbonát (DEPC) a plastové materiály by měly být na jedno použití.[25]
Markery velikosti molekulové hmotnosti a SDS-PAGE

Jedním z nejběžnějších použití markerů velikosti molekulové hmotnosti je gelová elektroforéza. Účelem gelové elektroforézy je oddělit proteiny pomocí fyzický nebo chemické vlastnosti, které zahrnují náboj, velikost molekuly a pH.
Gely se mohou lišit velikostí. Počet vzorků, které mají být zpracovány, určí vhodnou velikost gelu. Všechny gely jsou rozděleny do pruhů, které probíhají paralelně gelem. Každý pruh bude obsahovat konkrétní vzorek. Standardy velikosti molekulové hmotnosti jsou obvykle umístěny ve vnějším pruhu. Pokud má gel obzvláště vysoký počet pruhů, může být pro větší přehlednost přes gel umístěno více žebříků.
Proteiny a standardy jsou pipetován na gelu ve vhodných pruzích. Dodecylsulfát sodný (SDS) interaguje s proteiny, denaturace a dát jim záporný náboj. Vzhledem k tomu, že všechny proteiny mají stejný poměr náboje k hmotnosti, bude mobilita proteinů přes gel založena pouze na molekulové hmotnosti. Jakmile je elektrické pole zapnuto, zahájí se migrace proteinů. Po dokončení lze použít detekční mechanismus, jako je western blot, který odhalí přítomnost pásem. Každý pás představuje specifický protein. Cestovní vzdálenost je založena pouze na molekulové hmotnosti; proto lze molekulovou hmotnost každého proteinu určit porovnáním vzdálenosti neznámého proteinu se standardem známé molekulové hmotnosti.[27]
Různá použití markerů velikosti molekulové hmotnosti
Existuje mnoho druhů markerů velikosti molekulové hmotnosti a každý z nich má jedinečné vlastnosti, které umožňují jeho zapojení do řady biologických technik. Výběr markeru velikosti molekulové hmotnosti závisí na typu markeru (DNA, RNA nebo protein) a rozsahu délky, který nabízí (např. 1 kb). Před výběrem značky velikosti molekulové hmotnosti je důležité seznámit se s těmito charakteristikami a vlastnostmi. V konkrétním případě může být jeden typ vhodnější než jiný. Ačkoli se konkrétní markery mohou mezi protokoly pro danou techniku lišit, v této části budou uvedeny obecné markery a jejich role.
Allozymy
První typ molekulárního markeru vyvinutý a provozovaný na gelové elektroforéze byl alozymy. Tyto markery se používají k detekci variací proteinů. Slovo „alozym“ (také známý jako „aloenzym“) pochází z „alelický varianty enzymy."[28] Při běhu na gelu jsou proteiny odděleny podle velikosti a náboje. Přestože se alozymy mohou ve srovnání s ostatními dostupnými značkami zdát zastaralé, stále se používají dnes, hlavně kvůli jejich nízké ceně. Jednou z hlavních nevýhod je, že jelikož je k dispozici pouze omezené množství, je problém specifičnosti.[28]
Markery na bázi DNA (1960)
Ačkoli alozymy mohou detekovat variace v DNA, je to nepřímou metodou a není příliš přesné. Markery na bázi DNA byly vyvinuty v 60. letech.[28] Tyto markery jsou mnohem účinnější při rozlišování mezi variantami DNA. Dnes jsou to nejčastěji používané značky. Markery založené na DNA fungují na základě průzkumu nukleotidů, které mohou sloužit k řadě funkcí, jako je detekce rozdílů v nukleotidech nebo dokonce kvantifikace počtu mutace.[28]
- RFLP
- Polymorfismus délky restrikčních fragmentů je technika používaná k detekci variací v homologní DNA.[29] Specifické omezení endonukleázy se používají k trávení DNA. Molekulární marker RFLP je specifický pro jeden fragment. Spolu s alelovými markery RFLP, markerem velikosti molekulové hmotnosti, v tomto případě markerem DNA,[30] je také zahrnut na elektroforézovaný agarózový gel. Marker DNA umožňuje odhadnout velikost restrikčních fragmentů.
- Minisatelity
- Podobně jako RFLP používá tato technika také restrikční endonukleázy ke štěpení genomové DNA. Minisatelity jsou krátké sekvence tandemových opakování, přibližně 10–60 párů bází. Minisatelity lze použít při stopách DNA a jako regulátory genové kontroly.[28]
Markery založené na PCR (1980)
Úspěch markerů založených na DNA vedl k vývoji PCR. PCR (polymerázová řetězová reakce ) je DNA zesílení technika, kterou lze použít na různé typy fragmentů. Před tímto vývojem musela být DNA amplifikována klonováním nebo izolováním. Krátce po objevu PCR přišla myšlenka použití markerů založených na PCR pro gelovou elektroforézu. Tyto typy markerů jsou založeny na PCR primery a jsou kategorizovány jako sekvence DNA polymorfismus.[28]
- Mikrosatelity
- Také známý jako SSR (jednoduché opakování sekvence ) nebo STR (krátké tandemové opakování ), mikrosatelity se od minisatelitů liší tím, že jsou kratší, obvykle 2-6 párů bází. Tato vlastnost mikrosatelitů umožňuje snadnou izolaci. Mikrosatelity se nejčastěji používají v populační genetika. Mikrosatelity mají vysokou a složitou rychlost mutací, což je jejich hlavní nevýhoda.[28]
- AFLP
- Zesílený polymorfismus délky fragmentu je založen na PCR DNA otisky prstů technika. DNA je nejprve natrávena endonukleázami. The restrikční fragmenty jsou pak ligovány dohromady.[31] Molekulární marker je poté generován, když jsou vybrány specifické fragmenty pro zesílení. Markery AFLP probíhají podél markeru DNA na gelu. Běžný AFLP DNA marker je dlouhý 30-330 bp.[32] Fragmenty této značky leží v intervalech 10 bp, aby se zvýšila přesnost.
- RAPD
- Náhodná amplifikovaná polymorfní DNA je technika, která se provádí podobně jako AFLP. Rozdíl je v tom, že molekulární markery jsou generovány náhodně.[31] Nejběžnějším markerem velikosti molekulové hmotnosti pro tuto techniku je 1kb DNA žebřík.[33][34]
Polymorfismus sekvence DNA
Ačkoli technicky vzato, polymorfismus sekvence DNA probíhá od použití RFLP v 60. letech, analýza se v průběhu let významně změnila. Polymorfismus sekvence DNA používá starší techniky, jako je RFLP, ale ve větším měřítku. Sekvenování je mnohem rychlejší a efektivnější. Analýza je automatizovaná, protože využívá techniku známou jako sekvenování brokovnic. Tato vysoce výkonná metoda se běžně používá v populační genetice.[28]
- SNP
- SNP (polymorfismus jednoho nukleotidu ), se používají k detekci variací jednotlivých nukleotidů. Technika je velmi podobná technice RFLP. SNP se často používají pro populační genetické studie.[35] Po amplifikaci pomocí PCR lze tyto malé fragmenty vizualizovat pomocí gelové elektroforézy a při určování délky fragmentu znovu hrají roli DNA markery.
Analýza polysacharidů elektroforézou na sacharidovém gelu
Uhlohydrát markery se používají v technice známé jako polysacharid analýza elektroforézou na sacharidovém gelu (PACE), což je měřitelná separační technika.[36]Umožňuje analýzu enzymu hydrolýza produkty.[36] Používá se v aplikacích, jako je charakterizace enzymů zapojených do hemicelulóza degradace, stanovení struktury hemicelulózových polysacharidů a analýza enzymatického štěpení celulóza produkty.[36]
PACE závisí na derivitizaci, což je přeměna chemické sloučeniny na a derivát.[36][37] Tady monosacharidy, oligosacharidy a polysacharidy jsou sledované sloučeniny. Na svých redukčních koncích jsou označeny a fluorescenční štítek (tj fluorofor ).[36] Tato derivitizace s fluoroforem umožňuje jak separaci na gelu za požadovaných okolností, tak i fluorescence zobrazení gelu. V tomto případě se použije polyakrylamidový gel.[36]
Stejně jako u DNA, RNA a proteinové elektroforézy se markery provádějí vedle vzorků, které nás zajímají, v elektroforéze na sacharidovém gelu.[36] Markery sestávají z oligosacharidů známé molekulové hmotnosti. Stejně jako sledované vzorky je marker také derivován fluoroforem (obvykle 8-amino)naftalen -1,3,6-kyselina trisulfonová (ANTS) nebo 2-aminoakridon ).[36]
Reference
- ^ Carlson, David P. "Značky velikosti pro elektroforetickou analýzu DNA". Patent USA č. 5316908A. Patenty Google. Citováno 30. října 2013.
- ^ Carlson, David P. "Značky velikosti pro elektroforetickou analýzu DNA". Patent EP # 0466404B1. Patenty Google. Citováno 30. října 2013.
- ^ A b C d E F G h i j k l m n Ó p Blaber, Mike. „Přednáška 20: Gelová elektroforéza“. BCH5425 Molekulární biologie a biotechnologie.
- ^ Bowen, R (20. října 1999). "DNA ligace". Biotechnologie a genetické inženýrství. Citováno 12. listopadu 2013.
- ^ A b C Lan, Vo Thi Thuong; Půjčka, Pham Thi Thanh; Duong, Pham Anh Thuy; Thanh, Le Thi; Ha, Ngo Thi; Thuan, Ta Bich (2012). „Přímý postup pro laboratorní výrobu žebříku DNA“. Journal of Nucleic Acids. 2012: 254630. doi:10.1155/2012/254630. PMC 3306978. PMID 22496965.
- ^ A b C d E F G Bowen, R. (2000). „Elektroforéza DNA na agarózovém gelu“. Hypertexty pro biomedicínské vědy - Colorado State University.
- ^ „Pufr Tris Borate EDTA a Tris-Acetate-EDTA (TAE & TBE, pH 8,3)“ (PDF). Aniara.
- ^ A b C „Tipy a triky pro elektroforézu na agarózovém gelu“. Life Technologies.
- ^ Hartley, James. "Žebřík značení velikosti proteinu". Americký patent # 5449758A. Patenty Google. Citováno 30. října 2013.
- ^ Cheng, Tian Lu. „Automaticky se vyvíjející a pravidelně vážená souprava markerů molekulární hmotnosti proteinů a způsob jejich přípravy“. Americký patent č. 20130217133A1. Patenty Google. Citováno 30. října 2013.
- ^ „Značkovač molekulárních hmotností bílkovin“. ThermoScientific. Citováno 12. listopadu 2013.
- ^ A b C d E F Ingelman, Margareta (2004). "Separace a analýza proteinů". KE7001 Biochemistry Labs. Citováno 12. listopadu 2013.
- ^ "Značkovače molekulární hmotnosti bílkovin". Pomozte Biotech. 2011. Citováno 12. listopadu 2013.
- ^ A b C d E F G h „Průvodce srovnáváním a výběrem proteinových molekulárních hmotností“. Citováno 16. listopadu 2013.
- ^ A b „Biotinylovaný marker molekulové hmotnosti“. Citováno 16. listopadu 2013.
- ^ A b "Značky molekulové hmotnosti". Citováno 16. listopadu 2013.
- ^ A b „Pierce Prestained Protein Molecular Weight Marker“. Citováno 16. listopadu 2013.
- ^ A b C d E F G h i j k l m n „Elektroforéza - průvodce elektroforézou a detekcí na polyakrylamidovém gelu“ (PDF). Bio-Rad.
- ^ „Průvodce srovnáváním a výběrem proteinových molekulárních hmotností“. ThermoScientific. Citováno 12. listopadu 2013.
- ^ A b C d E F G h i „Proteinová příručka 2013“ (PDF). Life Technologies.
- ^ A b Kool, Eric T. "Kruhové vektory DNA pro syntézu RNA a DNA". Americký patent č. 6096880A. Patenty Google. Citováno 27. listopadu 2013.
- ^ Lonza. „Markery RNA 0,5–9 kbp“ (PDF). Dokument č. 18123-0807-06. Lonza Rockland Inc.. Citováno 27. listopadu 2013.
- ^ New England Biolabs. „značka microRNA“. New England Bioloabs. Citováno 27. listopadu 2013.
- ^ Wicks, Richard J. (1986). „Stanovení molekulové hmotnosti RNA elektroforézou na agarózovém gelu s použitím formaldehydu jako denaturantu: Porovnání markerů molekulové hmotnosti rna a dna“. International Journal of Biochemistry. 18 (3): 277–278. doi:10.1016 / 0020-711x (86) 90118-7. PMID 2937672.
- ^ A b „Katalogové číslo: R0004“. RNA Marker je velmi snadný. Abnova. Citováno 14. prosince 2013.
- ^ "Elektroforéza RNA: Úvod". RNA elektroforéza. Thermo Fisher Scientific Inc.. Citováno 14. prosince 2013.
- ^ "Stanovení molekulové hmotnosti proteinů" (PDF). Citováno 14. prosince 2013.
- ^ A b C d E F G h Schlotterer, Christian. „Vývoj molekulárních markerů“ (PDF). Citováno 26. listopadu 2013.
- ^ „Zlepšení populace“. Citováno 30. října 2013.
- ^ Higgins, L. (duben 2012). „DNA Ladder for Gel Electrophoresis“. Lewis & Clark College. Citováno 15. listopadu 2013.
- ^ A b Mueller, Ulrich (1999). „AFLP genotypizace a otisky prstů“ (PDF). Trendy v ekologii a evoluci. 14 (10): 389–394. doi:10.1016 / s0169-5347 (99) 01659-6. PMID 10481200. Citováno 30. října 2013.
- ^ Invitrogen Corporation (2003). „30-330 bp AFLP® DNA Ladder“ (PDF). Manuál. Life Technologies Corporation. Citováno 15. listopadu 2013.
- ^ Gianniny, Christine; et al. (Květen 2004). „unRAPD analýza mtDNA z květů rajčat bez artefaktů nukleární DNA“ (PDF). Biotechniky. 36 (5): 772–776. doi:10.2144 / 04365BM04. PMID 15152595. Citováno 15. listopadu 2013.
- ^ Roberts, M. A .; Crawford, D. L. (1. června 2000). „Využití náhodně zesílené polymorfní DNA jako prostředku pro vývoj sond DNA specifických pro rod a kmen Streptomyces“. Aplikovaná a environmentální mikrobiologie. 66 (6): 2555–2564. doi:10.1128 / AEM.66.6.2555-2564.2000. PMC 110581. PMID 10831438.
- ^ McClean, Phillip. „Třídy molekulárních markerů“. Citováno 30. října 2013.
- ^ A b C d E F G h Kosik, Ondřej; Bromley, Jennifer R .; Busse-Wicher, Marta; Zhang, Zhinong; Dupree, Paul (2012). "Studie enzymatického štěpení celulózy pomocí analýzy polysacharidů pomocí karbohydrátové gelové elektroforézy (PACE)". Metody v enzymologii. 510: 51–67. doi:10.1016 / B978-0-12-415931-0.00004-5. ISBN 9780124159310. ISSN 0076-6879. PMID 22608721.
- ^ Cammack R, Attwood TK, Campbell PN, Parish HJ, Smith A, Stirling JL, Vella F (2006). „Fluorofor“. Oxfordský slovník biochemie a molekulární biologie (Druhé vydání.). Oxford University Press.
