Rovnice zahrnující parciální derivace termodynamických veličin
| Termodynamika |
|---|
 |
|
|
|
|
| Specifická tepelná kapacita |  |  |  |  |  |
| | Stlačitelnost |  |  |  |  |  |
| | Teplotní roztažnost |  |  |  |  |  |
|
|
|
|
|
|
|
|
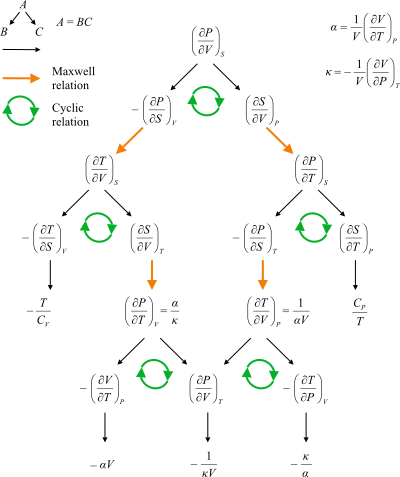
Vývojový diagram ukazující cesty mezi Maxwellovými vztahy.

je tlak,

teplota,

hlasitost,

entropie,
 koeficient tepelné roztažnosti
koeficient tepelné roztažnosti,
 stlačitelnost
stlačitelnost,
 tepelná kapacita
tepelná kapacita při stálém objemu,

tepelná kapacita při konstantním tlaku.
Maxwellovy vztahy jsou množinou rovnic v termodynamika které lze odvodit z symetrie druhých derivací az definic termodynamické potenciály. Tyto vztahy jsou pojmenovány pro fyzika devatenáctého století James Clerk Maxwell.
Rovnice
Struktura Maxwellových vztahů je vyjádřením rovnosti mezi druhými derivacemi pro spojité funkce. Vyplývá to přímo ze skutečnosti, že pořadí diferenciace analytická funkce dvou proměnných je irelevantní (Schwarzova věta ). V případě Maxwellových vztahů je uvažovanou funkcí termodynamický potenciál a  a
a  jsou dva různé přirozené proměnné pro tento potenciál máme
jsou dva různé přirozené proměnné pro tento potenciál máme
Schwarzova věta (obecně)
Kde částečné derivace jsou brány se všemi ostatními přirozenými proměnnými konstantní. Pro každý termodynamický potenciál existují  možné Maxwellovy vztahy kde
možné Maxwellovy vztahy kde  je počet přirozených proměnných pro tento potenciál. Podstatné zvýšení entropie bude ověřeno podle vztahů splněných zákony termodynamiky.
je počet přirozených proměnných pro tento potenciál. Podstatné zvýšení entropie bude ověřeno podle vztahů splněných zákony termodynamiky.
Čtyři nejčastější Maxwellovy vztahy
Čtyři nejběžnější Maxwellovy vztahy jsou rovnosti druhých derivací každého ze čtyř termodynamických potenciálů s ohledem na jejich tepelně přirozenou proměnnou (teplota  nebo entropie
nebo entropie  ) a jejich mechanické přirozená proměnná (tlak
) a jejich mechanické přirozená proměnná (tlak  nebo hlasitost
nebo hlasitost  ):
):
Maxwellovy vztahy (běžný)
kde potenciály jako funkce jejich přirozených tepelných a mechanických proměnných jsou vnitřní energie  , entalpie
, entalpie  , Helmholtzova volná energie
, Helmholtzova volná energie  , a Gibbsova volná energie
, a Gibbsova volná energie  . The termodynamický čtverec lze použít jako a mnemotechnická pomůcka připomenout a odvodit tyto vztahy. Užitečnost těchto vztahů spočívá v jejich kvantifikačních změnách entropie, které nejsou přímo měřitelné, pokud jde o měřitelné veličiny, jako je teplota, objem a tlak.
. The termodynamický čtverec lze použít jako a mnemotechnická pomůcka připomenout a odvodit tyto vztahy. Užitečnost těchto vztahů spočívá v jejich kvantifikačních změnách entropie, které nejsou přímo měřitelné, pokud jde o měřitelné veličiny, jako je teplota, objem a tlak.
Každá rovnice může být znovu vyjádřena pomocí vztahu

které jsou někdy známé také jako Maxwellovy vztahy.
Derivace
Maxwellovy vztahy jsou založeny na jednoduchých pravidlech částečné diferenciace, zejména na celkový diferenciální funkce a symetrii hodnocení parciálních derivací druhého řádu.
| Derivace |
|---|
| Odvození Maxwellova vztahu lze odvodit z diferenciálních forem termodynamické potenciály: Diferenciální forma vnitřní energie U je 
Tato rovnice se podobá celkem diferenciály formuláře 
Může být zobrazen pro jakoukoli rovnici tvaru, 
že 
Zvažte rovnici  . Nyní to můžeme okamžitě vidět . Nyní to můžeme okamžitě vidět 
Protože také víme, že pro funkce s spojitými druhými derivacemi jsou smíšené parciální derivace identické (Symetrie druhých derivací ), to znamená, že 
proto to vidíme 
a proto to 
Odvození Maxwellovy relace z Helmholtzovy volné energie - Diferenciální forma Helmholtzovy volné energie je
 
Ze symetrie druhých derivací 
a proto to 
Další dva Maxwellovy vztahy lze odvodit z diferenciální formy entalpie  a diferenciální forma Gibbsovy volné energie a diferenciální forma Gibbsovy volné energie  podobným způsobem. Všechny výše uvedené Maxwellovy vztahy tedy vyplývají z jednoho z Gibbsovy rovnice. podobným způsobem. Všechny výše uvedené Maxwellovy vztahy tedy vyplývají z jednoho z Gibbsovy rovnice. |
| Rozšířená derivace |
|---|
Kombinovaná forma prvního a druhého zákona termodynamiky, (Rov. 1) (Rov. 1)
U, S a V jsou stavové funkce. Pojďme,      
Nahraďte je v rovnici 1 a jeden dostane, 
A také psáno jako, 
porovnáním koeficientu dx a dy získáme jeden  
Diferenciace výše uvedených rovnic pomocí y, x
 (Rov. 2) (Rov. 2)- a
 (Rov. 3) (Rov. 3)
U, S a V jsou přesné rozdíly, proto   
Odečtěte eqn (2) a (3) a jeden dostane
 - Poznámka: Výše uvedené se nazývá obecný výraz Maxwellova termodynamického vztahu.
- Maxwellův první vztah
- Povolte x = S a y = V a jeden dostane
 - Maxwellova druhý vztah
- Povolte x = T a y = V a jeden dostane
 - Maxwellův třetí vztah
- Povolte x = S a y = P a jeden dostane
 - Maxwellův čtvrtý vztah
- Povolte x = T a y = P a jeden dostane
 - Maxwellova pátá relace
- Povolte x = P a y = V
  = 1 = 1- Maxwellův šestý vztah
- Povolte x = T a y = S a jeden dostane
 = 1 = 1
|
Odvození založené na Jacobians
Podíváme-li se na první zákon termodynamiky,

jako prohlášení o diferenciálních formách a vezměte vnější derivace této rovnice dostaneme

od té doby  . To vede k základní identitě
. To vede k základní identitě

Fyzický význam této identity lze vidět poznamenáním, že obě strany jsou ekvivalentními způsoby psaní práce provedené v nekonečně Carnotově cyklu. Ekvivalentní způsob zápisu identity je

Maxwellovy vztahy nyní následují přímo. Například,

Kritický krok je předposlední. Ostatní Maxwellovy vztahy následují podobným způsobem. Například,

Obecné Maxwellovy vztahy
Výše uvedené nejsou jediné Maxwellovy vztahy. Když se vezmou v úvahu jiné pracovní termíny zahrnující kromě objemové práce i jiné přirozené proměnné, nebo když počet částic je zahrnuta jako přirozená proměnná, další Maxwellovy vztahy se projeví. Například pokud máme jednosložkový plyn, pak počet částic N je také přirozenou proměnnou výše uvedených čtyř termodynamických potenciálů. Maxwellovy vztahy pro entalpii s ohledem na tlak a počet částic by pak byly:

kde μ je chemický potenciál. Kromě toho existují další termodynamické potenciály kromě čtyř běžně používaných a každý z těchto potenciálů poskytne sadu Maxwellových vztahů. Například velký potenciál  výnosy:[1]
výnosy:[1]

Viz také
Reference















































































