Formylace - Formylation
V biochemii je přidání a formyl funkční skupina se nazývá formylace. Formylová funkční skupina sestává z karbonylu vázaného na vodík. Při připojení k Skupina R., formyl skupina se nazývá aldehyd.

Formylace byla identifikována v několika kritických biologických procesech. Methionin byl poprvé objeven ve formě E-coli autorem Marcker a Sanger v roce 1964[1] a později bylo identifikováno, že se účastní zahájení syntézy proteinů v bakteriích a organelách.[2] Formace N-formylmethionin je katalyzován enzymem methionyl-tRNASe setkal transformyláza.[3] Kromě toho se v de novo biosyntéza purinů. Tyto reakce jsou katalyzovány enzymy glycinamid ribonukleotid (GAR) transformyláza a 5-aminoimidazol-4-karboxyamid ribotid (AICAR) transformyláza.[4] V poslední době se ukázalo, že formylace je a histon modifikace, která může modulovat genovou expresi.
Obecná formylační reakce
Formylace označuje jakékoli chemické procesy, ve kterých je sloučenina funkcionalizována formylovou skupinou (-CH = O). V organické chemii je termín nejčastěji používán s ohledem na aromatické sloučeniny (například převod benzen na benzaldehyd v Gattermann – Kochova reakce ). V biochemii je reakce katalyzována enzymy, jako jsou formyltransferázy.
Formylační reakce v biologii
Methanogeneze
Formylace methanofuran iniciuje methanogeneze cyklus. Formylová skupina je odvozena od oxid uhličitý a je převeden na metan.

Formylace v syntéze bílkovin

U bakterií a organel je zahájení syntézy bílkovin signalizováno tvorbou formyl-methionyl-tRNA (tRNAfMet). Tato reakce závisí na 10-formyltetrahydrofolát a enzym methionyl-tRNA formyltransferáza.[3]Tato reakce není používána eukaryoty nebo Archeaou jako přítomnost tRNAfMet v nebakteriálních buňkách je označován jako rušivý materiál a rychle eliminován. Po jeho výrobě tRNAfMet je dodáván do 30S podjednotka ribozomu za účelem zahájení syntézy bílkovin. fMet má stejnou kodonovou sekvenci jako methionin. FMet se však používá pouze k zahájení syntézy proteinů a nachází se tedy pouze na N konci proteinu. Během zbytkového překladu se používá methionin. v E-coli, tRNAfMet je konkrétně uznána iniciační faktor IF-2, protože formyl skupina blokuje tvorbu peptidové vazby na N-konci methioninu.[3]
Jakmile je dokončena syntéza proteinů, lze formylovou skupinu na methioninu odstranit pomocí peptidová deformyláza. Methioninový zbytek může být dále odstraněn enzymem methioninaminopeptidáza.

Formylační reakce v biosyntéze purinů
V jedenáctém kroku syntézy de novo jsou nutné dvě formylační reakce inosinmonofosfát (IMP), prekurzor purinových ribonukleotidů AMP a GMP. Glycinamid ribonukleotid (GAR) transformyláza katalyzuje formylaci GAR na formylglycinamidin ribotid (FGAR) ve čtvrté reakci dráhy. V předposledním kroku de novo purinové biosyntézy je 5-aminoimidazol-4-karboxyamid ribotid (AICAR) formulován na 5-formaminoimidazol-4-karboxamid ribotid (FAICAR) AICAR transformyláza.[4]
GAR transformyláza
PurN GAR transformyláza se nachází v eukaryotech a prokaryotech. Byla však identifikována druhá GAR transformyláza, PurT GAR transformyláza E-coli. Zatímco tyto dva enzymy nemají žádnou konzervaci sekvence a vyžadují různé donory formylů, specifická aktivita a Km pro GAR jsou stejné jak v PurT, tak v PurN GAR transformyláze.
PurN GAR transformyláza
PurN GAR transformyláza 1CDE používá koenzym N10-formyltetrahydrofolát (N10-formyl-THF) jako donor formylu k formulaci a-aminoskupiny GAR. U eukaryot je PurN GAR transformyláza součástí velkého multifunkčního proteinu, ale u prokaryot se vyskytuje jako jediný protein.[6]
Mechanismus

Předpokládá se, že formylační reakce probíhá přímou přenosovou reakcí, při které aminová skupina GAR nukleofilně napadá N10-formyl-THF a vytváří čtyřboký meziprodukt.[4] Protože a-aminoskupina GAR je relativně reaktivní, předpokládá se, že k deprotonaci nukleofilu dochází rozpouštědlem. Na aktivním místě jsou umístěny Asn 106, His 108 a Asp 144, které pomáhají při přenosu formylu.[6] Studie mutageneze však ukázaly, že tyto zbytky nejsou jednotlivě nezbytné pro katalýzu, protože pouze mutace dvou nebo více zbytků inhibují enzym. Na základě struktury se předpokládá, že záporně nabitý Asp144 zvyšuje pKa His108, což umožňuje protonované imidazoliové skupině His108 zvýšit elektrofilicitu N10-formyl-THF formyl skupiny. Navíc se předpokládá, že His108 a Asn106 stabilizují oxyaniont vytvořený v přechodném stavu.[7]

PurT GAR transformyláza
PurT GAR transformyláza vyžaduje jako katalyzátor donor formylu a ATP pro katalýzu. Odhaduje se, že PurT GAR transformyláza provádí 14-50% forem GAR v E-coli. Enzym je členem nadrodiny proteinů ATP-grip.[8]
Mechanismus
Pro PurT GAR transformylázu byl navržen sekvenční mechanismus, ve kterém je navržen krátkodobý formylfosfátový meziprodukt do první formy. Tento formylfosfátový meziprodukt poté podléhá nukleofilnímu napadení GAR aminem pro přenos formylové skupiny. Formylfosfátový meziprodukt byl detekován v experimentech mutageneze, ve kterých mutantní PurT GAR transforymyláza měla slabou afinitu k formiátu.[6] Inkubace PurT GAR transformylázy s formylfosfátem, ADP a GAR vede k ATP i FGAR. To dále naznačuje, že formylfosfát může být meziproduktem, protože je kineticky a chemicky kompetentní provádět formylační reakci v enzymu.[9] Bylo také navrženo, aby se vytvořil enzymový fosfátový meziprodukt předcházející formylfosfátovému meziproduktu na základě studií poziční isotopové výměny.[9] Strukturální data však naznačují, že formiát může být umístěn pro přímý útok na γ-fosfát ATP v aktivním místě enzymu za vzniku formylfosfátového meziproduktu.[8]

AICAR transformyláza
AICAR transformyláza vyžaduje koenzym N10-formyltetrahydrofolát (N10-formyl-THF) jako donor formylu pro formulaci AICAR na FAICAR. AICAR transformyláza a GAR transformyláza však nesdílejí vysokou sekvenční podobnost ani strukturní homologii.[7]
Mechanismus

Amin na AICAR je mnohem méně nukleofilní než jeho protějšek na GAR kvůli delokalizaci elektronů v AICAR prostřednictvím konjugace. Proto musí být aktivován N5 nukleofil AIRCAR, aby došlo k formylační reakci. Bylo zjištěno, že histidin 268 a lysin 267 jsou nezbytné pro katalýzu a jsou zachovány ve všech AICAR transformylázách. Histidin 268 se účastní deprotonace N5 nukleofilu AICAR, zatímco lysin 267 se navrhuje ke stabilizaci čtyřboký meziprodukt.[7]
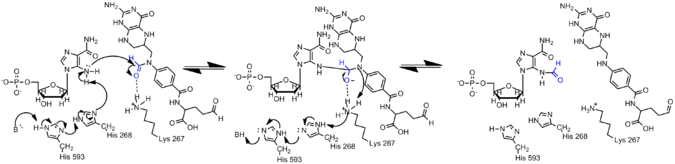
Formylace v histonových proteinech

ε-Formylace je jednou z mnoha posttranslační úpravy které se vyskytují na histonových proteinech, u nichž bylo prokázáno, že modulují chromatin konformace a aktivace genů.

Formylace byla identifikována na Nε lysinových zbytků v histonech a proteinech. Tato modifikace byla pozorována u linkerových histonů a proteiny skupiny s vysokou mobilitou, je vysoce hojný a předpokládá se, že hraje roli v epigenetice chromatinové funkce. Ukázalo se, že lysiny, které jsou formulovány, hrají roli ve vazbě na DNA. Formylace byla navíc detekována na histonových lysinech, o nichž je také známo, že jsou acetylované a methylované. Formylace tedy může blokovat další posttranslační modifikace.[10]Formylace je detekována nejčastěji na 19 různých modifikačních místech na histonu H1. Genetická exprese buňky je vysoce narušena formylací, která může způsobit onemocnění, jako je rakovina. Vývoj těchto modifikací může být způsoben oxidačním stresem.[10]
V histonových proteinech je lysin typicky modifikován histonacetyl-transferázami (HAT) a histonovými deacetylázami (HDAC nebo KDAC). Acetylace lysinu je zásadní pro regulaci a expresi určitých genů. Oxidační stres vytváří výrazně odlišné prostředí, ve kterém může být acetyl-lysin rychle vyloučen tvorbou formyl-lysinu kvůli vysoké reaktivitě forem formfosfátů. Předpokládá se, že tato situace je v současné době způsobena poškozením oxidační DNA. Byl navržen mechanismus tvorby formylfosfátu, který je vysoce závislý na oxidačně poškozené DNA a je poháněn hlavně radikální chemií v buňce.[11] Vyrobený formylfosfát lze poté použít k formulaci lysinu. Předpokládá se, že oxidativní stres hraje roli v dostupnosti lysinových zbytků na povrchu proteinů a v možnosti jejich formylace.

Formylace v medicíně
Formylační reakce jako lékový cíl
Inhibice enzymů podílejících se na biosyntéze purinů byla využívána jako potenciální lékový cíl pro chemoterapii.
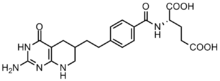
Rakovinové buňky vyžadují pro usnadnění dělení vysoké koncentrace purinů[6] a spoléhají spíše na syntézu de novo než na nukleotidová záchranná cesta.[7][12] Bylo vyvinuto několik inhibitorů na bázi folátu, které inhibují formylační reakce pomocí GAR transformylázy a AICAR transformylázy.[13] První inhibitor GAR transformylázy Lometrexol [(6R) 5,10-dideazatetrahydrofolát] byl vyvinut v 80. letech 20. století prostřednictvím spolupráce mezi Eli Lilly a akademické laboratoře.[14]
I když je struktura podobná N10-formyl-THF, lometrexol není schopen provádět jednu reakci přenosu uhlíku.[13] Dále bylo syntetizováno několik inhibitorů GAR transformylázy na bázi GAR.[13]Bylo zjištěno, že vývoj inhibitorů na bázi folátu je obzvláště náročný, protože inhibitory také dolů regulují enzym folypolyglutamát syntáza, který přidává další γ-glutamáty k monoglutamátovým folátům a antifolátům po vstupu do buňky pro zvýšení afinity enzymu. Tato zvýšená afinita může vést k antifolátové rezistenci.[12]
Leighův syndrom
Leighův syndrom je neurodegenerativní porucha, která je spojena s poruchou enzymatické formylační reakce. Leighův syndrom je typicky spojován s defekty oxidativní fosforylace, ke které dochází v mitochondriích.[15] Exome sekvenování, byl použit k identifikaci mutace genu kódujícího mitochondriální methionyl-tRNA formyltransferázu (MTFMT) u pacientů s Leighovým syndromem. Předpokládá se, že mutace c.626C> T identifikovaná v MTFMT poskytující příznaky Leighova syndromu mění sestřih exonu vedoucí k mutaci posunu snímků a předčasnému stop kodonu. Bylo zjištěno, že jedinci s mutací MTFMT c.626C> T mají snížené hladiny fMet-tRNAMet a změny v úrovni formylace mitochondricky přeloženého COX1. Tato vazba poskytuje důkazy o nezbytnosti formylovaného methioninu při zahájení exprese pro určité mitochondriální geny.[16]
Reference
- ^ Marcker, K; Sanger, F. (1964). "N-formyl-methionyl-S-RNA". J. Mol. Biol. 8 (6): 835–840. doi:10.1016 / S0022-2836 (64) 80164-9. PMID 14187409.
- ^ Adams, J.M .; Capecchi, M.R. (1966). „N-Formylmethionyl-sRNA jako iniciátor syntézy proteinů“. PNAS. 55 (1): 147–155. Bibcode:1966PNAS ... 55..147A. doi:10.1073 / pnas.55.1.147. PMC 285768. PMID 5328638.
- ^ A b C Kozak, M (1983). „Srovnání zahájení syntézy proteinů u prokaryot, eukaryot a organel“. Mikrobiologické recenze. 47 (1): 1–45. doi:10.1128 / MMBR.47.1.1-45.1983. PMC 281560. PMID 6343825.
- ^ A b C Voet and Voet (2008). Základy biochemie 3. vydání. New York: Wiley.
- ^ Thauer, R. K. (1998). „Biochemistry of Methanogenesis: a Hold to Marjory Stephenson“. Mikrobiologie. 144: 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ A b C d Warren, M.S .; K.M. Mattia; A.E. Marolewski; S.J. Benkovic (1996). „Transformylázové enzymy biosyntézy purinu de novo“ (PDF). Pure Appl. Chem. 68 (11): 2029–2036. doi:10.1351 / pac199668112029. S2CID 39555269. Citováno 24. února 2013.
- ^ A b C d Wolan, D; Greasley, S.E .; Beardsley, P .; Wilson, I.A. (2002). "Strukturální pohledy na ptačí mechanismus AICAR transformylázy". Biochemie. 41 (52): 15505–15513. doi:10.1021 / bi020505x. PMID 12501179.
- ^ A b Thoden, J.B .; Firestine, S .; Nixon, A .; Benkovic, S.J .; Holden, H. M. (2000). „Molecular Structure of Escherichia coli PurT-Encoded Glycinamide Ribonucleotide Transformylase“. Biochemie. 39 (30): 8791–8802. doi:10.1021 / bi000926j. PMID 10913290.
- ^ A b Marolewski, A.E .; Mattia, K.M .; Warren, M.S .; Benkovic, S.J. (1997). „Formylfosfát: navrhovaný meziprodukt v reakci katalyzovaný Escherichia coli PurT GAR transformylázou“. Biochemie. 36 (22): 6709–6716. doi:10.1021 / bi962961p. PMID 9184151.
- ^ A b Wisniewski, J.R .; Zougman, A .; Mann, M. (2002). „N-Formylace lysinu je rozšířená posttranslační modifikace jaderných proteinů vyskytující se na zbytcích podílejících se na regulaci funkce chromatinu“. Výzkum nukleových kyselin. 36 (2): 570–577. doi:10.1093 / nar / gkm1057. PMC 2241850. PMID 18056081.
- ^ Jiang, T; Zhou, X .; Taghizadeh, K .; Dong, M .; Dedon, PC. (2007). „N-formylace lysinu v histonových proteinech jako sekundární modifikace vyplývající z poškození oxidační DNA“. PNAS. 104 (1): 60–65. Bibcode:2007PNAS..104 ... 60J. doi:10.1073 / pnas.0606775103. PMC 1765477. PMID 17190813.
- ^ A b DeMartino, J. K.; Hwang, I .; Xu, L .; Wilson, I.A .; Boger, D.L. (2006). „Objev silného, nepolyglutamatovatelného inhibitoru glycinamid ribonukleotidové transformylázy“. Journal of Medicinal Chemistry. 49 (10): 2998–3002. doi:10.1021 / jm0601147. PMC 2531195. PMID 16686541.
- ^ A b C Christopherson, R.I .; Lyons, S.D .; Wilson, P. K. (2002). „Inhibitory de Novo Nucleotide Biosynthesis as Drugs“. Acc. Chem. Res. 35 (11): 961–971. doi:10.1021 / ar0000509. PMID 12437321.
- ^ Wang, L; Desmoulin, S.K .; Cherian, C .; Polin, L .; White, K .; Kushner, J .; Fulterer, A .; Chang, M .; Mitchell, S .; Stout, M .; Romero, M.F .; Hou, Z .; Matherly, L.H .; Gangjee, A (2011). „Syntéza, biologická a protinádorová aktivita vysoce účinného 6-substituovaného pyrrolo [2,3-d] pyrimidin thienoyl antifolátu s transportérem folátu spojeným s protony a selektivitou folátového receptoru nad redukovaným folátovým nosičem, který inhibuje β-glycinamid ribonukleotid formyltransferázu“. Journal of Medicinal Chemistry. 54 (20): 7150–7164. doi:10.1021 / jm200739e. PMC 3209708. PMID 21879757.
- ^ "Leighův syndrom". Online Mendelian Inheritance in Man. Citováno 24. února 2013.
- ^ Tucker EJ, Hershman SG, Köhrer C, Belcher-Timme CA, Patel J, Goldberger OA, Christodoulou J, Silberstein JM, McKenzie M, Ryan MT, Compton AG, Jaffe JD, Carr SA, Calvo SE, RajBhandary UL, Thorburn DR, Mootha VK (2011). „Mutace v MTFMT jsou základem lidské poruchy formylace způsobující zhoršenou mitochondriální translaci“. Cell Metab. 14 (3): 428–434. doi:10.1016 / j.cmet.2011.07.010. PMC 3486727. PMID 21907147.
