Endoplazmatické retikulum - Endoplasmic reticulum
| Buněčná biologie | |
|---|---|
| The zvířecí buňka | |
 Složky typické zvířecí buňky:
|

The endoplazmatické retikulum (ER) je v podstatě transportní systém eukaryotické buňky a má mnoho dalších důležitých funkcí, jako je skládání proteinů. Je to typ organela skládá se ze dvou podjednotek - hrubé endoplazmatické retikulum (RER), a hladké endoplazmatické retikulum (SER). Endoplazmatické retikulum se nachází ve většině eukaryotické buňky a tvoří propojenou síť zploštělých, membránou uzavřených vaků známých jako cisterny (v RER) a trubkové struktury v SER. Membrány ER jsou spojité s vnějším jaderná membrána. Endoplazmatické retikulum se nenachází v červené krvinky nebo spermie.
Oba typy ER sdílejí mnoho stejných bílkoviny a zapojit se do určitých společných činností, jako je syntéza určitých lipidy a cholesterol. Různé typy buňky obsahují různé poměry dvou typů ER v závislosti na činnostech buňky.
Vnější (cytosolický ) obličej drsného endoplazmatického retikula je posetý ribozomy to jsou stránky proteosyntéza. Drsné endoplazmatické retikulum je obzvláště prominentní v buňkách, jako je hepatocyty. Hladké endoplazmatické retikulum postrádá ribozomy a funguje lipid syntéza, ale ne metabolismus, výroba steroidní hormony, a detoxikace.[1] Hladké endoplazmatické retikulum je obzvláště hojné u savců játra a pohlavní žláza buňky.
Dějiny
ER byla pozorována u světelný mikroskop Garnier v roce 1897, který vytvořil tento termín ergastoplazma.[2][3] S elektronová mikroskopie, krajkové membrány endoplazmatického retikula byly poprvé spatřeny v roce 1969 Keith R. Porter, Albert Claude a Ernest F. Fullam.[4] Později slovo retikulum, což znamená „síť“, použil Porter v roce 1953 k popisu této struktury membrán.[5]
Struktura
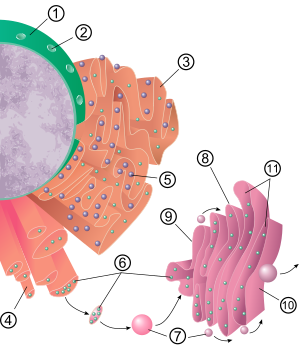

Obecnou strukturou endoplazmatického retikula je síť membrán nazývaných cisterny. Tyto vakovité struktury drží pohromadě cytoskelet. The fosfolipidová membrána uzavírá cisternový prostor (nebo lumen), který je spojitý s perinukleární prostor ale odděleně od cytosol. Funkce endoplazmatického retikula lze shrnout jako syntézu a export proteinů a membránových lipidů, ale liší se mezi ER a typem buňky a funkcí buňky. Množství drsného i hladkého endoplazmatického retikula v buňce se může pomalu měnit z jednoho typu na druhý, v závislosti na měnících se metabolických aktivitách buňky. Transformace může zahrnovat zabudování nových proteinů do membrány i strukturální změny. Ke změnám obsahu bílkovin může dojít bez znatelných strukturálních změn.[6][7][Citace je zapotřebí ]
Drsné endoplazmatické retikulum

Povrch drsného endoplazmatického retikula (často zkráceně RER nebo hrubý ER; také zvaný granulované endoplazmatické retikulum) je posetý výrobou bílkovin ribozomy což mu dává „drsný“ vzhled (odtud jeho název).[8] Vazebným místem ribozomu na hrubém endoplazmatickém retikulu je translocon.[9] Ribozomy však nejsou stabilní součástí struktury této organely, protože jsou neustále vázány a uvolňovány z membrány. Ribosom se váže na RER pouze tehdy, když se v cytosolu vytvoří specifický komplex protein-nukleová kyselina. Tento speciální komplex se tvoří, když začíná volný ribozom překlady the mRNA bílkoviny určené pro sekreční cesta.[10] Prvních 5–30 aminokyseliny polymerované kódování a signální peptid, molekulární zpráva, která je rozpoznána a vázána a částice pro rozpoznávání signálu (SRP). Překlad se pozastaví a ribosomový komplex se váže na RER translocon kde překlad pokračuje s rodící se (nový) protein tvořící se v lumen a / nebo membráně RER. Protein je zpracován v lumenu ER enzymem (signál peptidáza ), který odstraňuje signální peptid. Ribozomy v tomto okamžiku mohou být uvolňovány zpět do cytosolu; je však také známo, že netranslační ribozomy zůstávají spojeny s translokony.[11]
Membrána hrubého endoplazmatického retikula tvoří velké dvojité membránové listy, které jsou umístěny v blízkosti vnější vrstvy jaderný obal.[12] Dvojité membránové listy jsou naskládány a spojeny přes několik pravotočivých nebo levotočivých šroubovicových ramp, „ramp Terasaki“, což vede ke konstrukci připomínající vícepodlažní parkoviště.[13][14] I když mezi endoplazmatickým retikulem a Golgiho aparát vázané na membránu transportní vezikuly kyvadlové proteiny mezi těmito dvěma oddíly.[15] Vezikuly jsou obklopeny obalové proteiny s názvem COPI a COPII. COPII zaměřuje vezikuly na Golgiho aparát a COPI označí je, aby byly přivedeny zpět do drsného endoplazmatického retikula. Hrubé endoplazmatické retikulum funguje ve shodě s golgiho komplex na cílit na nové proteiny k jejich správným cílům. Druhý způsob transportu z endoplazmatického retikula zahrnuje oblasti zvané membránová kontaktní místa, kde jsou membrány endoplazmatického retikula a dalších organel drženy těsně pohromadě, což umožňuje přenos lipidů a dalších malých molekul.[16][17]
Drsné endoplazmatické retikulum je klíčové v mnoha funkcích:
- Výroba lysozomální enzymy s a manóza-6-fosfát značka přidána do cis-Golgiho síť.[Citace je zapotřebí ]
- Výroba vylučováno proteiny, buď sekretované konstitutivně bez značky, nebo sekretované regulačním způsobem Clathrin a spárované bazické aminokyseliny v signální peptid.
- Integrální membránové proteiny které zůstávají zakotveny v membráně, když vezikuly vystupují a váží se na nové membrány. Rab proteiny jsou klíčové pro zacílení membrány; SNAP a SNARE proteiny jsou klíčové v případě fúze.
- Počáteční glykosylace jak montáž pokračuje. Toto je N-vázané (O-spojování se vyskytuje u Golgiho).
Hladké endoplazmatické retikulum

Ve většině buněk je hladké endoplazmatické retikulum (zkráceno SER) je vzácný. Místo toho existují oblasti, kde je ER částečně hladké a částečně drsné, tato oblast se nazývá přechodná ER. Přechodný ER dostane svůj název, protože obsahuje výstupní stránky ER. Jedná se o oblasti, kde se transportní vezikuly, které obsahují lipidy a proteiny vytvořené v ER, oddělí od ER a začnou se pohybovat do Golgiho aparát. Specializované buňky mohou mít mnoho hladkého endoplazmatického retikula a v těchto buňkách má hladký ER mnoho funkcí.[6] Syntetizuje lipidy, fosfolipidy,[18][19][20] a steroidy. Buňky, které vylučují tyto produkty, například buňky v testy, vaječníky, a mazové žlázy mít hojnost hladkého endoplazmatického retikula.[21] Rovněž provádí metabolismus sacharidů, detoxikaci produktů přirozeného metabolismu a alkoholu a drog, připojení receptorů na proteiny buněčné membrány a metabolismus steroidů.[22] Ve svalových buňkách reguluje iont vápníku koncentrace. Hladké endoplazmatické retikulum se nachází v různých typech buněk (živočišných i rostlinných) a v každém z nich plní různé funkce. Hladké endoplazmatické retikulum také obsahuje enzym glukóza-6-fosfatáza, který převádí glukóza-6-fosfát k glukóze, krok dovnitř glukoneogeneze. Je připojen k jaderný obal a skládá se z tubulů, které jsou umístěny v blízkosti buněčné periferie. Tyto trubice se někdy větví a vytvářejí síť, která má retikulární vzhled.[12] V některých buňkách existují rozšířené oblasti, jako jsou vaky hrubého endoplazmatického retikula. Síť hladkého endoplazmatického retikula umožňuje větší plochu povrchu věnovat působení nebo skladování klíčových enzymů a produktů těchto enzymů.
Sarkoplazmatické retikulum

Sarkoplazmatické retikulum (SR), z řeckého σάρξ sarx ("maso"), je hladký ER nalezen v myocyty. Jediným strukturálním rozdílem mezi touto organelou a hladkým endoplazmatickým retikulem je směs proteinů, které mají, a to jak navázané na své membrány, tak i driftující v mezích svých lumenů. Tento základní rozdíl svědčí o jejich funkcích: Endoplazmatické retikulum syntetizuje molekuly, zatímco sarkoplazmatické retikulum ukládá ionty vápníku a pumpuje je do sarkoplazmy, když je stimulováno svalové vlákno.[23][24] Po jejich uvolnění ze sarkoplazmatického retikula ionty vápníku interagují s kontraktilními proteiny, které využívají ATP ke zkrácení svalového vlákna. Sarkoplazmatické retikulum hraje hlavní roli v vazba excitace-kontrakce.[25]
Funkce
Endoplazmatické retikulum slouží mnoha obecným funkcím, včetně skládání proteinových molekul do tzv. Vaků cisterny a transport syntetizovaných proteinů v vezikuly do Golgiho aparát. Správné skládání nově vyrobených proteinů umožňuje několik endoplazmatických retikul garde bílkoviny, včetně protein disulfid izomeráza (PDI), ERp29, Hsp70 rodinný příslušník BiP / Grp78, kalnexin, kalretikulin a rodina peptidylpropylizomerázy. Pouze správně složené proteiny jsou transportovány z hrubého ER do Golgiho aparátu - rozložené proteiny způsobují rozvinutá proteinová odpověď jako zátěžová reakce v pohotovostním režimu. Poruchy v redox regulace, regulace vápníku, deprivace glukózy a virová infekce[26] nebo nadměrná exprese proteinů[27] může vést k stresová reakce endoplazmatického retikula (ER stres), stav, ve kterém se skládání proteinů zpomaluje, což vede ke zvýšení rozložené proteiny. Tento stres se objevuje jako potenciální příčina poškození při hypoxii / ischemii, inzulínové rezistenci a dalších poruchách.[28]
Transport bílkovin
Sekreční proteiny, většinou glykoproteiny, se pohybují přes membránu endoplazmatického retikula. Proteiny, které jsou transportovány endoplazmatickým retikulem v celé buňce, jsou označeny adresním štítkem zvaným a sekvence signálu. N-konec (jeden konec) a polypeptid řetězec (tj. protein) obsahuje několik aminokyseliny které fungují jako tag adresy, které jsou odstraněny, když polypeptid dosáhne svého cíle. Vznikající peptidy se dostávají do ER prostřednictvím translocon, membránově zabudovaný multiproteinový komplex. Proteiny, které jsou určeny pro místa mimo endoplazmatické retikulum, jsou zabaleny do transportu vezikuly a pohyboval se podél cytoskelet k jejich cíli. V lidských fibroblastech je ER vždy distribuován společně s mikrotubuly a jeho depolymerizace způsobuje jeho koagregaci s mitochondriemi, které jsou také spojeny s ER.[29]
Endoplazmatické retikulum je také součástí cesty třídění proteinů. Jedná se v podstatě o dopravní systém eukaryotické buňky. Většina jeho rezidentních proteinů je v něm zadržena retencí motiv. Tento motiv se skládá ze čtyř aminokyselin na konci proteinové sekvence. Nejběžnější retenční sekvence jsou KDEL pro bílkoviny umístěné v lumenu a KKXX pro transmembránový protein.[30] Varianty KDEL a KKXX se však vyskytují a další sekvence mohou také vést k retenci endoplazmatického retikula. Není známo, zda taková variace může vést k lokalizacím sub-ER. Existují tři KDEL (1, 2 a 3 ) receptory v savčích buňkách a mají velmi vysoký stupeň sekvenční identity. Funkční rozdíly mezi těmito receptory musí být stanoveny.[31]
Regulace bioenergetiky dodávky ER ATP mechanismem CaATiER

Endoplazmatické retikulum neobsahuje zařízení pro regeneraci ATP, a proto vyžaduje import ATP z mitochondrií. Importovaný ATP je pro ER zásadní pro výkon jeho funkce při zachování buněčných funkcí, jako je skládání a obchodování s proteiny.[32]
Transportér ER ATP, SLC35B1 / AXER, byl nedávno klonován a charakterizován,[33] a mitochondrie dodávají ATP do ER prostřednictvím a Ca.2+-agonizovaná doprava do ER (CaatiER) mechanismus.[34] The Caatier mechanismus ukazuje citlivost na cytosolický Ca2+ v rozmezí od vysokého nM do nízkého μM rozsahu, s Ca2+- snímací prvek, který ještě nebude identifikován a ověřen.
Klinický význam
Abnormality v XBP1 vést ke zvýšenému stresová reakce endoplazmatického retikula a následně způsobí vyšší náchylnost k zánětlivým procesům, ke kterým může dokonce přispívat Alzheimerova choroba.[35] V dvojtečka Anomálie XBP1 byly spojeny se zánětlivými onemocněními střev včetně Crohnova nemoc.[36]
The rozvinutá proteinová odpověď (UPR) je buněčná stresová reakce související s endoplazmatickým retikulem.[37] UPR se aktivuje v reakci na akumulaci rozloženého nebo nesprávně složeného zboží bílkoviny v lumen endoplazmatického retikula. Funkce UPR obnovuje normální funkci buňky zastavením proteinu překlad, degraduje špatně složené proteiny a aktivuje signální dráhy, které vedou ke zvýšení produkce molekul chaperony zahrnutý do něčeho, zůčastnit se čeho skládání bílkovin. Trvalá nadměrná aktivace UPR byla zapletena do prion nemoci stejně jako několik dalších neurodegenerativní onemocnění a inhibice UPR by se mohla stát léčbou těchto onemocnění.[38]
Reference
- ^ „Endoplazmatické retikulum (drsné a hladké)“. Archivováno z původního dne 24. listopadu 2015. Citováno 21. listopadu 2015.
- ^ Garnier, C. 1897. Les filaments basaux des cellules glandulaires. Všimněte si préliminaire. Bibliographie anatomique, 5, 278–289.
- ^ Buvat R (1963). "Elektronová mikroskopie rostlinné protoplazmy". International Review of Cytology. 14: 41–55. doi:10.1016 / S0074-7696 (08) 60021-2. ISBN 9780123643148. PMID 14283576.
- ^ Porter KR, Claude A, Fullam EF (březen 1945). „Studium buněk tkáňové kultury elektronovou mikroskopií: metody a předběžná pozorování“. The Journal of Experimental Medicine. 81 (3): 233–46. doi:10.1084 / jem.81.3.233. PMC 2135493. PMID 19871454.
- ^ PORTER KR (květen 1953). „Pozorování submikroskopické bazofilní složky cytoplazmy“. The Journal of Experimental Medicine. 97 (5): 727–50. doi:10.1084 / jem.97.5.727. PMC 2136295. PMID 13052830.
- ^ A b Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molekulární biologie buňky (4. vydání). New York: Garland Science. ISBN 978-0-8153-3218-3. Archivováno od původního dne 2017-10-03.
- ^ Cooper GM (2000). Buňka: molekulární přístup (2. vyd.). Washington (DC): ASM Press. ISBN 978-0-87893-106-4.
- ^ "reticulum". Svobodný slovník.
- ^ Görlich D, Prehn S, Hartmann E, Kalies KU, Rapoport TA (říjen 1992). "Savčí homolog SEC61p a SECYp je během translokace spojen s ribozomy a rodícími se polypeptidy." Buňka. 71 (3): 489–503. doi:10.1016 / 0092-8674 (92) 90517-G. PMID 1423609. S2CID 19078317.
- ^ Lodish H a kol. (2003). Molekulární buněčná biologie (5. vydání). W. H. Freeman. str.659–666. ISBN 978-0-7167-4366-8.
- ^ Seiser RM, Nicchitta CV (říjen 2000). „Osud ribozomů vázaných na membránu po ukončení syntézy proteinů“. The Journal of Biological Chemistry. 275 (43): 33820–7. doi:10,1074 / jbc.M004462200. PMID 10931837.
- ^ A b Shibata Y, Voeltz GK, Rapoport TA (srpen 2006). "Hrubé plechy a hladké tubuly". Buňka. 126 (3): 435–9. doi:10.1016 / j.cell.2006.07.019. PMID 16901774. S2CID 16107069.
- ^ Terasaki M, Shemesh T, Kasthuri N, Klemm RW, Schalek R, Hayworth KJ, Hand AR, Yankova M, Huber G, Lichtman JW, Rapoport TA, Kozlov MM (červenec 2013). „Skládané listy endoplazmatického retikula jsou spojeny motivy helikoidní membrány“. Buňka. 154 (2): 285–96. doi:10.1016 / j.cell.2013.06.031. PMC 3767119. PMID 23870120.
- ^ Guven J, Huber G, Valencia DM (říjen 2014). „Terasaki spirála rampa v drsném endoplazmatickém retikulu“. Dopisy o fyzické kontrole. 113 (18): 188101. Bibcode:2014PhRvL.113r8101G. doi:10.1103 / PhysRevLett.113.188101. PMID 25396396.
- ^ Endoplazmatické retikulum. (n.d.). McGraw-Hill Encyclopedia of Science and Technology. Citováno 13. září 2006 z webu Answers.com: „Odpovědi - nejdůvěryhodnější místo pro zodpovězení životních otázek“. Archivováno od originálu 16. 11. 2006. Citováno 2006-09-13.
- ^ Levine T (září 2004). „Krátkodobý intracelulární přenos malých molekul přes spojení endoplazmatického retikula“. Trendy v buněčné biologii. 14 (9): 483–90. doi:10.1016 / j.tcb.2004.07.017. PMID 15350976.
- ^ Levine T, Loewen C (srpen 2006). "Interorganické membránové kontaktní místa: skrz sklo, temně". Současný názor na buněčnou biologii. 18 (4): 371–8. doi:10.1016 / j.ceb.2006.06.011. PMID 16806880.
- ^ Prinz, William A .; Choudhary, Vineet; Liu, Li-Ka; Lahiri, Sujoy; Kannan, Muthukumar (01.03.2017). „Syntéza fosfatidylserinu na membránových kontaktních místech podporuje jeho transport z ER“. Journal of Lipid Research. 58 (3): 553–562. doi:10.1194 / ml. M072959. ISSN 0022-2275. PMC 5335585. PMID 28119445.
- ^ Kannan, Muthukumar; Riekhof, Wayne R .; Voelker, Dennis R. (2015). "Transport fosfatidylserinu z endoplazmatického retikula na místo fosfatidylserin dekarboxylázy2 v kvasnicích". Provoz. 16 (2): 123–134. doi:10.1111 / tra.12236. ISSN 1600-0854. PMID 25355612. S2CID 34302.
- ^ Friedman, Jonathan R .; Kannan, Muthukumar; Toulmay, Alexandre; Jan, Calvin H .; Weissman, Jonathan S .; Prinz, William A .; Nunnari, Jodi (2018-01-22). „Homeostáza lipidů je udržována dvojím zaměřením mitochondriálního biosyntetického PE enzymu na ER“. Vývojová buňka. 44 (2): 261–270.e6. doi:10.1016 / j.devcel.2017.11.023. ISSN 1534-5807. PMC 5975648. PMID 29290583.
- ^ "Funkce hladkého ER". University of Minnesota Duluth.
- ^ Maxfield FR, Wüstner D (říjen 2002). „Intracelulární transport cholesterolu“. The Journal of Clinical Investigation. 110 (7): 891–8. doi:10,1172 / JCI16500. PMC 151159. PMID 12370264.
- ^ Toyoshima C, Nakasako M, Nomura H, Ogawa H (červen 2000). "Krystalová struktura vápníkové pumpy sarkoplazmatického retikula při rozlišení 2,6 A". Příroda. 405 (6787): 647–55. Bibcode:2000Natur.405..647T. doi:10.1038/35015017. PMID 10864315. S2CID 4316039.
- ^ Goodman SR (2007-11-26). Lékařská buněčná biologie (3. vyd.). Akademický tisk. p. 69. ISBN 9780080919317.
- ^ Martini F, Nath J, Bartholomew E (2014). Základy anatomie a fyziologie (10. vydání). ISBN 978-0321909077.
- ^ Xu C, Bailly-Maitre B, Reed JC (říjen 2005). „Stres endoplazmatického retikula: rozhodnutí o životě a smrti buněk“. The Journal of Clinical Investigation. 115 (10): 2656–64. doi:10,1172 / JCI26373. PMC 1236697. PMID 16200199.
- ^ Kober L, Zehe C, Bode J (říjen 2012). „Vývoj nového selekčního systému založeného na stresu ER pro izolaci vysoce produktivních klonů“. Biotechnologie a bioinženýrství. 109 (10): 2599–611. doi:10,1002 / bit. 24527. PMID 22510960. S2CID 25858120.
- ^ Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, Tuncman G, Görgün C, Glimcher LH, Hotamisligil GS (říjen 2004). „Stres endoplazmatického retikula spojuje obezitu, působení inzulínu a cukrovku 2. typu“. Věda. 306 (5695): 457–61. Bibcode:2004Sci ... 306..457O. doi:10.1126 / science.1103160. PMID 15486293. S2CID 22517395.
- ^ Soltys BJ, Gupta RS (1992). „Vzájemné vztahy endoplazmatického retikula, mitochondrií, intermediárních vláken a mikrotubulů - studie čtyřnásobné fluorescenční značení“. Biochemie a buněčná biologie. 70 (10–11): 1174–86. doi:10.1139 / o92-163. PMID 1363623.
- ^ Stornaiuolo M, Lotti LV, Borgese N, Torrisi MR, Mottola G, Martire G, Bonatti S (březen 2003). „Signály získávání KDEL a KKXX připojené ke stejnému reportérovému proteinu určují různé přenosy mezi endoplazmatickým retikulem, mezikontrastem a komplexem Golgi“. Molekulární biologie buňky. 14 (3): 889–902. doi:10,1091 / mbc.E02-08-0468. PMC 151567. PMID 12631711.
- ^ Raykhel I, Alanen H, Salo K, Jurvansuu J, Nguyen VD, Latva-Ranta M, Ruddock L (prosinec 2007). "Kód molekulární specificity pro tři savčí receptory KDEL". The Journal of Cell Biology. 179 (6): 1193–204. doi:10.1083 / jcb.200705180. PMC 2140024. PMID 18086916.
- ^ Clairmont, CA; De Maio, A; Hirschberg, CB (25. února 1992). „Translokace ATP do lumen hrubých vezikul odvozených z endoplazmatického retikula a její vazba na luminální proteiny včetně BiP (GRP 78) a GRP 94“. The Journal of Biological Chemistry. 267 (6): 3983–90. PMID 1740446.
- ^ Klein, Marie-Christine; Zimmermann, Katharina; Schorr, Stefan; Landini, Martina; Klemens, Patrick A. W .; Altensell, Jacqueline; Jung, Martin; Krause, Elmar; Nguyen, Duy; Helms, Volkhard; Rettig, Jens; Fecher-Trost, Claudia; Cavalié, Adolfo; Hoth, Markus; Bogeski, Ivan; Neuhaus, H. Ekkehard; Zimmermann, Richard; Lang, Sven; Haferkamp, Ilka (28. srpna 2018). „AXER je výměník ATP / ADP v membráně endoplazmatického retikula“. Příroda komunikace. 9 (1): 3489. Bibcode:2018NatCo ... 9,3489 tis. doi:10.1038 / s41467-018-06003-9. PMC 6113206. PMID 30154480.
- ^ Yong, Jing; Bischof, Helmut; Burgstaller, Sandra; Siirin, Marina; Murphy, Anne; Malli, Roland; Kaufman, Randal J (9. září 2019). „Mitochondrie dodávají ATP do ER prostřednictvím mechanismu antagonizovaného cytosolickým Ca2+". eLife. 8. doi:10,7554 / eLife.49682. PMID 31498082.
- ^ Casas-Tinto S, Zhang Y, Sanchez-Garcia J, Gomez-Velazquez M, Rincon-Limas DE, Fernandez-Funez P (červen 2011). „ER stresový faktor XBP1s brání neurotoxicitě amyloid-beta“. Lidská molekulární genetika. 20 (11): 2144–60. doi:10,1093 / hmg / ddr100. PMC 3090193. PMID 21389082.
- ^ Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH, Blumberg RS (září 2008). „XBP1 spojuje ER stres se zánětem střev a přináší genetické riziko pro lidské zánětlivé onemocnění střev“. Buňka. 134 (5): 743–56. doi:10.1016 / j.cell.2008.07.021. PMC 2586148. PMID 18775308.
- ^ Walter, Peter. „Krátká řeč Petera Waltera: Rozvíjení UPR“. iBiologie.
- ^ Moreno JA, Halliday M, Molloy C, Radford H, Verity N, Axten JM, Ortori CA, Willis AE, Fischer PM, Barrett DA, Mallucci GR (říjen 2013). „Orální léčba zaměřená na rozvinutou proteinovou reakci brání neurodegeneraci a klinickému onemocnění u myší infikovaných priony“. Science Translational Medicine. 5 (206): 206ra138. doi:10.1126 / scitranslmed.3006767. PMID 24107777. S2CID 25570626.
