Vezikulární transportní protein - Vesicular transport adaptor protein - Wikipedia


Vezikulární transportní proteiny adaptéru jsou bílkoviny podílí se na tvorbě komplexů, které fungují v obchodování molekul z jedné subcelulární umístění do jiného.[2][3][4] Tyto komplexy koncentrují správné molekuly nákladu vezikuly ten pupen nebo vytlačit z jednoho organela a cestovat do jiného místa, kam je náklad doručen. I když byly vypracovány některé podrobnosti o tom, jak tyto adaptační proteiny dosahují své specifičnosti obchodování, je stále ještě co se naučit.
Existuje několik lidských poruch spojených s defekty komponent těchto komplexů[5][6] počítaje v to Alzheimerova choroba a Parkinsonovy nemoci.[7]
Proteiny






Většina proteinů adaptéru je heterotetramery. V komplexech AP jsou dva velké proteiny (∼ 100 kD ) a dva menší proteiny. Jeden z velkých proteinů se nazývá β (beta ), s β1 v komplexu AP-1, β2 v Komplex AP-2, a tak dále.[10] Druhý velký protein má v různých komplexech různá označení. V AP-1 se jmenuje γ (gama ), AP-2 má α (alfa ), AP-3 má δ (delta ), AP-4 má ε (epsilon ) a AP-5 má ζ (zeta ).[10] Dva menší proteiny jsou střední podjednotka s názvem μ (mu ∼50 kD) a malá podjednotka σ (sigma K20 kD) a pojmenovány 1 až 5 odpovídající 5 komplexům AP.[10] Součásti COPI (policajt jeden) a coatomer a TSET (T-set) komplex pro přenos membrány mají podobné heterotetramery komplexů AP.[11]
Retromer není úzce spjato, bylo přezkoumáno,[12] a jeho proteiny zde nebudou popsány. GGA (lokalizace Golgi, homologie ušní domény gama-adaptinu, proteiny vázající ARF) jsou skupina příbuzných proteinů (tři u lidí), které působí jako monomerní klatrinové adaptorové proteiny v různých důležitých obchodování s membránovými váčky,[13] ale nejsou podobné žádnému z komplexů AP a nebudou podrobně popsány v tomto článku. Stoniny (nezobrazené na hlavním obrázku) jsou také monomery podobné v některých ohledech GGA[4] a také o nich nebudeme v tomto článku podrobně pojednávat.
PTB jsou proteinové domény které zahrnují NUMB, DAB1 a DAB2. Epsin a AP180 v ANTH doménou jsou další adaptorové proteiny, které byly přezkoumány.[4]
Důležitý dopravní komplex COPII, nebyl zobrazen na hlavní postavě. Komplex COPII je heterohexamer, ale není úzce příbuzný komplexům AP / TSET. Jednotlivé proteiny komplexu COPII se nazývají SEK proteiny, protože jsou kódovány geny identifikovanými v sekretory mutanti kvasinek. Zvláště zajímavým aspektem COPII je, že může tvořit typické sférické vezikuly a tubuly k přepravě velkých molekul kolagen prekurzory, které se nevejdou do typických sférických vezikul. Struktura COPII byla popsána v otevřeném článku[14] a nebude předmětem tohoto článku. Toto jsou příklady mnohem větší sady adaptérů pro náklad.[3]
Evoluční úvahy
The poslední společný předek (MRCA) eukaryoty musel mít mechanismus pro obchodování molekul mezi nimi endomembrány a organely a byla hlášena pravděpodobná identita příslušného komplexu adaptéru.[11] Předpokládá se, že MRCA měla 3 proteiny zapojené do obchodování a že tvořila heterotrimer. Tento heterotrimer dále „dimerizoval“ a vytvořil šestičlenný komplex. Jednotlivé komponenty se dále změnily na současné komplexy v uvedeném pořadí, přičemž AP1 a AP2 se rozcházely jako poslední.[11]
Kromě toho jedna součást TSET, a muniscin také známý jako protein TCUP, se zdá, že se vyvinul do části proteinů proteinu opisthokonts (zvířata a houby ).[11] Části komplexů AP se vyvinuly do částí proteinů GGA a stoninu.[4] Existují důkazy o tom, že části jaderný pór komplex a COPII mohou být evolučně příbuzné.[15]
Tvorba transportních vezikul


Nejlépe charakterizovaným typem vezikul je clathrin potažený vezikul (CCV). Tvorba vezikuly COPII na endoplazmatické retikulum a jeho transport do Golgiho tělo. Zapojení heterotetrameru COPI je podobné jako u situace AP / klatrin, ale plášť COPI úzce nesouvisí s potahy CCV ani COPII vezikul.[16][17] AP-5 je spojen se 2 proteiny, SPG11 a SPG15, které mají nějakou strukturální podobnost s clathrin a může tvořit vrstvu kolem komplexu AP-5,[18] ale ultrastruktura tohoto pláště není známa. Povlak AP-4 není znám.[19][A]
Téměř univerzálním rysem sestavy pláště je nábor různých komplexů adaptérů na „dárcovskou“ membránu proteinem Arf1. Jedinou známou výjimkou je AP-2, kterou rekrutuje a zejména lipid plazmatické membrány.[20]
Dalším téměř univerzálním rysem sestavy kabátu je, že se nejprve získají adaptéry a poté se získají kabáty. Výjimkou je COPI, ve kterém je 7 proteinů přijímáno na membránu jako heptamer.[16]
Jak je znázorněno na přiloženém obrázku, produkce potaženého vezikulu není okamžitá a značný zlomek doby zrání se používá k provedení „abortivního“ nebo „marného“[21] interakce, dokud nenastane dostatek interakcí současně, aby se struktura mohla dále rozvíjet.[22]
Posledním krokem při tvorbě transportního váčku je „odtržení“ od dárcovské membrány. To vyžaduje energii, ale i v dobře prostudovaném případě CCV to ne všechny vyžadují dynamin. Průvodní ilustrace ukazuje případ APV-2 CCV, avšak APV-1 a AP-3 CCV nepoužívají dynamin.[23]
Výběr molekul nákladu
Které molekuly nákladu jsou začleněny do konkrétního typu vezikul závisí na specifických interakcích. Některé z těchto interakcí jsou přímo s AP komplexy a některé nepřímo s „alternativními adaptéry“, jak je uvedeno v tento diagram.[4] Například membránové proteiny mohou mít přímé interakce, zatímco proteiny, které jsou rozpustné v lumen donorové organely se váže nepřímo na AP komplexy vazbou na membránové proteiny, které procházejí membránou a vážou se na svém lumenálním konci k požadované molekule nákladu. Zdá se, že molekuly, které by neměly být zahrnuty do vezikul, jsou vyloučeny „molekulárním shluknutím“.[24]
„Signály“ nebo „aminokyselinové„ motivy “v proteinech nákladu, které interagují s proteiny adaptéru, mohou být velmi krátké. Například jedním dobře známým příkladem je dileucin motiv, ve kterém je leucin aminokyselina (aa) po zbytku bezprostředně následuje další leucin nebo isoleucin zbytek.[25][b] Ještě jednodušší příklad je tyrosin založený signál, kterým je YxxØ (a tyzbytek kalafuny oddělený 2 zbytky aa od jiného objemného, hydrofobní aa zbytek). Průvodní obrázek ukazuje, jak může malá část proteinu interagovat specificky s jiným proteinem, takže tyto krátké signální motivy by neměly být překvapující.[26] Druh srovnání sekvencí použitý částečně k definování těchto motivů.[10]
V některých případechpřekladový modifikace, jako např fosforylace (zobrazené na obrázku) jsou důležité pro rozpoznání nákladu.
Nemoci
Nemoci adaptéru byly zkontrolovány.[6]
AP-2 / CCV jsou zapojeny do autosomálně recesivní hypercholesterolemie prostřednictvím přidruženého protein adaptéru lipoproteinového receptoru s nízkou hustotou.[27][28]
Retromer se podílí na recyklaci složek plazmatické membrány. Důležitost této recyklace na a synapse je naznačen na jedné z postav v galerii. Existují alespoň 3 způsoby, jak může dysfunkce retromeru přispět k poruchám mozku, včetně Alzheimerovy a Parkinsonovy choroby.[7]
AP-5 je naposledy popsaný komplex a jedním z důvodů podporujících myšlenku, že se jedná o autentický komplex adaptérů, je to, že je spojen s dědičná spastická paraplegie,[18] stejně jako AP-4.[6] AP-1 je spojen s MEDNIK syndrom. AP-3 je spojen s Hermanského – Pudlakův syndrom. COPI je spojen s autoimunitní onemocnění.[29] COPII je spojen s kranio-lenticulo-suturální dysplázie Jeden z GGA proteinů může být zapojen do Alzheimerovy choroby.[30]
Galerie

Složky Synapse se recyklují prostřednictvím transportních vezikul
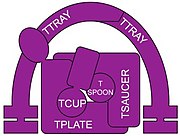
Komplex transportu membrán TSET
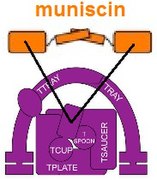
Muniscin se vyvinul z části TCUP

Vezikulové transportní cesty v rostlinách.
Viz také
Poznámky
- ^ AP-4 je mnohem méně hojný než jiné AP komplexy a chybí u několika modelových organismů, což ztěžuje biochemické a genetické analýzy.
- ^ Úplný motiv na bázi „dileucinu“ je (D / E) XXXL (L / I), kde X je libovolná aa a D / E je buď aspartický nebo glutamová zbytky kyselin
Reference
- ^ Odlišný pohled na 5 komplexů AP lze vidět zde “ Mattera R, Guardia CM, Sidhu SS, Bonifacino JS (2015). „Obrázek 1: Izolace Tepsinu jako interagátoru AP-4“. J Biol Chem. 290 (52): 30736–49. doi:10,1074 / jbc.M115,683409. PMC 4692204. PMID 26542808.
- ^ Bonifacino JS (2014). „Adaptační proteiny zapojené do polarizovaného třídění“. The Journal of Cell Biology. 204 (1): 7–17. doi:10.1083 / jcb.201310021. PMC 3882786. PMID 24395635.
- ^ A b Paczkowski JE, Richardson BC, Fromme JC (2015). „Nákladní adaptéry: struktury osvětlují mechanismy regulující biogenezi vezikul“. Trendy v buněčné biologii. 25 (7): 408–16. doi:10.1016 / j.tcb.2015.02.005. PMC 4475447. PMID 25795254.
- ^ A b C d E Robinson MS (2015). "Čtyřicet let Clathrinem potažených vezikulů" (PDF). Provoz. 16 (12): 1210–38. doi:10.1111 / tra.12335. PMID 26403691. S2CID 13761396.
- ^ De Matteis MA, Luini A (září 2011). „Mendelovy poruchy obchodování s membránami“. The New England Journal of Medicine. 365 (10): 927–38. doi:10.1056 / NEJMra0910494. PMID 21899453.
- ^ A b C Bonifacino J (28. ledna 2014). „Adaptační choroby: přemostění buněčné biologie a medicíny“. videocast.nih.gov. Národní institut zdraví. Citováno 15. dubna 2017.
- ^ A b Small SA, Petsko GA (březen 2015). „Retromer u Alzheimerovy choroby, Parkinsonovy choroby a dalších neurologických poruch“. Recenze přírody. Neurovědy. 16 (3): 126–32. doi:10.1038 / nrn3896. PMID 25669742. S2CID 5166260.
- ^ "tady".
- ^ McMahon, Harvey T .; Gallop, Jennifer L. (2005). "tady". Příroda. 438 (7068): 590–596. doi:10.1038 / příroda04396. PMID 16319878. S2CID 4319503.
- ^ A b C d Mattera R, Guardia CM, Sidhu SS, Bonifacino JS (2015). „Bivalentní interakce mezi motivem a uchem zprostředkovávají asociaci doplňkového proteinu Tepsin s komplexem adaptéru AP-4“. The Journal of Biological Chemistry. 290 (52): 30736–49. doi:10,1074 / jbc.M115,683409. PMC 4692204. PMID 26542808.
- ^ A b C d Hirst J, Schlacht A, Norcott JP, Traynor D, Bloomfield G, Antrobus R, Kay RR, Dacks JB, Robinson MS (2014). „Charakterizace TSET, starodávného a rozšířeného komplexu obchodování s membránami“. eLife. 3: e02866. doi:10,7554 / eLife.02866. PMC 4031984. PMID 24867644.
- ^ Burd C, Cullen PJ (2014). „Retromer: hlavní dirigent třídění endosomu“. Perspektivy Cold Spring Harbor v biologii. 6 (2): a016774. doi:10.1101 / cshperspect.a016774. PMC 3941235. PMID 24492709.
- ^ Tan J, Evin G (2012). „Β-místo APP štěpící enzym 1 a patogeneze Alzheimerovy choroby“. Journal of Neurochemistry. 120 (6): 869–80. doi:10.1111 / j.1471-4159.2011.07623.x. PMID 22171895. S2CID 44408418.
- ^ Zanetti G, Prinz S, Daum S, Meister A, Schekman R, Bacia K, Briggs JA (2013). „Struktura pláště transportního váčku COPII sestaveného na membránách“. eLife. 2: e00951. doi:10,7554 / eLife.00951. PMC 3778437. PMID 24062940.
- ^ Promponas VJ, Katsani KR, Blencowe BJ, Ouzounis CA (2016). „Důkazy o posloupnosti společného původu eukaryotických endomembránových koatomů“. Vědecké zprávy. 6: 22311. Bibcode:2016NatSR ... 622311P. doi:10.1038 / srep22311. PMC 4773986. PMID 26931514.
- ^ A b Faini M, Beck R, Wieland FT, Briggs JA (červen 2013). "Pláště vezikul: struktura, funkce a obecné zásady montáže". Trendy v buněčné biologii. 23 (6): 279–88. doi:10.1016 / j.tcb.2013.01.005. PMID 23414967.
- ^ Jackson LP (srpen 2014). "Struktura a mechanismus biogeneze vezikul COPI". Současný názor na buněčnou biologii. 29: 67–73. doi:10.1016 / j.ceb.2014.04.009. PMID 24840894.
- ^ A b Hirst J, Borner GH, Edgar J, Hein MY, Mann M, Buchholz F, Antrobus R, Robinson MS (2013). „Interakce mezi AP-5 a dědičnými spastickými paraplegiovými proteiny SPG11 a SPG15“. Molekulární biologie buňky. 24 (16): 2558–69. doi:10,1091 / mbc.E13-03-0170. PMC 3744948. PMID 23825025.
- ^ Frazier MN, Davies AK, Voehler M, Kendall AK, Borner GH, Chazin WJ, Robinson MS, Jackson LP (2016). "Molekulární základ interakce mezi AP4 β4 a jeho doplňkovým proteinem, Tepsin". Provoz. 17 (4): 400–15. doi:10.1111 / tra.12375. PMC 4805503. PMID 26756312.
- ^ Yu X, Breitman M, Goldberg J (2012). „Mechanismus založený na struktuře pro nábor coatomeru na membrány závislý na Arf1“. Buňka. 148 (3): 530–42. doi:10.1016 / j.cell.2012.01.015. PMC 3285272. PMID 22304919.
- ^ Kirchhausen, Tom. „Budování bublin“. youtube.com. harvard.edu. Citováno 23. dubna 2017.
- ^ Cocucci E, Aguet F, Boulant S, Kirchhausen T (srpen 2012). „Prvních pět sekund v životě jámy pokryté klatrinem“. Buňka. 150 (3): 495–507. doi:10.1016 / j.cell.2012.05.047. PMC 3413093. PMID 22863004.
- ^ Kural C, Tacheva-Grigorova SK, Boulant S, Cocucci E, Baust T, Duarte D, Kirchhausen T (2012). „Dynamika intracelulárních nosičů obsahujících klatrin / AP1- a klatrin / AP3“. Zprávy buněk. 2 (5): 1111–9. doi:10.1016 / j.celrep.2012.09.025. PMC 3513667. PMID 23103167.
- ^ Hirst J, Edgar JR, Borner GH, Li S, Sahlender DA, Antrobus R, Robinson MS (2015). „Příspěvky epsinR a gadkin k intracelulárnímu obchodu zprostředkovanému klatrinem“. Molekulární biologie buňky. 26 (17): 3085–103. doi:10,1091 / mbc.E15-04-0245. PMC 4551321. PMID 26179914.
- ^ Mattera R, Boehm M, Chaudhuri R, Prabhu Y, Bonifacino JS (2011). „Zachování a diverzifikace rozpoznávání signálu dileucinu variantami komplexu adaptorového proteinu (AP)“. The Journal of Biological Chemistry. 286 (3): 2022–30. doi:10.1074 / jbc.M110.197178. PMC 3023499. PMID 21097499.
- ^ Traub LM, Bonifacino JS (2013). „Rozpoznání nákladu u klatrinem zprostředkované endocytózy“. Perspektivy Cold Spring Harbor v biologii. 5 (11): a016790. doi:10.1101 / cshperspect.a016790. PMC 3809577. PMID 24186068.
- ^ Online Mendelian Inheritance in Man (OMIM): 605747
- ^ „Entrez Gene: LDLRAP1 protein s nízkou hustotou lipoproteinového receptorového adaptéru 1“.
- ^ Online Mendelian Inheritance in Man (OMIM): 616414
- ^ Online Mendelian Inheritance in Man (OMIM): 606006
externí odkazy
- Koláž z elektronových mikrofotografií ukazujících váčky COPI, COPII a clathrin
- struktura pláště COPI z tato publikace, zdarma s registrací zdarma
- Video popis choroby COPII CLSD
- Videa iBiologie od Kai Simons o lipidy, lipidové rafty a obchodování s buňkami





