Weinrebova syntéza ketonů - Weinreb ketone synthesis
| Weinrebova syntéza ketonů | |
|---|---|
| Pojmenoval podle | Steven M. Weinreb |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | syntéza weinreb-ketonu |
The Weinreb – Nahmova syntéza ketonů je chemická reakce používaná v organická chemie dělat vazby uhlík-uhlík. To bylo objeveno v roce 1981 Steven M. Weinreb a Steven Nahm jako metoda syntézy ketony.[1] Původní reakce zahrnovala dva následující nukleofilní acylové substituce: přeměna chlorid kyseliny s N, O-dimethylhydroxylamin, k vytvoření a Weinreb – Nahm amida následné ošetření tohoto druhu an organokovový činidlo, jako je a Grignardovo činidlo nebo organolithné činidlo. Nahm a Weinreb také uvedli syntézu aldehydy podle snížení z amide s přebytkem lithiumaluminiumhydrid (vidět redukce amidu ).

Hlavní výhodou této metody oproti přidání organokovových činidel k typičtějším acylovým sloučeninám je to, že se vyhýbá běžnému problému nadměrného přidávání. U těchto posledních reakcí dva ekvivalenty příchozí skupiny přidat k vytvoření alkohol spíše než keton nebo aldehyd. K tomu dochází, i když jsou ekvivalenty nukleofilu přísně kontrolovány.

Amid Weinreb – Nahm byl od té doby adoptován do pravidelného používání organickými chemiky jako spolehlivá metoda pro syntézu ketonů. Tyto funkční skupiny jsou přítomny ve velkém počtu přírodní produkty a lze spolehlivě reagovat za vzniku nových vazeb uhlík-uhlík nebo převést na jiné funkční skupiny. Tato metoda byla použita v řadě syntéz, včetně Macrosphelides A a B,[2] Amphidinolid J,[3] a spirofunginy A a B.[4] (Vidět Rozsah níže)
Mechanismus
Weinreb a Nahm původně navrhovali následující mechanismus reakce vysvětlit selektivitu ukázanou v reakcích Weinrebova – Nahmova amidu. Jejich návrh byl, že čtyřboký meziprodukt (A níže) vytvořené v důsledku nukleofilní adice podle organokovový činidlo je stabilizováno chelace z methoxy skupina, jak je znázorněno.[1] Tento meziprodukt je stabilní pouze při nízkých teplotách, které vyžadují nízkou teplotu uhasit.

Tato chelatace je na rozdíl od mechanismu tvorby nadměrně přidávaného produktu, kde kolaps čtyřstěnného meziproduktu umožňuje druhé přidání. Mechanistická domněnka ze strany Weinrebu byla akademickou komunitou okamžitě přijata, ale až v roce 2006 byla potvrzena spektroskopickými a kinetickými analýzami.[5]
Příprava
Kromě výše uvedeného původního postupu (který může mít problémy s kompatibilitou pro citlivé substráty) lze Weinrebovy amidy syntetizovat z různých acyl sloučeniny. Drtivá většina těchto postupů využívá komerčně dostupnou sůl N, O-dimethylhydroxylamin hydrochlorid [MeO (Me) NH • HCl], se kterým se obvykle zachází snáze než s volným aminem.[6]
Léčba an ester nebo lakton s AlMe3 nebo AlMe2Cl poskytuje odpovídající Weinrebův amid v dobrých výtěžcích. Alternativně lze k aktivaci aminu před přidáním esteru použít nenukleofilní Grignardova činidla, jako je isopropylmagnesiumchlorid.[7]
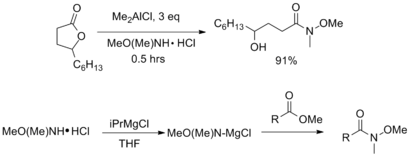
Různé peptidová vazba činidla lze také použít k přípravě Weinreb – Nahm amidů z karboxylových kyselin. Rozličný karbodiimid -, hydroxybenzotriazol -, a trifenylfosfin spojky založené na bázi byly hlášeny speciálně pro tento účel.[6][7]

A konečně, aminokarbonylační reakce uváděná Stephenem Buchwaldem umožňuje konverzi aryl halogenidy přímo do amidů aryl Weinreb – Nahm.[8]

Rozsah
Je známo, že standardní podmínky pro syntézu Weinreb-Nahmova ketonu tolerují širokou škálu funkčních skupin jinde v molekule, včetně substituce alfa-halogenem, chráněné N aminokyseliny, nenasycení α-β, silyl ethery, rozličný laktamy a laktony, sulfonáty, estery sulfinátů a fosfonátů.[6][7] Ve spojení s amidem lze použít širokou škálu nukleofilů. Lithiates a Grignardova činidla jsou nejčastěji zaměstnáni; příklady zahrnující alifatický, vinyl, aryl, a alkynyl uhlík nukleofily byl nahlášen. Avšak u vysoce bazických nebo stéricky bráněných nukleofilů může jako významná vedlejší reakce dojít k eliminaci methoxidové části za uvolnění formaldehydu.[9]

Nicméně amid Weinreb – Nahm figuruje prominentně v mnoha syntézách a slouží jako důležitý spojovací partner pro různé fragmenty. Níže jsou uvedeny klíčové kroky zahrnující Weinrebovy amidy při syntéze několika přírodních produktů, včetně členů imunosupresivum rodina Macrosphelides a antibiotikum rodina spirofunginů.[2][3][4]

Variace
Reakce Weinreba – Nahma amidy s Wittigova činidla bylo provedeno, aby se zabránilo někdy drsným podmínkám požadovaným pro přidání hydridových činidel nebo organokovových sloučenin. Tím se získá N-methyl-N-methoxy-enamin který se po hydrolytickém zpracování převede na odpovídající keton nebo aldehyd.[10]

Kromě toho byla vyvinuta výměna hořčík-halogen v jedné nádobě s následnou arylací, která ukazuje stabilitu Weinreb-Nahmova amidu a poskytuje provozně jednoduchou metodu syntézy arylketonů.[11]
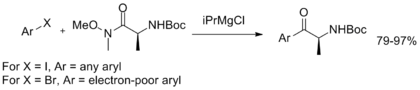
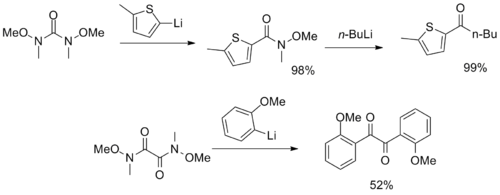
Byly syntetizovány neobvyklejší reagencie s více aminovými funkčními skupinami Weinreb – Nahm, které sloužily jako CO2 a a-diketon synthony.[12][13]
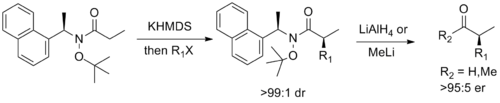
Konečně, Stephen G. Davies z Oxford navrhl a chirální pomocný který kombinuje funkčnost Weinrebského amidu s Myersovým pseudoefedrin pomocné, umožňující diastereoselektivní izolovat alkylace s následným snadným štěpením na odpovídající enantioenchlorovaný aldehyd nebo keton.[14]
Viz také
Reference
- ^ A b Nahm, S .; Weinreb, S. M. (1981), „N-methoxy-n-methylamidy jako účinná acylační činidla“, Čtyřstěn dopisy, 22 (39): 3815–3818, doi:10.1016 / s0040-4039 (01) 91316-4
- ^ A b Paek, S.-M .; Seo, S.-Y .; Kim, S.-H .; Jung, J.-W .; Lee, Y.-S .; Jung, J.-K .; Suh, Y.-G. (2005), „Stručné syntézy (+) - Macrosphelides A a B“, Organické dopisy, 7 (15): 3159–3162, doi:10.1021 / ol0508429, PMID 16018610
- ^ A b Barbazanges, M .; Meyer, C .; Cossy, J. (2008), „Total Synthesis of Amphidinolidide J“, Organické dopisy, 10 (20): 4489–4492, doi:10.1021 / ol801708x, PMID 18811171
- ^ A b Shimizu, T .; Satoh, T .; Murakoshi, K .; Sodeoka, M. (2005), „Asymetrická celková syntéza (-) - spirofunginu A a (+) - spirofunginu B“, Organické dopisy, 7 (25): 5573–5576, doi:10.1021 / ol052039k, PMID 16320994
- ^ Qu, B .; Collum, D. B. (2006), "Mechanismus acylace fenylacetylidu lithného s Weinrebovým amidem", The Journal of Organic Chemistry, 71 (18): 7117–7119, doi:10.1021 / jo061223w, PMID 16930080
- ^ A b C Singh, J .; Satyamurthi, N .; Aidhen, I. S. (2000), „The Growth Synthetic Utility of Weinreb's Amide“, Journal für praktische Chemie, 342: 340, doi:10.1002 / (sici) 1521-3897 (200004) 342: 4 <340 :: aid-prac340> 3.0.co; 2-1
- ^ A b C Mentzel, M .; Hoffmann, H. M. R. (1997), „N-methoxy-N-methylamidy (Weinrebovy amidy) v moderní organické syntéze“, Journal für Praktische Chemie / Chemiker-Zeitung, 339: 517–524, doi:10.1002 / prac.19973390194
- ^ Martinelli, J. R .; Freckmann, D. M. M .; Buchwald, S. L. (2006), „Pohodlná metoda pro přípravu Weinrebových amidů pomocí Pd-katalyzované aminokarbonylace arylbromidů při atmosférickém tlaku“, Organické dopisy, 8 (21): 4843–4846, doi:10.1021 / ol061902t, PMID 17020317
- ^ Graham, S.L .; Scholz, T. H. (1990), „Nový způsob reaktivity N-methoxy-N-methylamidů se silně bazickými činidly“, Čtyřstěn dopisy, 31 (44): 6269–6272, doi:10.1016 / s0040-4039 (00) 97039-4
- ^ Hisler, K .; Tripoli, R .; Murphy, J. A. (2006), „Reakce Weinrebových amidů: tvorba aldehydů Wittigovými reakcemi“, Čtyřstěn dopisy, 47 (35): 6293–6295, doi:10.1016 / j.tetlet.2006.06.118
- ^ Conrad, K .; Hsiao, Y .; Miller, R. (2005), „Praktický proces syntézy α-amino-arylketonu v jedné nádobě“, Čtyřstěn dopisy, 46 (49): 8587–8589, doi:10.1016 / j.tetlet.2005.09.183
- ^ Whipple, W. L .; Reich, H. J. (1991), "Použití N, N'-dimethoxy-N, N'-dimethylmočoviny jako ekvivalentu karbonylové diikace v organokovových adičních reakcích. Syntéza nesymetrických ketonů", The Journal of Organic Chemistry, 56 (8): 2911–2912, doi:10.1021 / jo00008a057
- ^ Sibi, M. P .; Sharma, R .; Paulson, K. L. (1992), "N, N'-dimethoxy-N, N-dimethyletandiamid: Užitečný a-oxo-N-methoxy-N-methylamid a 1,2-diketon synthon", Čtyřstěn dopisy, 33: 1941, doi:10.1016 / 0040-4039 (92) 88108-h
- ^ Davies, S. G .; Goodwin, C. J .; Hepworth, D .; Roberts, P. M .; Thomson, J. E. (2010), „O počátcích diastereoselektivity při alkylaci enolátů odvozených od N-l- (l'-naftyl) ethyl-O-terc-butylhydroxamátů: chirál Weinrebovy amidové ekvivalenty“, The Journal of Organic Chemistry, 75 (4): 1214–1227, doi:10.1021 / jo902499s, PMID 20095549
