Sandmeyerova reakce - Sandmeyer reaction
| Sandmeyerova reakce | |
|---|---|
| Pojmenoval podle | Traugott Sandmeyer |
| Typ reakce | Substituční reakce |
| Identifikátory | |
| Portál organické chemie | Sandmeyerova reakce |
| RSC ontologické ID | RXNO: 0000021 |
The Sandmeyerova reakce je chemická reakce používá se k syntéze arylhalogenidy z arylu diazoniové soli za použití solí mědi jako činidel nebo katalyzátorů.[1][2][3]Je to příklad radikálově nukleofilní aromatické substituce. Sandmeyerova reakce poskytuje metodu, pomocí které lze provádět jedinečné transformace na benzen, jako je halogenace, kyanace, trifluormethylace, a hydroxylace.
Reakci objevil v roce 1884 švýcarský chemik Traugott Sandmeyer, když se pokusil syntetizovat fenylacetylen z benzendiazoniumchloridu a měďnatý acetylid. Místo toho byl jeho hlavním produktem fenylchlorid.[4] V moderní době se Sandmeyerova reakce týká jakéhokoli způsobu substituce aromatické aminoskupiny přípravou její diazoniové soli a následným vytěsněním nukleofilem v přítomnosti katalytických solí mědi. (Vzhledem k nízké ceně solí mědi se pro lepší reaktivitu často používá stechiometrické množství, i když je možná katalýza.) Nejčastěji používanými Sandmeyerovými reakcemi jsou reakce chlorace, bromace, kyanace a hydroxylace za použití CuCl, CuBr, CuCN, a Cu2O, resp. V poslední době byla vyvinuta trifluormethylace diazoniových solí, která se označuje jako reakce Sandmeyerova typu. Diazoniové soli také reagují s boronáty, jodidem, thioly voda kyselina fosforná a další,[5] a fluorace se může provádět za použití tetrafluorborátových aniontů (Balz-Schiemannova reakce ). Protože však tyto procesy nevyžadují kovový katalyzátor, nejsou obvykle označovány jako Sandmeyerovy reakce. V mnoha variantách, které byly vyvinuty, byly také použity jiné soli přechodných kovů, včetně mědi (II), železa (III) a kobaltu (III).[6] Díky své široké syntetické použitelnosti je Sandmeyerova reakce, spolu s dalšími transformacemi diazoniových sloučenin, komplementární k elektrofilní aromatická substituce.
Reakční podmínky a mechanismus
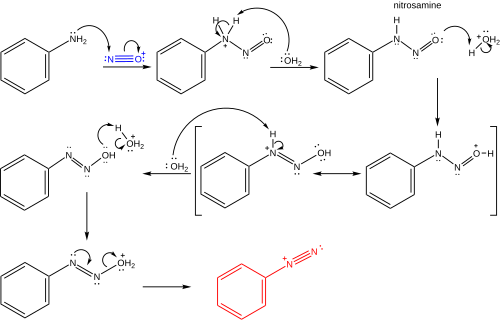
The kyselina dusitá je obvykle připraven in situ z dusitan sodný a kyselina. Následující dva protonace kroky se ztratí jeden ekvivalent vody za vzniku nitrosoniový ion. Nitrosoniový iont pak působí jako elektrofil v reakci s aromatický (nebo heterocyklický ) amin, jako je anilin, za vzniku diazoniové soli, postupuje se a nitrosamin středně pokročilí.[5] Typické reakční podmínky jsou následující:[7][8]
Chlorace: ArN2+Cl–CuCl, HCI (36% vod.), 50 - 100 ° C; bromace: ArN2+HSO4–CuBr, HBr (48% vod.), 50 - 100 ° C; kyanace: ArN2+Cl–, CuCN, KCN, H2O, benzen, 0 ° C; hydroxylace: Cu2O, Cu (č3)2, H2O, 25 ° C.
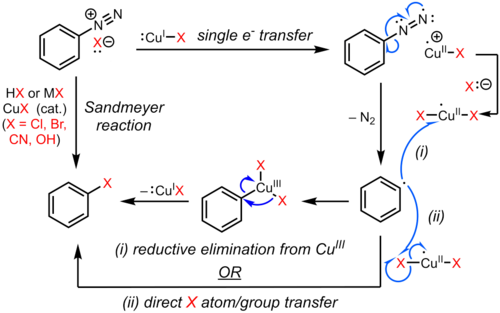
Sandmeyerova reakce je příkladem a radikál-nukleofilní aromatická substituce (S.RNAr). Radikální mechanismus Sandmeyerovy reakce je podporován detekcí biaryl vedlejší produkty.[9] Substituce aromatické diazo skupiny halogenem nebo pseudohalogen je iniciováno mechanismem přenosu jednoho elektronu katalyzovaným mědí (I) za vzniku arylová skupina se ztrátou plynného dusíku.[10][11][12][9] Substituovaný arene je případně tvořen přímým přenosem Cl, Br, CN nebo OH z mědi (II) do arylového radikálu za vzniku substituovaného arenu a regenerace měďnatého katalyzátoru. V alternativním návrhu je přechodný meziprodukt mědi (III), vytvořený kondenzací arylového radikálu s mědí (II), podroben rychlé redukční eliminaci za získání produktu a regenerace mědi (I).[13][14][15] Důkazy pro takový organokoptický meziprodukt jsou však slabé a většinou nepřímé,[16][17] a přesná cesta může záviset na substrátu a reakčních podmínkách. Tyto možnosti jsou uvedeny níže.
Tvorba nitrosoniového iontu

Tvorba benzendiazoniového iontu
Jeden elektronový přenos
Syntetické aplikace
Varianty Sandmeyerovy reakce byly vyvinuty tak, aby vyhovovaly několika syntetickým aplikacím. Tyto reakce typicky probíhají tvorbou aryl diazoniové soli následovanou reakcí se solí mědi za získání substituovaného arenu podle níže uvedeného schématu.
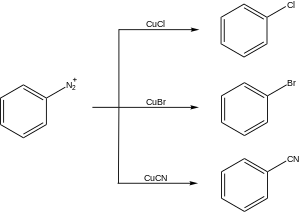
Některé příklady syntetických aplikací Sandmeyerovy reakce jsou uvedeny níže.
Halogenace
Jedním z nejdůležitějších použití Sandmeyerovy reakce je tvorba arylhalogenidů. Rozpouštědlo volby pro syntézu aryljodidy je dijodmethan,[18][19] zatímco pro syntézu arylbromidy, bromoform se používá. Pro syntézu arylchloridy, chloroform je rozpouštědlem volby.[20] Syntéza (+) - curcuphenolu, bioaktivní sloučeniny, která vykazuje antifungální a protirakovinovou aktivitu, využívá Sandmeyerovu reakci k nahrazení aminové skupiny bromovou skupinou.[21]

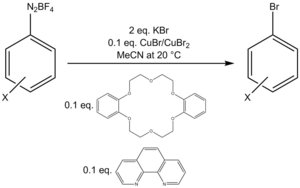
Jeden bromační protokol používá směs Cu (I) / Cu (II) s dalšími množstvími bidentate ligand fenanthrolin a katalyzátor fázového přenosu dibenzo-18-koruna-6 převést sůl aryl diazonium tetrafluorborátu na arylbromid.[22]
The Balz-Schiemannova reakce používá tetrafluorborát a dodává produkt substituovaný halogenidem, fluorobenzen, který není získán použitím fluoridy mědi. Tato reakce zobrazuje motivy charakteristické pro Sandmeyerovu reakci.[23]
Kyanace
Další použití Sandmeyerovy reakce je pro kyanace což umožňuje vznik benzonitrily, důležitá třída organických sloučenin. Klíčový meziprodukt při syntéze antipsychotické drogy, Fluanxol, je syntetizován kyanací Sandmeyerovou reakcí.[24]

Sandmeyerova reakce byla také použita při syntéze neoamfimedinu, sloučeniny, o které se předpokládá, že je cílena topoizomeráza II jako protinádorový lék.[25]

Trifluormethylace
Bylo prokázáno, že reakce Sandmeyerova typu lze použít ke generování arylových sloučenin funkcionalizovaných trifluormethylovými substitučními skupinami. Tento proces trifluormethylace poskytuje jedinečné chemické vlastnosti s celou řadou praktických aplikací. Zejména farmaceutika s CF3 skupiny byly vylepšeny metabolická stabilita, lipofilita, a biologická dostupnost. Trifluormethylační reakce Sandmeyerova typu se vyznačují mírnými reakčními podmínkami a větší tolerancí funkční skupiny ve srovnání s dřívějšími způsoby trifluormethylace.[26][27] Níže je uveden příklad trifluormethylační reakce Sandmeyerova typu.[28]

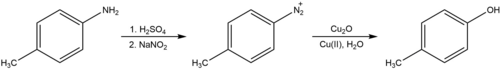
Hydroxylace
Sandmeyerovu reakci lze také použít k přeměně arylaminu na fenoly pokračující tvorbou aryl diazoniové soli, jak je uvedeno níže.[8] V přítomnosti měděného katalyzátoru probíhá tato reakce snadno při teplotě místnosti. Postup uváděný Cohenem a spolupracovníky vyžaduje oxid měďný spolu s přebytkem dusičnanu měďnatého v neutrální vodě. To je v rozporu s klasickým postupem (známým pod německým názvem Verkochung, Verkochung ), který vyžaduje vaření diazoniové soli ve vodné kyselině, což je proces, o kterém se předpokládá, že zahrnuje arylový kation místo radikálu a je známo, že kromě požadovaného hydroxylačního produktu generuje další vedlejší produkty nukleofilní adice.
Triazene
Léčba druhým ekvivalentem anilinu by poskytla a triazen. Porovnejte například Diminazen (Berenil) a Isometamidium chlorid.
Reference
- ^ Traugott Sandmeyer (1884). „Ueber die Ersetzung der Amidgruppe durch Chlor in den aromatischen Substanzen“. Berichte der deutschen chemischen Gesellschaft. 17 (3): 1633–1635. doi:10,1002 / cber.18840170219.
- ^ Traugott Sandmeyer (1884). „Ueber die Ersetzung der Amid-gruppe durch Chlor, Brom und Cyan in den aromatischen Substanzen“. Berichte der Deutschen Chemischen Gesellschaft. 17 (4): 2650–2653. doi:10,1002 / cber.188401702202.
- ^ Ludwig Gattermann (1890). „Untersuchungen über Diazoverbindungen“. Berichte der Deutschen Chemischen Gesellschaft. 23 (1): 1218–1228. doi:10.1002 / cber.189002301199.
- ^ Hodgson, Herbert H. (01.04.1947). „Sandmeyerova reakce“. Chemické recenze. 40 (2): 251–277. doi:10.1021 / cr60126a003. ISSN 0009-2665. PMID 20291034.
- ^ A b Wang, Zerong (2010). „Sandmeyerova reakce“. Komplexní reakce organických jmen a reagenty. John Wiley & Sons, Inc., str. 2471–2475. ISBN 9780470638859.
- ^ M. P. Doyle, B. Siegfried a J. F. Dellaria (1977). „Deaminační reakce na bázi alkylnitritu a halogenidu kovu. 2. Substituční deaminace arylaminů alkylnitrity a halogenidy mědi (II). Přímá a pozoruhodně účinná přeměna arylaminů na arylhalogenidy.“ J. Org. Chem. 42 (14): 2426–2431. doi:10.1021 / jo00434a017.
- ^ Chandler, Norman, R. O. C. (Richard Oswald (1993). Principy organické syntézy. Coxon, J. M. (James Morriss), 1941- (3. vyd.). London: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843.
- ^ A b Cohen, Theodore; Dietz, Albert G .; Miser, Jane R. (01.06.1977). „Jednoduchá příprava fenolů z diazoniových iontů generováním a oxidací arylových radikálů solemi mědi“. The Journal of Organic Chemistry. 42 (12): 2053–2058. doi:10.1021 / jo00432a003. ISSN 0022-3263.
- ^ A b Galli, Carlo (srpen 1988). „Radikální reakce arenediazoniových iontů: snadný vstup do chemie arylového radikálu“. Chemické recenze. 88 (5): 765–792. doi:10.1021 / cr00087a004.
- ^ J. K. Kochi (1957). „Mechanismus Sandmeyerových a Meerweinových reakcí“. J. Am. Chem. Soc. 79 (11): 2942–2948. doi:10.1021 / ja01568a066.
- ^ H. H. Hodgson (1947). „Sandmeyerova reakce“. Chem. Rev. 40 (2): 251–277. doi:10.1021 / cr60126a003. PMID 20291034.
- ^ Nonhebel, D. C .; Waters, W. A. (8. října 1957). „Studie mechanismu Sandmeyerovy reakce“. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 242 (1228): 16–27. Bibcode:1957RSPSA.242 ... 16N. doi:10.1098 / rspa.1957.0150. S2CID 97536209.
- ^ 1960-, Anslyn, Eric V. (2006). Moderní fyzikální organická chemie. Dougherty, Dennis A., 1952-. Sausalito, CA: University Science. ISBN 978-1891389313. OCLC 55600610.CS1 maint: číselné názvy: seznam autorů (odkaz)
- ^ C., Vollhardt, K. Peter (2018-01-29). Organická chemie: struktura a funkce. Schore, Neil Eric, 1948- (8e ed.). New York. ISBN 9781319079451. OCLC 1007924903.
- ^ 1937-, Carey, Francis A. (2007). Pokročilá organická chemie. Část B, Reakce a syntéza. Sundberg, Richard J., 1938- (5. vydání). New York, NY: Springer. ISBN 9781601195494. OCLC 223941000.CS1 maint: číselné názvy: seznam autorů (odkaz)
- ^ Timms, Allan W .; Walton, Paul H .; Rowell, Simon C .; Hanson, Peter (2004-06-28). "Propagace Sandmeyerovy hydroxylace (homolytická hydroxydediazoniace) a hydrodediazoniace chelatací měděného katalyzátoru: bidentátové ligandy". Organická a biomolekulární chemie. 2 (13): 1838–1855. doi:10.1039 / B404699D. ISSN 1477-0539. PMID 15227536.
- ^ Timms, Allan W .; Walton, Paul H .; Taylor, Alec B .; Rowell, Simon C .; Hanson, Peter (2002-05-22). „Sandmeyerovy reakce. Část 6. Mechanistické vyšetřování kroků redukce a přenosu ligandu při Sandmeyerově kyanaci.“ Journal of the Chemical Society, Perkin Transactions 2. 0 (6): 1126–1134. doi:10.1039 / B200747A. ISSN 1364-5471.
- ^ W. B. Smith; O. C. Ho (1990). "Aplikace cesty isoamylnitrit-dijodmethan na aryljodidy". J. Org. Chem. 55 (8): 2543–2545. doi:10.1021 / jo00295a056.
- ^ V. Nair; S. G. Richardson (1982). „Modifikace bází nukleových kyselin pomocí radikálových meziproduktů: Syntéza dihalogenovaných purinových nukleosidů“. Syntéza. 1982 (8): 670–672. doi:10.1055 / s-1982-29896.
- ^ J. I. G. Cadogan; D. A. Roy; D. M. Smith (1966). „Alternativa k Sandmeyerově reakci“. J. Chem. Soc.: 1249–1250. doi:10.1039 / J39660001249.
- ^ Kim, Sung-Gon; Kim, Jaehak; Jung, Heejung (duben 2005). "Efektivní celková syntéza (+) - curcuphenolu prostřednictvím asymetrické organokatalýzy". Čtyřstěn dopisy. 46 (14): 2437–2439. doi:10.1016 / j.tetlet.2005.02.047.
- ^ P. Beletskaya; Alexander S. Sigeev; Alexander S. Peregudov; Pavel V. Petrovskii (2007). "Katalytická Sandmeyerova bromace". Syntéza. 2007 (16): 2534–2538. doi:10.1055 / s-2007-983784.
- ^ Wang, Zerong (2009). Komplexní organické názvové reakce a činidla. Hoboken, N.J .: John Wiley. 185–190. ISBN 9780471704508.
- ^ Nielsen, Martin Anker; Nielsen, Michael Kim; Pittelkow, Thomas (listopad 2004). „Škálování a hodnocení bezpečnosti Sandmeyerovy reakce“. Výzkum a vývoj organických procesů. 8 (6): 1059–1064. doi:10.1021 / op0498823.
- ^ LaBarbera, Daniel V .; Bugni, Tim S .; Irsko, Chris M. (říjen 2007). "Celková syntéza neoamfimedinu". The Journal of Organic Chemistry. 72 (22): 8501–8505. doi:10.1021 / jo7017813. PMC 2547140. PMID 17900144.
- ^ Browne, Duncan L. (3. února 2014). „Trifluormethylační Sandmeyerova reakce: metoda transformace C-N na C-CF“. Angewandte Chemie International Edition. 53 (6): 1482–1484. doi:10,1002 / anie.201308997. PMID 24376150.
- ^ Dai, Jian-Jun; Fang, Chi; Xiao, Bin; Yi, červen; Xu, červen; Liu, Zhao-Jing; Lu, Xi; Liu, Lei; Fu, Yao (12. června 2013). „Měďem podporovaná Sandmeyerova trifluormethylační reakce“. Journal of the American Chemical Society. 135 (23): 8436–8439. doi:10.1021 / ja404217t. PMID 23718557.
- ^ Danoun, Grégory; Bayarmagnai, Bilguun; Grünberg, Matthias F .; Gooßen, Lukas J. (29. července 2013). "Sandmeyerova trifluormethylace arenediazonium tetrafluoroboritanů". Angewandte Chemie International Edition. 52 (31): 7972–7975. doi:10,1002 / anie.201304276. PMID 23832858.