Kyanace - Cyanation
V organické syntéze, kyanace je připojení nebo nahrazení a kyanid skupina na různých substráty. Takové transformace jsou vysoce hodnotné, protože generují C-C vazbu. Dále nitrily jsou univerzální funkční skupiny.
Kyanace za vzniku sp3 nitrily
Typicky se tvoří alkylnitrily přes SN1 nebo S.NKyanace 2 typu s alkyl elektrofily. Ilustrativní je syntéza benzylkyanid reakcí benzylchlorid a kyanid sodný.[1] V některých případech kyanid měďný se používá místo kyanidu sodného.[2]
Kyanací ketonů nebo aldehydů se získá odpovídající kyanohydriny, což lze provést přímo s kyanidovým iontem ( kyanohydrinová reakce ) nebo použitím hydrogensíranu a následným vytěsněním siřičitanu:[3][4]
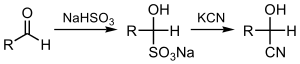
Související reakce je kyanovodík, který instaluje prvky H-CN.
Kyanace arenů
Kyanace arenů nabízí přístup k kyselina benzoová deriváty, stejně jako užitečnost samotných arylnitrilů jako čistých chemikálií:

Kyanátové areny jsou známy celou řadou mechanicky odlišných drah:
S arenem jako dvou elektronovým elektrofilem
Zatímco klasický Rosenmund Von-Braunova reakce využívá stechiometrický kyanid měďný jako zdroj kyanace,[5] byly vyvinuty novější varianty, které jsou katalytické v měď:[6]

Navíc, katalyzováno palladiem kyanace arylhalogenidy byly rozsáhle prozkoumány. Obvykle, KCN nebo jeho méně toxický náhradník Zn (CN)2 se používají jako nukleofilní zdroje kyanidů. Chcete-li dále zmenšit toxicita obavy, ferikyanid draselný byl také použit jako zdroj kyanidu. Katalytické cykly se předpokládá, že postupují standardní cestou Pd (0 / II) s redukční eliminace kování klíčové vazby C-C. Častým problémem je deaktivace Pd (II) přebytkem kyanidu.[7] Byly vyvinuty podmínky katalýzy palladia pro aryljodidy, bromidy a dokonce i chloridy:[8]

Kyanace katalyzované niklem se vyhýbají použití drahých kovů a mohou toho využít benzylkyanid nebo acetonitril jako zdroj kyanidu, přes redukční štěpení vazeb C-C:[9]

Sandmeyer kyanace je prostředek k přeměně anilin deriváty na benzonitrily.[10] Kyanace se obecně předpokládá jako dvouelektronová, zatímco s radikální mediátorů v nepřítomnosti kovů, je reakce pravděpodobně radikální.[11]
S arenem jako dvou elektronovým nukleofilem
Metalované areny lze kyanovat elektrofilní zdroje kyanidů, včetně kyanamidy, kyanatany, dimethylmalononitril nebo ethyl (ethoxymethylen) kyanoacetát. Tyto metody mohou pokračovat s zprostředkováním přechodovými kovy nebo bez nich:[12]

S arenem jako radikálním elektrofilem
Radikální přístupy k arenu C-H kyanace jsou známy. Photoredox mediátory (kovové nebo organické) jsou nejčastější:[13][14]

Reference
- ^ Adams, Roger; Thal, A. F. (1922). „Benzylkyanid“. Organické syntézy. 2: 9. doi:10.15227 / orgsyn.002.0009.
- ^ J. V. Supniewski; P. L. Salzberg (1928). „Allylkyanid“. Org. Synth. 8: 4. doi:10.15227 / orgsyn.008.0004.
- ^ Mowry, David T. (1948). „Příprava nitrilů“. Chemické recenze. 42 (2): 189–283. doi:10.1021 / cr60132a001. ISSN 0009-2665.
- ^ Corson, B. B .; Dodge, R. A .; Harris, S. A .; Yeaw, J. S. (1926). „Mandelic Acid“. Org. Synth. 6: 58. doi:10.15227 / orgsyn.006.0058.
- ^ Warzecha, Klaus-Dieter. „kyanidová substituce brombenzenu“.
- ^ Wu, Jeff (2002). „Katalytická Rosenmund – von Braunova reakce v iontových kapalinách na bázi halogenidů“. Čtyřstěn dopisy. 43: 387. doi:10.1016 / s0040-4039 (01) 02168-2.
- ^ Cohen, Daniel (2015). "Mírná kyanace katalyzovaná palladiem na (hetero) arylhalogenidy a trifláty ve vodném prostředí". Organické dopisy. 17: 202. doi:10.1021 / ol5032359.
- ^ Jin, Fuqiang (2000). "Kyanační reakce arylchloridů katalyzované palladiem". Čtyřstěn dopisy. 41: 3271. doi:10.1016 / s0040-4039 (00) 00384-1.
- ^ Ueda, Yohei (2019). „Nikl katalyzovaná kyanace arylhalogenidů a triflátů za použití acetonitrilu štěpením vazby C – CN za pomoci 1,4-bis (trimethylsilyl) -2,3,5,6-tetramethyl-1,4-dihydropyrazinu“. Chemická věda. 10: 994. doi:10.1039 / c8sc04437f.
- ^ H. T. Clarke; R. R. Read (1925). „o-Tolunitril a p-Tolunitril“. Org. Synth. 4: 69. doi:10.15227 / orgsyn.004.0069.
- ^ Barbero, Margherita (2016). „Sandyyerova kyanace arenediazonium o-benzendisulfonimidů bez mědi“. Organická a biomolekulární chemie. 14: 1437. doi:10.1039 / c5ob02321a. hdl:2318/1554335.
- ^ Reeves, Jonathan (2015). „Transnitrilace z dimethylmalononitrilu na arylgrignard a lithiové reagencie: praktická metoda syntézy arylnitrilu“. Journal of the American Chemical Society. 137: 9481. doi:10.1021 / jacs.5b06136.
- ^ Ravelli, Davide; Protti, Stefano; Fagnoni, Maurizio (2016). „Reakce vytvářející vazby uhlík-uhlík prostřednictvím fotogenních meziproduktů“. Chemické recenze. 116: 9850–9913. doi:10.1021 / acs.chemrev.5b00662.
- ^ Li, Jie Jack (2015). Aktivace CH vazby v organické syntéze. CRC Press, Taylor & Francis Group.
