Léčba talasemie - Management of thalassemia
Léčba dědičné poruchy krve talasémie závisí na úrovni závažnosti. U mírných forem onemocnění je často nutné pouze poradenství a poradenství. U těžších forem může léčba spočívat v krevní transfúze; chelatační terapie obrátit přetížení železem, užívání drog, jako je deferoxamin, deferipron nebo deferasirox; léky s antioxidantem indikaxin aby se zabránilo zhroucení hemoglobin; nebo a transplantace kostní dřeně pomocí materiálu od kompatibilního dárce nebo od matky pacienta. Odstranění sleziny (splenektomie ) by teoreticky mohl pomoci snížit potřebu krevních transfuzí u lidí s thalassemia major nebo intermedia, ale v současné době neexistují spolehlivé důkazy z klinických studií o jejich účincích.[1] Populace promítání preventivně uspěl.
Úrovně závažnosti
- Mírná talasemie: pacienti s talasemií rysy po stanovení počáteční diagnózy nevyžadují lékařskou ani následnou péči.[2] Pacienti s β-thalassemickým znakem by měli být varováni, že jejich stav může být špatně diagnostikován pro běžné Anémie z nedostatku železa. Měli by se vyhýbat empirickému použití Terapie železem; přesto se může nedostatek železa vyvinout během těhotenství nebo z chronického krvácení.[3] Poradenství je indikováno u všech osob s genetickými poruchami, zejména pokud je v rodině riziko těžké formy onemocnění, kterému lze předcházet.[4]
- Těžká talasemie: Pacienti s těžkou talasemií vyžadují lékařské ošetření. Režim krevní transfuze byl prvním měřítkem účinným při prodloužení života.[2]
Léky
Pacienti s talasemií postupně akumulují vysoké hladiny železa (Fe) v těle. Toto hromadění železa může být způsobeno samotným onemocněním, nepravidelně hemoglobin nesprávné zabudování adekvátního železa do jeho struktury, nebo to může být způsobeno mnoha krevními transfuzi, které pacient dostal. Toto přetížení železem s sebou přináší mnoho biochemických komplikací.
Dvě klíčové látky podílející se na transportu a ukládání železa v těle jsou feritin a transferin. Ferritin je protein přítomný v buňkách, který se váže na Fe (II) a ukládá jej jako Fe (III) a uvolňuje jej do krve, kdykoli je to nutné. Transferrin je protein vázající železo přítomný v krevní plazmě; transferin působí jako transportér, který přenáší železo krví a poskytuje buňkám kov endocytóza. Transferin je vysoce specifický pro železo (III) a váže se na něj pomocí rovnovážná konstanta z 1023 M−1 při pH 7,4.[5]
Thalasémie vede k tomu, že v krvi je k dispozici železo vázané na ne-transferin, protože veškerý transferin je plně nasycen. Toto volné železo je pro tělo toxické, protože katalyzuje reakce, které generují volný hydroxyl radikály.[6] Tyto radikály mohou indukovat peroxidace lipidů organel, jako jsou lysosomy, mitochondrie a sarkoplazmatické membrány. Výsledné lipidové peroxidy mohou interagovat s jinými molekulami za vzniku křížových vazeb, a tak buď způsobí, že tyto sloučeniny budou špatně vykonávat své funkce, nebo je zcela znefunkční.[6] Toto přetížení železem může být léčeno chelatační terapie. Deferoxamin, deferipron a deferasirox jsou tři nejčastěji používaná chelatační činidla pro železo.
Deferoxamin
Struktura a koordinace
Droga deferoxamin, také známý jako desferoxamin B a DFO-B, je a kyselina trihydroxamová který vyrábí aktinobakterie Streptomyces pilosus. Váže železo, snižuje toxické reakce katalyzované nenavázaným kovem a také snižuje absorpci železa tkáněmi. Deferoxamin toho dosahuje působením jako hexadentát žehlička-chelátování ligand: váže se na všech šest koordinačních míst na železu vázaném na nepřenosné látky a účinně jej deaktivuje.[7] Deferoxamin je většinou specifický pro železitý železo (Fe3+) a souřadnice Fe3+ pomocí atomů kyslíku na jeho násobkuhydroxyl a karbonyl skupiny, tvořící strukturu zvanou ferrioxamin. Tento komplex léčivo-železo je většinou vylučován ledvinami, protože je rozpustný ve vodě.[8] Přibližně jedna třetina ferrioxaminu mohla být také vylučována stolicí ve žluči.[6]
Správa a akce
Deferoxamin se podává prostřednictvím intravenózní, intramuskulární nebo subkutánní injekce. Perorální podání není možné, protože deferoxamin je rychle metabolizován enzymy a špatně se vstřebává z gastrointestinálního traktu. Požadováno parenterální podání představuje jeden z pádů deferoxaminu, protože pro pacienty je obtížnější sledovat jejich terapii kvůli finanční a emoční zátěži, která se vyskytla.[9]Bylo prokázáno, že deferoxamin léčí mnoho klinických komplikací a nemocí, které jsou důsledkem přetížení železem. Příznivě to ovlivňuje srdeční onemocnění, jako je onemocnění myokardu, ke kterému dochází v důsledku akumulace železa v srdci.[10] Bylo také prokázáno, že deferoxamin zlepšuje funkci jater zastavením vývoje jaterní fibróza ke kterému dochází v důsledku akumulace železa v játrech.[11] Deferoxamin má také pozitivní účinky na endokrinní funkce a růst. Endokrinní abnormality u pacientů s talasemií zahrnují přetížené železo interferující s produkcí růstového faktoru podobného inzulínu (IGF-1 ), stejně jako stimulující hypogonadismus, které oba způsobují špatný pubertální růst. Studie ukázala, že 90% pacientů, kteří byli od dětství pravidelně léčeni deferoxaminem, mělo normální pubertální růst, který klesl na 38% u pacientů léčených pouze malými dávkami deferoxaminu od jejich dospívání.[6] Další endokrinní abnormalita, které čelí pacienti s talasemií, je diabetes mellitus, který je výsledkem poškození železem v pankreatu inzulín vylučování. Studie prokázaly, že pacienti, kteří byli pravidelně léčeni deferoxaminem, mají snížené riziko vzniku diabetes mellitus.[12]
Vedlejší efekty
Pokud jsou podávány dávky vyšší než 50 mg / kg tělesné hmotnosti, může deferoxamin vést k toxickým vedlejším účinkům. Tyto nežádoucí účinky mohou zahrnovat sluchové a oční abnormality, plicní toxicita, senzomotor neurotoxicita, stejně jako změny funkce ledvin.[6] Dalším toxickým účinkem deferoxaminu, který je většinou pozorován u dětí, je selhání lineárního růstu. Toto snížení výšky může nastat v důsledku toho, že deferoxamin chelatuje jiné kovy než železo, které jsou potřebné pro normální růst. afinitní konstanta (K.A) z 1031 pro Fe3+, 1014 pro Cu2+ a 1010 pro Zn2+, a tak se může koordinovat na zinek a měď, když je k dispozici málo železa pro chelataci. Zinek je potřebný pro správné fungování různých látek metaloenzymy podílí se na tvorbě kostí. Chelace zinku může způsobit nedostatek zinku v těle, což může vést ke snížení rychlosti růstu kolagen tvorba a vadná mineralizace kostí. Podobně funguje měď jako enzymový kofaktor při tvorbě kostí. Chelatace mědi může také vést k nedostatku mědi, což vede k metafýza baňkování a osteoporóza. Například při nedostatku mědi jako enzymu se tvoří abnormální kolagen lysyl oxidáza, který používá jako kofaktor měď a katalyzuje oxidační deaminace krok, který je důležitý pro zesíťování kolagenu, nemůže správně fungovat. Studie ukázaly, že i když krevní sérum u pacientů léčených deferoxaminem nebyl nedostatek mědi a zinku, byly pozorovány nedostatky kovů v metafyzální matrici.
Toxický účinek deferoxaminu na lineární růst může být také způsoben přebytkem deferoxaminu akumulujícího se ve tkáních a interferencí s enzymy závislými na železu, které se podílejí na posttranslační modifikaci kolagenu.[13]
Pacienti, kteří dostávají vitamín C doplňky prokázaly zlepšené vylučování železa deferoxaminem. K tomu dochází v důsledku expanze zásoby železa způsobené vitaminem C, ke kterému má deferoxamin následně přístup. Suplementace vitaminu C by však také mohla zhoršit toxicitu železa podporou tvorby volné radikály. Proto by se mělo 30 minut až jednu hodinu po podání deferoxaminu užít pouze 100 mg vitaminu C.[14]
Bylo také prokázáno, že kombinovaná léčba deferoxaminem a deferipronem vede ke zvýšené účinnosti chelatace a zdvojnásobuje vylučování železa.[15]
Deferipron
Struktura a koordinace
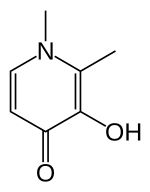
Deferipron (DFP) je bidentate chelátor železa. Tři molekuly léčiva se proto koordinují s jedním atomem železa a tvoří se ortorombický struktura.[16]
DFP je vyroben synteticky a je vysoce selektivní pro Fe (III).[16][17] Fyzikální vlastnosti které umožňují, aby tato sloučenina byla účinná jako léčivo, zahrnuje její vodu rozpustnost nízká molekulární váha (139 Da ), neutrální náboj a lipofilita.[16] Tyto fyzikálně-chemické vlastnosti umožňují snadné křížení buněčné membrány v celém těle, včetně hematoencefalická bariéra, což usnadňuje odstraňování přebytečného železa z orgánů.[16][18]
Ačkoliv mechanismus pro odstranění železa pomocí DFP není dobře známo, nicméně studie Viroja Wiwanitkita z roku 2006 navrhla možný mechanismus: Předpokládalo se, že ke koordinaci železa dochází štěpením buď Vazba CC nebo a CO vazba v droze. Wiwanitkit dospěl k závěru, že mechanismus prochází štěpením Vazba CC protože tato vazba vyžaduje méně energie na to, aby byla štěpena. Bylo zjištěno, že celková energie pro štěpení je negativní, což naznačuje spontánnost a termodynamická výhodnost štěpení. Výsledná struktura produktu se také podobala pozorované terciární struktura komplex léčivo-železo.[19]
Správa a akce
Deferipron je chelátor železa, který je orálně aktivní, jeho podávání je tedy mnohem jednodušší než podávání deferoxaminu.[16] Plazma hladiny pro vyvrcholení komplexu železo-lék po jedné hodině po požití a droga má poločas rozpadu 160 minut. Většina komplexu železo-léčivo se proto vylučuje do tří až čtyř hodin po podání, tj vylučování vyskytující se většinou v moči (90%).[16]
Při srovnání deferipronu s deferoxaminem oba váží železo s podobnou účinností. Léky s různými vlastnostmi však mají přístup k různým zásobám železa. DFP je menší než deferoxamin a může tak snadněji vstoupit do buněk. Také na pH krve je afinita DFP k železu závislá na koncentraci: při nízkých koncentracích DFP se komplex železa a léčiva rozpadne a železo je darováno jinému konkurenčnímu ligandu. Tato vlastnost odpovídá pozorované tendenci služby DFP k redistribuci železa v těle. Ze stejného důvodu může služba DFP „dopravovat“ intracelulární železo do plazma a přemístěte železo na deferoxamin, který ho následně vypudí z těla.[17]
Bylo také zjištěno, že DFP je při léčbě siderózy myokardu u pacientů s thalassemií major významně účinnější než deferoxamin:[16] Předpokládá se, že DFP zlepšuje funkci mitochondrií v srdci přístupem a redistribucí labilního železa v srdečních buňkách.
Pacienti s talasemií mohou také čelit potenciálu oxidační poškození mozkových buněk, protože mozek má vysoké nároky na kyslík, ale obsahuje relativně nízkou hladinu antioxidant prostředky na ochranu proti oxidace. Přítomnost přebytečného železa v mozku může vést k vyšším koncentracím železa volné radikály. Hexadentát chelátory, stejně jako deferoxamin, jsou velké molekuly, a je tedy nepravděpodobné, že by byly schopné překročit hematoencefalická bariéra chelatovat přebytečné železo. DFP to však může udělat a vytvoří rozpustný neutrální komplex železo-léčivo, který může procházet buněčnými membránami bez usnadnění difúze. Připojení léčiva k cukrům může dodatečně zlepšit průnik hematoencefalickou bariérou, jak to mozek používá usnadněná přeprava pro jeho relativně vysokou hladinu příjmu cukru.[20]
Vedlejší efekty
Službě DFP lze podléhat glukuronidace v játrech, která může vyloučit až 85% léčiva z těla, než bude mít šanci chelátovat železo. DFP má také známý bezpečnostní profil s agranulocytóza je nejzávažnějším vedlejším účinkem.[16] I když byla agranulocytóza hlášena u méně než 2% léčených pacientů, je potenciálně život ohrožující, a proto vyžaduje pečlivé sledování počtu bílých krvinek.[18] Méně závažné nežádoucí účinky zahrnují gastrointestinální příznaky, které byly zjištěny u 33% pacientů v prvním roce podávání, ale v následujících letech poklesly na 3%; artralgie; a nedostatek zinku, což je problém zejména pro jednotlivce s cukrovka.[16]
Deferasirox
Struktura a koordinace

Deferasirox je N-substituovaný bis-hydroxyfenyl-triazol. Je schopen odstranit železo z krve prostřednictvím koordinace dvou molekul deferasiroxu na jediný ion železa, který tvoří chelát železa (Fe- [deferasirox]2).[21] Každá molekula trojzubec chelátor deferasirox se váže na železo na třech místech pomocí jednoho atomu dusíku a dvou atomů kyslíku. Výsledkem je stabilní osmistěn geometrie kolem středu železa. Schopnost deferasiroxu odstraňovat železo pramení přímo z jeho relativně malé velikosti, což mu umožňuje přístup k železu obsaženému v krvi a uvnitř tkání. Důležitým rysem deferasiroxu je také to, že se prokázalo, že je vysoce selektivní pro železo v oxidačním stavu +3 a užívání tohoto léčiva nevede k významnému snížení hladiny jiných důležitých kovů v těle.[22]
Správa a akce
Deferasirox se nejčastěji prodává pod značkou Exjade. Má jednu klíčovou výhodu oproti desferoxaminu v tom, že může být užíván orálně ve formě pilulek, a proto to nevyžaduje intravenózní nebo podkožní správa. S terminálním eliminačním poločasem 8–16 hodin lze pilulku deferasiroxu užívat jen jednou denně. Bylo zjištěno, že pro udržení jaterního železa je pro většinu pacientů dostatečná dávka 20 mg / kg tělesné hmotnosti jednou denně. úrovně koncentrace (LIC), které se obvykle měří jako mg železa na g jaterní tkáně. U některých pacientů mohou být zapotřebí vyšší dávky, aby se snížily hladiny LIC.[23] Schopnost deferasiroxu účinně snižovat hladiny LIC byla dobře zdokumentována. Jedna studie prokázala, že po 4–5 letech léčby deferasiroxem se průměrné hladiny LIC u pacientů snížily ze 17,4 ± 10,5 na 9,6 ± 8,0 mg Fe / g. Tato studie ukázala, že dlouhodobá léčba vedla k udržitelnému snížení zátěže železem, které čelí pacienti, kteří dostávali krevní transfuze pro talasémii.[24]Další výhodou použití deferasiroxu místo desferoxaminu je to, že na rozdíl od desferoxaminu časné studie ukázaly, že deferasirox nemá významný vliv na růst a vývoj pediatrických pacientů s talasemií. Ve studii Cappellini et al. bylo prokázáno, že děti, které dostávaly léčbu, vykazovaly nepřetržitý téměř normální růst a vývoj během pětiletého studijního období.[24]
Vedlejší efekty
Deferasirox však může mít celou řadu vedlejších účinků. Mohou zahrnovat bolesti hlavy, nevolnost, zvracení a bolesti kloubů.[25] Byly prokázány určité důkazy o souvislosti s gastrointestinálními poruchami, které zažívají někteří lidé, kteří podstoupili léčbu.[24]
Indicaxanthin
Struktura

Indicaxanthin je pigment odvozený z ovoce kaktusové hrušky a může být použit jako antioxidant. Bylo prokázáno, že dietní indikxanthin má ochranné účinky na červené krvinky u lidí s beta thalasémií.[26] Má strukturu podobnou struktuře aminokyselin a je amfifilní: je schopen vázat se na buněčné membrány prostřednictvím interakcí souvisejících s nábojem se skupinami membránových složek polárních hlav, jakož i adsorpcí na lipidové agregáty. Po zavedení ex vivo do talasemické krve bylo prokázáno, že se indikantanthin hromadí v RBC.[26]
Funkce
Hb prochází následující oxidační reakcí během normálního řízeného odbourávání červených krvinek:
Hb → Oxy-Hb → Met-Hb → [Perferryl-Hb] → Oxoferryl → další oxidační kroky
Tuto reakci zažívají thalassemické erytrocyty ve větší míře, protože nejenže je v thalassemické krvi více oxidačních radikálů, ale thalassemické erytrocyty mají také omezenou antioxidační obranu. Indikantanthin je schopen redukovat perferryl-Hb, reaktivní meziprodukt, zpět na met-Hb. Celkovým účinkem tohoto kroku je, že je zabráněno degradaci Hb, což pomáhá zabránit zrychlenému rozpadu RBC.[26]
Kromě toho bylo prokázáno, že indikxathin snižuje oxidační poškození buněk a tkání, a to díky vazbě na radikály. Mechanismus jeho funkce je však stále neznámý.[26]
Indikantanthin má vysokou biologickou dostupnost a minimální vedlejší účinky, jako je zvracení nebo průjem.
Detekce nosiče
- Ve společnosti existuje politika prověřování Kypr snížit výskyt talasémie, která od zavedení programu v 70. letech (což zahrnuje i prenatální screening a potrat) snížila počet dětí narozených s dědičným onemocněním krve z 1 ze 158 porodů na téměř nulu.[27]
- v Írán jako předmanželský screening se nejprve zkontrolují indexy červených krvinek u muže, pokud ano mikrocytóza (střední buněčný hemoglobin <27 pg nebo střední objem červených krvinek <80 fl), žena je testována. Když jsou oba mikrocytární, jejich hemoglobin A2 koncentrace se měří. Pokud mají oba koncentraci vyšší než 3,5% (diagnostika znaku talasemie), jsou doporučeni místnímu místu určenému pro zdraví genetické poradenství.[28]
V roce 2008, v Španělsko bylo selektivně implantováno dítě, aby bylo lékem na talasemii jeho bratra. Dítě se narodilo z embrya, které bylo před implantací vyšetřeno na prosté choroby Oplodnění in vitro. Zásoba dítěte imunologicky kompatibilní pupečníkové krve byla uložena na transplantaci jeho bratrovi. Transplantace byla považována za úspěšnou.[29] V roce 2009 skupina lékařů a specialistů v Chennai a Coimbatore zaregistroval úspěšnou léčbu talasemie u dítěte pomocí sourozenecké pupečníkové krve.[30]
Transplantace kostní dřeně
Je možné se vyléčit pomocí a transplantace kostní dřeně (BMT) od kompatibilního dárce. U mladých lidí s nízkým rizikem je míra přežití bez talasemie 87%; riziko úmrtí je 3%.[31] Nevýhodou je, že tato metoda vyžaduje HLA - srovnatelný kompatibilní dárce.
Pokud daná osoba nemá kompatibilního dárce HLA, existuje další metoda zvaná transplantace kostní dřeně z haploidentické matky na dítě (neodpovídající dárce), ve které je dárcem matka. Výsledky jsou následující: míra přežití bez talasemie 70%, rejekce 23% a úmrtnost 7%. Nejlepší výsledky mají velmi mladí lidé.[32]
Reference
- ^ Sharma, A; Easow Mathew, M; Puri, L (17. září 2019). „Splenektomie pro lidi s thalassemia major nebo intermedia“. Cochrane Database of Systematic Reviews. 9: CD010517. doi:10.1002 / 14651858.CD010517.pub3. PMC 6746994. PMID 31529486.
- ^ A b „Léčba a management dětské talasémie“. Zdravotní péče. Otevřete publikování. 30.dubna 2010. Citováno 27. září 2011.
- ^ Claude Owen Burdick. „Oddělení vlastnosti talasemie a nedostatku železa jednoduchou kontrolou“. Americká společnost pro klinickou patologii. Archivovány od originál dne 22. září 2014. Citováno 27. září 2011.
- ^ Harrison's Principles of Internal Medicine, 17. vydání. McGraw-Hill lékařský. Září 2008. str. 776. ISBN 978-0-07-164114-2.
- ^ Aisen P, Leibman A, Zweier J; Leibman; Zweier (březen 1978). "Stechiometrická a charakteristika místa vazby železa na lidský transferrin". J. Biol. Chem. 253 (6): 1930–7. PMID 204636.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d E >Brittenham, Gary M; Olivieri, Nancy F (1997). „Terapie chelatující železo a léčba talasémie“. Journal of the American Society of Hematology. 89 (3): 739–761. PMID 9028304. Citováno 28. února 2013.
- ^ Brittenham, Gary M .; Griffith, Patricia M .; Nienhuis, Arthur W .; McLaren, Christine E .; Young, Neal S .; Tucker, Eben E .; Allen, Christopher J .; Farrell, David E .; Harris, John W. (1994). "Účinnost deferoxaminu v prevenci komplikací přetížení železem u pacientů s Thalassemia Major". New England Journal of Medicine. 331 (9): 567–73. doi:10.1056 / NEJM199409013310902. PMID 8047080.
- ^ Cozar, O .; Leopold, N .; Jelic, C .; Chiş, V .; David, L .; Mocanu, A .; Tomoaia-Cotişel, M. (2006). "IR, Ramanova a povrchově vylepšená Ramanova studie desferrioxaminu B a jeho komplexu Fe (III), ferrioxamin B". Journal of Molecular Structure. 788 (1–3): 1–6. Bibcode:2006JMoSt.788 .... 1C. doi:10.1016 / j.molstruc.2005.04.035.
- ^ Cohen, Alan; Martin, Marie; Schwartz, Elias (1981). „Reakce na dlouhodobou léčbu deferoxaminem při talasemii“. The Journal of Pediatrics. 99 (5): 689–94. doi:10.1016 / S0022-3476 (81) 80385-X. PMID 7299539.
- ^ Pennell, D. J .; Berdoukas, V; Karagiorga, M; Ladis, V; Piga, A; Aessopos, A; Gotsis, ED; Tanner, MA; et al. (2006). „Randomizovaná kontrolovaná studie s deferipronem nebo deferoxaminem u hlavních pacientů s beta-talasemií s asymptomatickou siderózou myokardu“. Krev. 107 (9): 3738–44. doi:10.1182 / krev-2005-07-2948. PMID 16352815.
- ^ Jin, Haiyan; Terai, Shuji; Sakaida, Isao (2007). „Chelátor železa deferoxamin způsobí, že se aktivované jaterní hvězdné buňky stanou v klidovém stavu a podstoupí apoptózu“. Journal of Gastroenterology. 42 (6): 475–84. doi:10.1007 / s00535-007-2020-5. PMID 17671763.
- ^ Kaye, Todd B .; Guay, André T .; Simonson, Donald C. (1993). „Diabetes mellitus nezávislý na inzulínu a zvýšená hladina feritinu v séru“. Journal of Diabetes and its Complications. 7 (4): 245–249. doi:10.1016 / S0002-9610 (05) 80252-1.
- ^ Olivieri, Nancy F .; Koren, Gideon; Harris, Jonathan; Chattak, Sohail; Freedman, Melvin H .; Templeton, Douglas M .; Bailey, John D .; Reilly, B. J. (1992). "Selhání růstu a kostní změny vyvolané deferoxaminem". Journal of Pediatric Hematology / Oncology. 14: 48–56. doi:10.1097/00043426-199221000-00007. PMID 1550263.
- ^ Ambruso, DR; Mahony, BS; Githens, JH; Rhoades, ED (1982). „Vliv subkutánního deferoxaminu a perorálního vitaminu C na vylučování železa u vrozené hypoplastické anémie a refrakterní anémie spojené se syndromem 5q“. American Journal of Pediatric Hematology / Oncology. 4 (2): 115–23. PMID 7114394.
- ^ Kattamis, Antonis (2005). "Kombinovaná léčba s deferoxaminem a deferipronem". Annals of the New York Academy of Sciences. 1054 (1): 175–82. Bibcode:2005NYASA1054..175K. doi:10.1196 / annals.1345.020. PMID 16339663.
- ^ A b C d E F G h i Wiwanitkit, Viroj (2006). „Kvantová chemická analýza vazby deferipron-železo“. International Journal of Nanomedicine. 1 (1): 111–3. doi:10.2147 / nano.2006.1.1.111. PMC 2426763. PMID 17722270.
- ^ A b Olivieri, Nancy F .; Brittenham, Gary M. (1997). „Železo-chelatační terapie a léčba talasémie“. Krev. 89 (3): 739–61. doi:10,1182 / krev. V89.3.739. PMID 9028304.
- ^ A b Galanello, R .; Campus, S. (2009). "Deferipronová chelatační terapie pro Thalassemia Major". Acta Haematologica. 122 (2–3): 155–64. doi:10.1159/000243800. PMID 19907153.
- ^ Wiwanitkit, Viroj (2006). „Kvantová chemická analýza vazby deferipron-železo“. International Journal of Nanomedicine. 1 (1): 111–3. doi:10.2147 / nano.2006.1.1.111. PMC 2426763. PMID 17722270.
- ^ Heli, Hossein; Mirtorabi, Siamak; Karimian, Khashayar (2011). "Pokroky v chelataci železa: Aktualizace". Znalecký posudek na terapeutické patenty. 21 (6): 819–56. doi:10.1517/13543776.2011.569493. PMID 21449664.
- ^ Cappellini, M. D .; Cohen, A; Piga, A; Bejaoui, M; Perrotta, S; Agaoglu, L; Aydinok, Y; Kattamis, A; et al. (2006). „Studie fáze 3 s deferasiroxem (ICL670), chelátorem železa podávaným jednou denně, u pacientů s beta-thalasemií“. Krev. 107 (9): 3455–62. doi:10.1182 / krev-2005-08-3430. PMID 16352812.
- ^ R Galanello; Piga, A; Forni, GL; Bertrand, Y; Foschini, ML; Bordone, E; Leoni, G; Lavagetto, A; et al. (01.01.2006). „Fáze II klinické hodnocení deferasiroxu, perorálního chelatačního činidla jednou denně, u pediatrických pacientů s β-thalassemia major“. Haematologica. 91 (10): 1343–51. PMID 17018383.
- ^ Nisbet-Brown, Eric; Olivieri, Nancy F; Giardina, Patricia J; Grady, Robert W; Neufeld, Ellis J; Séchaud, Romain; Krebs-Brown, Axel J; Anderson, Judith R; et al. (2003). „Účinnost a bezpečnost ICL670 u pacientů s železem s talasemií: randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie zvyšování dávky“. Lancet. 361 (9369): 1597–602. doi:10.1016 / S0140-6736 (03) 13309-0. PMID 12747879.
- ^ A b C Cappellini, M. D .; Bejaoui, M .; Agaoglu, L .; Canatan, D .; Capra, M .; Cohen, A .; Drelichman, G .; Economou, M .; et al. (2011). „Chelace železa s deferasiroxem u dospělých a pediatrických pacientů s thalassemií major: Účinnost a bezpečnost během sledování po 5 letech“. Krev. 118 (4): 884–93. doi:10.1182 / krev-2010-11-316646. PMID 21628399.
- ^ „Jak se zachází s Thalassemias?“. Národní institut pro teplo, plíce a krev. Citováno 2. března 2013.
- ^ A b C d Tesoriere, L .; Allegra, M .; Butera, D .; Gentile, C .; Livrea, M. A. (2006). „Cytoprotektivní účinky antioxidačního fytochemického indikaxantinu v červených krvinkách β-talasemie“. Volný radikální výzkum. 40 (7): 753–61. doi:10.1080/10715760600554228. PMID 16984002.
- ^ Leung TN, Lau TK, Chung TKh; Lau; Chung (duben 2005). "Screening talasémie v těhotenství". Aktuální názor v porodnictví a gynekologii. 17 (2): 129–34. doi:10.1097 / 01.gco.0000162180.22984.a3. PMID 15758603.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Samavat A, Modell B; Modell (listopad 2004). „Íránský národní screeningový program na talasemii“. BMJ (Clinical Research Ed.). 329 (7475): 1134–7. doi:10.1136 / bmj.329.7475.1134. PMC 527686. PMID 15539666.
- ^ Španělské dítě navržené k vyléčení bratra
- ^ Chovatel jeho sestry: Krev bratra je požehnáním života, Časy Indie, 17. září 2009
- ^ Sabloff, M; Chandy, M; Wang, Z; Logan, BR; Ghavamzadeh, A; Li, CK; Irfan, SM; Bredeson, CN; et al. (2011). „Transplantace kostní dřeně shodné s HLA pro β-thalassemia major“. Krev. 117 (5): 1745–50. doi:10.1182 / krev-2010-09-306829. PMC 3056598. PMID 21119108.
- ^ Sodani, P; Isgrò, A; Gaziev, J; Paciaroni, K; Marziali, M; Simone, MD; Roveda, A; De Angelis, G; et al. (2011). „Transplantace hla-haploidentických kmenových buněk s deplecí T buněk u mladých pacientů s talasemií“. Pediatrické zprávy. 3 Suppl 2 (Suppl 2): e13. doi:10.4081 / pr.2011.s2.e13. PMC 3206538. PMID 22053275.
