Limonen-1,2-epoxid hydroláza - Limonene-1,2-epoxide hydrolase
| Limonen-1,2-epoxidhydroláza - katalytická doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
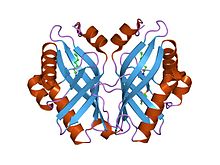 limonen-1,2-epoxidhydroláza | |||||||||
| Identifikátory | |||||||||
| Symbol | LEH | ||||||||
| Pfam | PF07858 | ||||||||
| Pfam klan | CL0051 | ||||||||
| InterPro | IPR013100 | ||||||||
| SCOP2 | 1nww / Rozsah / SUPFAM | ||||||||
| OPM nadčeleď | 133 | ||||||||
| OPM protein | 2 bng | ||||||||
| |||||||||
| limonen-1,2-epoxidhydroláza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 3.3.2.8 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
v enzymologie, a limonen-1,2-epoxidhydroláza (ES 3.3.2.8 ) je enzym že katalyzuje the chemická reakce
- limonen-1,2-epoxid + H2Ó limonen-1,2-diol
Tedy dva substráty tohoto enzymu jsou limonen-1,2-epoxid a H2Ó, zatímco jeho produkt je limonen-1,2-diol.
Tento enzym patří do rodiny hydrolázy, konkrétně ty, které působí na etherové vazby (ether hydrolázy). The systematické jméno této třídy enzymů je limonen-1,2-epoxidhydroláza. Tento enzym se také nazývá limonenoxid hydroláza. Tento enzym se účastní limonen a pinen degradace.
Epoxid hydrolázy katalyzovat the hydrolýza epoxidů na odpovídající dioly, což je důležité v detoxikace, syntéza signálních molekul, nebo metabolismus. Limonen-1,2-epoxidhydroláza (LEH) se liší od mnoha jiných epoxidových hydroláz v struktura a jeho nový jednokrok katalytické mechanismus. Jeho hlavní složit sestává ze šestivláknového smíšeného beta-list, se třemi N-terminál alfa helixy zabalené na jednu stranu a vytvořit kapsu, která sahá až do protein jádro. Čtvrtá spirála leží takovým způsobem, že funguje jako okraj této kapsy. I když hlavně lemované hydrofobní zbytky, tato kapsa obsahuje shluk polárních skupin, které leží v nejhlubším bodě a tvoří enzymy Aktivní stránky.[1]
Reference
- ^ Arand M, Hallberg BM, Zou J, Bergfors T, Oesch F, van der Werf MJ, de Bont JA, Jones TA, Mowbray SL (červen 2003). „Struktura Rhodococcus erythropolis-limonen-1,2-epoxidhydrolázy odhaluje nové aktivní místo“. EMBO J.. 22 (11): 2583–92. doi:10.1093 / emboj / cdg275. PMC 156771. PMID 12773375.
Další čtení
- van der Werf MJ, Overkamp KM, de Bont JA (1998). „Limonen-1,2-epoxidhydroláza z Rhodococcus erythropolis DCL14 patří do nové třídy epoxidových hydroláz“. J. Bacteriol. 180 (19): 5052–7. doi:10.1128 / JB.180.19.5052-5057.1998. PMC 107539. PMID 9748436.
- Barbirato F, Verdoes JC, de Bont JA, van der Werf MJ (1998). „Rhodococcus erythropolis DCL14 gen limonen-1,2-epoxidhydrolázy kóduje enzym patřící do nové třídy epoxidových hydroláz“. FEBS Lett. 438 (3): 293–6. doi:10.1016 / S0014-5793 (98) 01322-2. PMID 9827564. S2CID 25639310.
| Tento hydroláza článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

