Letts nitrilová syntéza - Letts nitrile synthesis - Wikipedia
| Letts nitrilová syntéza | |
|---|---|
| Pojmenoval podle | Edmund A. Letts |
| Typ reakce | Substituční reakce |
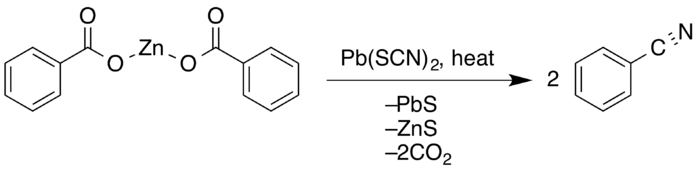
The Letts nitrilová syntéza je chemická reakce z aromatický karboxylové kyseliny s kov thiokyanáty tvořit nitrily. Reakce zahrnuje ztrátu oxid uhličitý a hydrogensulfid draselný. The polární základní substituční reakce byl objeven v roce 1872 Edmund A. Letts.[1][2]

Dějiny
V roce 1857 Hugo Schiff pozoroval, že reakce mezi benzoylchlorid s kyanid draselný vyrobil požadovaný benzonitril.[3] Práce, kterou později provedl britský chemik Edmund A. Letts, se ponořil mnohem hlouběji do syntézy nitrilů. Pokus o první přidání kyanoskupiny na octová kyselina, získal směs acetamid a karbonylsulfid. V roce 1872 však ukázal, že zpracováním molekulárního poměru 2: 1 kyseliny benzoové a thiokyanátu draselného teplem po dobu několika hodin se také získají nitrily pouze s malým množstvím amidu s asi 40% výtěžkem.[4]
G. Krüss rozšířil Lettsovu práci v roce 1884 a díky využití dosáhl lepších výnosů thiokyanát olovnatý.[5] V roce 1916 E.E. Reid zjistil, že to ukázalo suchá destilace z zinek (II) sůl kyseliny s 20% přebytkem thiokyanátu olovnatého poskytla 86% konverzi a 91% výtěžek, téměř dvojnásobný oproti výtěžku produkovanému Letts.[6]
Mechanismus
Kekulé navrhl mechanismus reakce v roce 1873.[7]
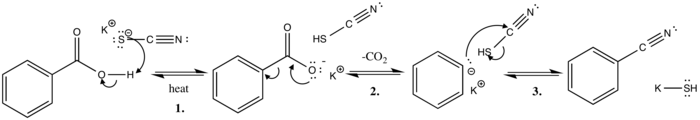
V tomto mechanismu polární bazické substituční reakce extrahuje thiokyanátový ion kyselý proton z kyseliny benzoové za zahřívání. Tím se získá konjugovaná báze (stabilizováno rezonanční struktury ) a kyselina thiokyanová.
Další krok zahrnuje vývoj oxidu uhličitého, kde se osamocený pár elektronů pohybuje ze záporně nabitého kyslíku za vzniku a dvojná vazba s karboxylovým uhlíkem. The sigma vazba mezi prstenem a karboxyl skupina je poté oddělena, elektronový pár se pohybuje do kruhu a delokalizuje se prostřednictvím rezonančních struktur.
Poslední krok mechanismu zahrnuje útok fenylového aniontu, který útočí na kyano-uhlík, tlačením elektronového páru na síru, která snadno difunduje negativní náboj a je dále stabilizována iont draslíku za vzniku konečného benzonitrilového produktu a hydrosulfidu draselného.
Aplikace
Aromatické nitrily mají několik aplikací, včetně polyrekombinace polymery,[8] jsou někdy studovány jako biologicky aktivní molekuly[9] a prochází Ritterovy reakce tvořit amidy.[10]

Benzonitril, původní produkt společnosti Letts, má mnohostranné využití činidlo a jako solventní. Substituované benzonitrily jsou důležité v mnoha oblastech, včetně farmaceutických. Benzonitril je prekurzorem při syntéze Fadrozol, an inhibitor aromatázy používané při léčbě rakovina prsu.[11] 4- (trifluormethyl) benzonitril, produkovaný Nikl katalyzovaný kyanace 4-chlorbenzotrifluoridu je prekurzorem pro antidepresivum Fluvoxamin.[12]

Benzonitril může také působit a ligand v asymetrická katalýza koordinuje s přechodné kovy a formování Lewisovy kyseliny.[13][14]
Viz také
Pro syntézu nitrilů:
Pro reakce nitrilů:
Reference
- ^ Letts, E. A. (1872). „Neue Bildungsweisen der Amide und Nitril“. Chemische Berichte. 5 (2): 669–674. doi:10,1002 / cber.18720050228.
- ^ Letts, E. A. (1872). "Nová metoda výroby amidů a nitrilů". Sborník královské společnosti v Londýně. 21 (139–147): 61–66. doi:10.1098 / rspl.1872.0012. ISSN 0370-1662. S2CID 178687230.
- ^ Schiff, Hugo (1857). „Ueber einige Derivate des Naphtylamins“. Annalen der Chemie und Pharmacie. 101 (1): 90–93. doi:10.1002 / jlac.18571010113.
- ^ Reid, E.E. (1910). "Studie přípravy nitrilů". Dopoledne. Chem. J. 43: 162–181.
- ^ Krüss, G. (1884). „Ueber eine neue Darstellungsmethode für Nitrile“. Ber. 17 (2): 1766–1768. doi:10,1002 / cber.18840170245.
- ^ Mowry, D.T. Příprava nitrilů. (1948). "Příprava nitrilů". Chem. Rev. 42 (2): 189–283. doi:10.1021 / cr60132a001. PMID 18914000.
- ^ Kekulé, A. (1872). „Neue Bildungsweisen der Amide und Nitril“. Ber. 5 (2): 669–674. doi:10,1002 / cber.18720050228.
- ^ Vasnev, V.A .; Sosin, S.L .; Korshak, V.V. (1964). „Syntéza polymerů polyrekombinací nitrilu aromatických a alifatických kyselin“. Polymer Science U.S.S.R. 6 (5): 928. doi:10.1016/0032-3950(64)90510-6.
- ^ Zhao, Aimin; Li, Whenzong; Yang, Huifung (1993). "Mikrobiální přeměna aromatických nitrilů". Weis. Tong. 20: 169–171.
- ^ Sadeghi, Bahareh; Farahzadi, Ebrahim; Hassanabadi, Alireza (01.01.2012). „KAl (SO4)20,12 hod2O jako ekologický a opakovaně použitelný katalyzátor pro syntézu amidů Ritterovou reakcí “. Journal of Chemical Research. 36 (9): 539–540. doi:10.3184 / 174751912x13418518739562. S2CID 197289966.
- ^ Raats, J. I .; Falkson, G .; Falkson, H. C. (1992). „Studie fadrozolu, nového inhibitoru aromatázy, u postmenopauzálních žen s pokročilým metastatickým karcinomem prsu“. Journal of Clinical Oncology. 10 (1): 111–116. doi:10.1200 / jco.1992.10.1.111. ISSN 0732-183X. PMID 1530798.
- ^ Schareina, Thomas; Zapf, Alexander; Beller, Matthias (01.01.2004). „Zlepšení kyanace arylhalogenidů katalyzované palladiem: vývoj nejmodernější metodiky využívající hexakyanoferát draselný (II) jako kyanatizační činidlo“. Journal of Organometallic Chemistry. 689 (24): 4576–4583. doi:10.1016 / j.jorganchem.2004.08.020.
- ^ Becker, Jennifer J .; Orden, Lori J. Van; White, Peter S .; Gagné, Michel R. (01.01.2002). „Electron-Poor Benzonitriles as Labile, Stabilizing Ligands in Asymetric Catalysis“. Organické dopisy. 4 (5): 727–730. doi:10.1021 / ol017218q. PMID 11869112.
- ^ Anderson, Gordon K .; Lin, Minren (1990). Bis (benzonitril) dichlorové komplexy palladia a platiny. Inorg. Synth. Anorganické syntézy. 28. str. 60–63. doi:10.1002 / 9780470132593.ch13. ISBN 9780470132593.
