Zrání in vitro - In vitro maturation
Zrání in vitro (IVM) je technika pronajímání obsahu ovariální folikuly a oocyty uvnitř zralé in vitro. Může být nabízen ženám s problémy s neplodností v kombinaci s IVF, které nabízejí ženám těhotenství bez stimulace vaječníků.
Dějiny
V roce 1935 provedli Pincus & Enzmann první experiment na nezralém králičím oocytu in vitro spontánní zrání a oplodnění.[1] Ukázali, že zrání probíhá izolovaně od normálního folikulárního prostředí.[1] V roce 1965 poté Edwards pokračoval ve studiích IVM u myší, ovcí, krav, prasat, opic rhesus a lidí.[2][3] Do roku 1991 bylo zaznamenáno první těhotenství pomocí IVM následovaného IVF,[4] a v roce 1994 první porod s použitím oocytů IVM z Syndromu polycystických vaječníků pacientů bylo zaznamenáno s důrazem na to, že oocyty pacientů s PCOS jsou schopné zrání.[5]
Pozadí
Oogeneze odehrává se během života plodu, ve kterém podstupují prvotní zárodečné buňky mitóza až několik týdnů před narozením, formování oogonia. Tito pak začnou meiosis tvořit oocyte uvnitř prvotního folikulu.[6] Tento folikul se skládá z oocytů obklopených zploštělými buňkami pregranulosy. Děti se rodí s 1–2 miliony prvotních folikulů a v pubertě mají kolem 300 000.[6] Z těchto primordiálních folikulů se uvolní pouze asi 400 zralých oocytů, které by mohly být potenciálně oplodněny, přičemž zbytek podstoupil atrézii.[7]
„Zrání“ oocytu je proces, kterým „oocyt získá schopnost oplodnit se a podstoupit embryogenezi“.[8]
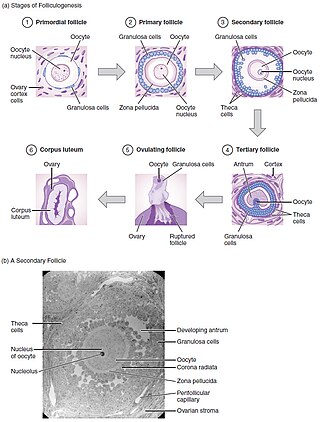
Folikulogeneze je mechanismus, kterým vaječníkové folikuly dozrávají. To může trvat mnoho měsíců in vivo a zahrnuje prvotní růst a diferenciaci folikulů.[8]
Primordiální folikuly obsahující primární oocyt, zastavené v profázi meiózy I,[8] vyvinout se do primárního folikulu obsahujícího kuboidní granulózní buňky. Vytvoří se sekundární folikul s několika vrstvami buněk granulózy a vrstvou theka. Nakonec se před ovulací vytvoří terciární folikul obsahující antrum naplněné folikulární tekutinou.[6] Z těchto malých antrálních folikulů se 1 stane dominantním a ovulujícím (u monoovulačních druhů). Během ovulace primární oocyt obnoví meiózu v reakci na signály a zastaví se v metafázové meióze II, připraven k oplodnění.[3] Dominantní folikul obsahuje zralý oocyt. Vývoj folikulů je přímo pod kontrolou gonadotropinů, LH a FSH. Používají cAMP jako intracelulárního druhého posla, přičemž jejich vývoj in vivo ovlivňují také růstové faktory a cytokiny.[7]
Přes in vitro zrání, folikulogeneze a pozdější části oogeneze se napodobují mimo vaječníky - snaží se znovu vytvořit podmínky pro tyto procesy.
Techniky
Pokud folikul dosáhl raného terciárního nebo antrálního stadia, lze provést IVM.[9]
Nejprve je třeba získat oocyty od subjektu. Načasování je závislé na fázi cyklu, ve které se subjekt nachází, který je obvykle sledován pomocí ultrasonografie.[10] Pokud bez použití primingu se oocyty získají, když největší folikuly mají velikost přibližně 10 mm.[9]
U lidí to lze provést pomocí aspirační jehly, která umožňuje přesnost pomocí ultrazvuku. V závislosti na tom, zda aspirujete zralé nebo nezralé folikuly, se protokol mírně liší. U obou postupů je aspirační tlak snížen, ale v různé míře. Navíc je důležitější, aby byl aspirát filtrován při získávání nezralých folikulů, protože folikuly jsou mnohem menší a těžší je vidět v extrahované tekutině.[10]
Priming je proces, kterým jsou oocyty primovány folikuly stimulující hormon (FSH) nebo lidský choriový gonadotropin (hCG) před načtením. hCG je důležité u žen s Syndromu polycystických vaječníků (PCOS). To má za následek rozšíření nebo rozptýlení vzoru cumulus oophorus kolem vaječné buňky, což usnadňuje její identifikaci ve folikulární tekutině. To vede ke zlepšení zrání a kvality oocytů.[7] Důkazy o klinickém účinku primování hCG však stále chybí.[11] Když byl IVM původně zaveden, úspěšná těhotenství byla nízká, což vedlo k použití vaječníků.[10]
Tato technika se používá také u ovcí,[12] prasata[13] a další zvířata. Vidět U zvířat.
Klasifikace oocytů
Oocyty jsou klasifikovány v závislosti na jejich stavu, jako je počet buněk kumulu. Nejlepší oocyty jsou vybrány tak, aby dospěly v naději, že budou následně implantovány in vitro techniky hnojení.[12]
Pěstováno v médiích
Oocyty se poté kultivují v médiu obsahujícím živiny důležité pro přežití oocytů, jako jsou gonadotropiny, růstové faktory a steroidy.[10] Ty se liší mezi klinikami a výzkumnými laboratořemi. McLaughlin et al. biopsie lidské ovariální tkáně a dosáhla 10% rychlosti zrání z unilaminárních folikulů do metafáze II multikrokovým kultivačním systémem:[14]
- 8 dní kultivace v médiu bez séra
- 8 dní kultivace v médiu bez séra s aktivin A
- 4 dny kultivace na membránách s aktivinem A a folikuly stimulující hormon (FSH).
Oplodnění in vitro
Jakmile oocyty dostatečně vyzrají, mohou být oplodněny in vitro, známý jako oplodnění in vitro (IVF). Techniky jako intracytoplazmatická injekce spermií (ICSI) lze také využít ke zlepšení šance na úspěšné oplodnění, které by mělo být provedeno nejméně jednu hodinu (a optimálně dvě až čtyři hodiny) po první polární tělo vytlačování.[15] Mimo in vitro zralé oocyty, ty oplodněné ICSI mají úspěšnost 60-80%, ve srovnání s IVF s úspěšností 25-40%.[16]
Několik živých porodů již proběhlo odebráním malých raných terciárních folikulů, které je nechaly zrát in vitro a následně hnojení U folikulů, které nedosáhly raného terciárního stadia, je však IVM stále ve vývoji. Existuje mnoho buněčných změn v oocyt a zbytek buněk ve folikulu, díky čemuž je velmi citlivý. Přesto je možné nechat primordiální folikul zrát na sekundární folikul mimo tělo pěstováním v plátku ovariální tkáně. Následnou splatnost ze sekundárního do raného terciárního stadia lze poté podpořit ve zkumavkách.[16] Bylo navrženo, že fotoiradiace buněk granulózy a oocytů může usnadnit IVM.[17]
Klinické aplikace
In vitro zrání je technika asistivní reprodukce (UMĚNÍ ) obvykle používané u pacientů s problémy s plodností včetně syndrom polycystických vaječníků (PCOS), vysoká antrální folikul počty a hyperreaktivita vaječníků.[18][19] V poslední době se však IVM široce využívá také v oblastech, jako je zachování plodnosti u pacientů s rakovinou, kteří podstoupili léčbu zahrnující gonadotoxické terapie.[18] Bylo zaznamenáno více než 1 000 živě narozených matek užívajících IVM.[19]
Syndrom polycystických vaječníků
PCOS je běžná porucha zahrnující dysfunkci endokrinní systém spojené s ženskou reprodukcí. PCOS zahrnuje nesrovnalosti v Hypofyzární-hypofýza-gonadální endokrinní osa což může mít za následek hormonální dysfunkci, nadbytek androgeny (např. testosteron) a časté anovulační menstruační cykly.[20] Proto je běžné, že ženy trpící PCOS potřebují při otěhotnění pomoc.[20][21][22] U těchto pacientů lze IVM použít ke zrání oocytů a usnadnění početí.[20][21]
Alternativa k ovariální hyperstimulaci
Použití in vitro zrání v asistované reprodukci má oproti standardním postupům ART výhody. V typickém IVF praxe, kontrolovaná ovariální hyperstimulace se provádí, což je kde suprafyziologické úrovně gonadotropiny jsou podávány pacientovi za účelem hyperstimulace antrálních folikulů a tím indukce zrání oocytů na metafáze II rychlostí, která je nad normální fyziologické schopnosti.[19] Tato praxe může být nevýhodná několika způsoby: Je velmi nákladná, může se zkomplikovat a může také předisponovat k několika nežádoucím vedlejším účinkům, jako je například ovariální hyperstimulační syndrom (OHSS).[19][21] Hyperstimulace vaječníků může způsobit těžkou OHSS až ve 2% případů. OHSS může mít vážné následky, včetně dýchacích potíží, poškození ledvin nebo dokonce cévní mozkové příhody.[19] Pacienti s PCOS a mladšími ženami jsou vystaveni zvýšenému riziku OHSS.[21] U těchto žen může být ještě výhodnější použít IVM než konvenční léčbu IVF.[19][21]
Při IVM jsou nezralé oocyty odstraněny z antrálního folikulu ženy a poté vyzrálé in vitro v kultuře bohaté na gonadotropiny.[19] To tedy neguje (nebo významně snižuje) potřebu stimulace gonadotropinem.[21]
IVM není zcela dokonalá technika. Míra těhotenství je u IVM nižší než u standardního IVF. Je také nutný výzkum, zda by děti narozené matkám, které podstoupily IVM, měly či neměly v průběhu života nějaké zdravotní problémy (např. Vývojové problémy).[19]
Ženy s osobní nebo rodinnou anamnézou otrombus spojený s estrogenem nebo závažné kardiovaskulární onemocnění, může také těžit z IVM. Je to proto, že konvenční IVF s hyperstimulací vaječníků má potenciál stimulovat hromadnou syntézu estrogenu stimulací granulózní buňka produkce estrogenu.[19]
Kryokonzervace tkáně vaječníků
Kryokonzervace tkáně vaječníků lze použít jako metodu zachování plodnosti, například před podstoupením chemoterapie to může způsobit ženská neplodnost, nebo jako budoucí zdroj v případě, že oocyty přestanou fungovat pokročilý mateřský věk. Kryokonzervace tkáně vaječníku je tedy alternativou k kryokonzervace oocytů což vyžaduje předchozí kontrolovaná ovariální hyperstimulace. In vitro zrání umožňuje přímé použití oocytů z ovariální tkáně oplodnění in vitro, jako alternativa k chirurgickému opětovnému zavedení tkáně do těla.[14]
Syndrom prázdného folikulu
IVM může být také důležitým faktorem pro pacientky s diagnózou syndrom prázdného folikulu (EFS). U EFS se ze zralých ovariálních folikulů nenacházejí žádné oocyty navzdory aplikaci suprafyziologických hladin gonadotropinů. Žena může být diagnostikována s EFS poté, co podstoupila několik kol IVF s celkovým (nebo téměř celkovým) selháním v každém kole.[21]
Zachránit
Rescue IVM je varianta klasiky in vitro maturace, která zahrnuje pokus o zralé nezralé oocyty, které byly pacientovi odstraněny sekundárně po hyperstimulaci vaječníků ve standardní praxi IVF. Proto umožnění zralosti více oocytů do vývojového stadia, kdy mohou být vývojově životaschopné. Záchranný IVM však byl považován za kontroverzní pole: Pokud oocyty dostatečně nevyzrály in vivo - navzdory expozici významným hladinám gonadotropinů - může to svědčit o dysmaturitě a omezeném vývojovém potenciálu.[19]
U zvířat
IVM se také používá u domácích zvířat, včetně myší,[23] kočky,[24][25] psi,[26][27] svině,[28] ovce,[29] kůň[30] a dobytek[31][32] stejně jako divoké druhy jako buvol,[33] bizon,[34] Ryba,[35] lvi,[36] tygři[36] a leopardy.[36] Schopnost obnovit oocyty zvířat původně určené pro atrézie folikulárních folikulů, mohou být použity výzkumnými pracovníky, ochránci přírody a zemědělským průmyslem pro akademické účely nebo pro zlepšení šlechtitelských systémů.
Ve výzkumu může být IVM prováděn na zvířatech, aby bylo možné pochopit vývojové schopnosti oocytů za určitých podmínek nebo porozumět specifické reprodukční biologii během tohoto vývojového období. IVM u jiných druhů se také provádí, protože některá zvířata se používají jako modely pro studium reprodukční biologie související s člověkem.[37] Tento výzkum je často prováděn s cílem zlepšit míru úspěšnosti in vitro systémy a / nebo mají za cíl zlepšit plodnost in vivo.
Lze jej také použít pro následné biotechnologické aplikace, jako je například vytváření transgenní zvířata pomocí inovativních technik úpravy genů, jako je CRISPR / Cas9, TALEN a ZFN pro biomedicínský výzkum. Příklad zahrnuje geneticky upravená prasata s CD163 a CD1D geny vyřazen.[38] Jedním ze způsobů, jak byla tato prasata vytvořena, byla injekce systému CRISPR / Cas9 do oplodněných oocytů, které dozrály in vitro.
V zemědělství se IVM obvykle provádí před IVF nebo umělou inseminací jako prostředek k uchování požadovaných vlastností konkrétních zvířat ve stádech a působí proti nižší produkci v důsledku sezónního chovu. U hospodářských zvířat, jako je skot, lze transvaginální regeneraci oocytů z vaječníků živých samic opakovaně provádět před in vitro produkce embryí.[39]
U nedomestikovaných zvířat lze IVM použít také k ochraně ohrožených druhů při zachování genetické rozmanitosti.[40] Vzhledem k omezeným zdrojům a druhově specifické povaze technologií asistované reprodukce je však u nedomestikovaných zvířat aplikace technik, jako je IVM, stále vzácná.[40]
Míra úspěchu a budoucí využití
V experimentu Segersa a kol. (2015), celková rychlost zrání po IVM oocytů získaných z ovariektomických vzorků v laboratoři byla 36%. Rychlost zrání korelovala s věkem pacienta a trváním IVM. S 8 páry s embryem kryokonzervace, došlo k 65% míře oplodnění. Alespoň jedno kvalitní embryo dne 3 bylo kryokonzervováno u 7/8 párů. Tento experiment ukazuje, že IVM oocytů získaných ex vivo během zpracování ovariální kůry před kryokonzervací je slibným řešením pro pacienty s rizikem ztráty plodnosti.[41]
Úspěch produkce embryí in vitro závisí na použití účinné techniky získávání oocytů a nejlepších výsledků bylo dosaženo laparoskopickou aspirací.[42]
Omezení
Porodnické a perinatální výsledky porodů z cyklů IVM jsou podobné těm s ICSI ošetření.[43] IVM však zahrnuje použití invazivních technik, což může matce ublížit. Kromě toho není stanoven embryologický výsledek IVM.[44] Komplexnější hodnocení zdravotního stavu dětí s IVM bude vyžadovat rozsáhlejší prospektivní studie.[43] Potenciál kryokonzervovaných oocytů IVM u pacientů s rakovinou zůstává neznámý. Optimální počet oocytů IVM zmrazených u kandidátů na zachování plodnosti (FP) není znám. FP oocyty neplodných žen s PCOS mají sníženou kompetenci ve srovnání s oocyty získanými po stimulaci vaječníků. Strategie FP kryokonzervace oocytů po IVM by měla být zvážena pouze v případě, že je stimulace vaječníků neproveditelná.[45]
U žen s normální ovulací je úspěšnost IVM nižší než u konvenčních režimů stimulace vaječníků s horší implantací a těhotenstvím. IVM je neoptimální a je ovlivněno několika faktory. IVM je však mírnější přístup k léčbě asistované reprodukce a alternativní postup pro specifické stavy. Přesný výběr pacientů může zlepšit klinický výsledek IVM.[43]
Vylepšení
Kryokonzervované oocyty IVM mohou pomoci urgentně uchovat plodnost u pacientů s rakovinou. O tomto výsledku však nejsou k dispozici dostatečné údaje. Zlepšení podmínek kultivace může zvýšit rychlost zrání a potenciál IVM oocytů.[46]
Kromě toho v myších oocytech doplňuje I-karnitin (LC) během vitrifikace zárodečné váčky (GV) a jejich následné IVM zlepšilo jaderné zrání i meiotické sestavení vřetene a mitochondriální distribuci v MII oocytech. Dosud však žádná data neprokázala tuto výhodu ve vývoji plodu a narození zdravých potomků po přenosu embryí na náhradní ženy. Tento protokol by však mohl potenciálně zlepšit kvalitu vitrifikovaných lidských oocytů a embryí během IVM.[47] Ve výzkumu Wang X et al. (2014), gonadotropiny ovlivňují zrání oocytů, hnojení a vývojovou kompetenci in vitro. Reakce bovinních oocytů na gonadotropiny in vitro závisí na relativních koncentracích (FSH / LH) pro optimální vývojovou kompetenci vývoje oocytů. Optimální koncentrace FSH / LH mohou zlepšit terapeutické klinické stimulační protokoly a míru úspěšnosti IVF.[48]
Reference
- ^ A b Pincus, Gregory; Enzmann, E. V. (1935-11-01). „Srovnávací chování savčích vajec in vivo a in vitro“. Journal of Experimental Medicine. 62 (5): 665–675. doi:10.1084 / jem.62.5.665. ISSN 0022-1007. PMC 2133299. PMID 19870440.
- ^ Edwards (1965). "Zrání in vitro u myší, ovcí, krav, prasat, opic rhesus a lidských ovárií ovárií". Příroda. 208 (5008): 349–351. Bibcode:1965Natur.208..349E. doi:10.1038 / 208349a0. PMID 4957259.
- ^ A b Edwards, R. G. (06.11.1965). "Zrání in vitro lidských ovariálních oöcytů". Lanceta. 2 (7419): 926–929. doi:10.1016 / s0140-6736 (65) 92903-x. ISSN 0140-6736. PMID 4165802.
- ^ Cha, K. Y .; Koo, J. J .; Ko, J. J .; Choi, D. H .; Han, S. Y .; Yoon, T. K. (01.01.1991). "Těhotenství po in vitro fertilizaci lidských folikulárních oocytů shromážděných z nestimulovaných cyklů, jejich kultivace in vitro a jejich přenos v programu dárcovských oocytů". Plodnost a sterilita. 55 (1): 109–113. doi:10.1016 / s0015-0282 (16) 54068-0. ISSN 0015-0282. PMID 1986950.
- ^ Trounson, Alan; Wood, Carl; Kausche, Annette (01.08.1994). „Zrání in vitro a oplodnění a vývojová kompetence oocytů získané z neléčených pacientů s polycystickými vaječníky *“. Plodnost a sterilita. 62 (2): 353–362. doi:10.1016 / S0015-0282 (16) 56891-5. PMID 8034085.
- ^ A b C Dunlop, Cheryl E .; Anderson, Richard A. (01.08.2014). "Regulace a hodnocení růstu folikulů". Scandinavian Journal of Clinical and Laboratory Investigation. 74 (sup244): 13–17. doi:10.3109/00365513.2014.936674. ISSN 0036-5513. PMID 25083887.
- ^ A b C Chian, Ri-Cheng; Lim, Jin-Ho; Tan, Seang-Lin (06.06.2004). "Nejmodernější zrání oocytů in vitro". Aktuální názor v porodnictví a gynekologii. 16 (3): 211–219. doi:10.1097/00001703-200406000-00003. ISSN 1040-872X. PMID 15129050.
- ^ A b C Hardy, Wright, Franks, Winston (2000). "In vitro zrání oocytů". Britský lékařský bulletin. 56 (3): 588–602. doi:10.1258/0007142001903391. PMID 11255547.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Chang, Eun Mi; Song, Hang Seok; Lee, Dong Ryul; Lee, Woo Sik; Yoon, Tae Ki (01.06.2014). „Zrání lidských oocytů in vitro: jeho role při léčbě neplodnosti a nové možnosti“. Klinická a experimentální reprodukční medicína. 41 (2): 41–46. doi:10.5653 / cerm.2014.41.2.41. ISSN 2233-8233. PMC 4102689. PMID 25045627.
- ^ A b C d „IVF Worldwide“. In vitro zrání. Citováno 2016-09-27.
- ^ Son, W. -Y .; Tan, S.L. (2010). „Laboratorní a embryologické aspekty cyklů dozrávání in vitro aktivovaných hCG u pacientek s polycystickými vaječníky“. Aktualizace lidské reprodukce. 16 (6): 675–689. doi:10.1093 / humupd / dmq014. PMID 20504873.
- ^ A b Wani, NA; Wani, G. M.; Khan, M.Z; Salahudin, S (2000). "Účinek technik sběru oocytů na zrání in vitro a oplodnění in vitro u ovcí". Výzkum malých přežvýkavců. 36 (1): 63–67. doi:10.1016 / s0921-4488 (99) 00097-8.
- ^ Niwa, K (1993). "Účinnost zrání in vitro a technik oplodnění in vitro u prasat". Journal of Reproduction and Fertility Supplement. 48: 49–59. PMID 8145214.
- ^ A b
- McLaughlin, M; Albertini, DF; Wallace, WH B; Anderson, RA; Telfer, E E (2018). „Oocyty metafáze II z lidských unilaminárních folikulů pěstovaných v multikrokovém kultivačním systému“. MHR: Základní věda reprodukční medicíny. 24 (3): 135–142. doi:10.1093 / molhr / gay002. ISSN 1360-9947. PMID 29390119.
- Další komentáře v BBC novinky článek: James Gallagher (09.02.2018). „První lidská vejce vypěstovaná v laboratoři“. BBC novinky.
- ^ Hyun, Chang-Seop; Cha, Jung-Ho; Syn, Weon-Young; Yoon, San-Hyun; Kim, Kyung-Ae; Lim, Jin-Ho (07.07.2007). "Optimální načasování ICSI po prvním vytlačování polárního těla v in vitro vyzrálé lidské oocyty ". Lidská reprodukce. 22 (7): 1991–1995. doi:10.1093 / humrep / dem124. PMID 17513319. Citováno 2012-07-14.
- ^ A b Hardy, K .; Wright, C. S .; Franks, S .; Winston, R. M. (01.01.2000). "In vitro zrání oocytů". Britský lékařský bulletin. 56 (3): 588–602. doi:10.1258/0007142001903391. ISSN 0007-1420. PMID 11255547.
- ^ Kannan S .; Mehta A .; Simha V .; Reddy O .; Kaur B .; Onteru S .; Singh D. (2014). „Fotoindukce kokultivace buněk granulózy a oocytů k ovlivnění in vitro zrání a oplodnění“. Hypotéza. 12 (1): e7. doi:10,5779 / hypotéza.v12i1,378.
- ^ A b Khalili, Mohammad Ali; Dehghan, Maryam; Nazari, Saeedeh; Agha-Rahimi, Azam (01.03.2014). „Hodnocení ovariálních tkání autotransplantovaných do různých tělních míst následovaných IVM u myší“. Iranian Journal of Reproductive Medicine. 12 (3): 199–204. ISSN 1680-6433. PMC 4009574. PMID 24799880.
- ^ A b C d E F G h i j Vitek, Wendy; Robins, Jared C (01.10.2013). "Zrání in vitro". Porodník a gynekolog. 15 (4): 215–219. doi:10.1111 / tog.12050. ISSN 1744-4667.
- ^ A b C Ouandaogo, Z.G .; Assou, S .; Haouzi, D .; Anahory, T .; Dechaud, H .; Hamamah, S. (2010). "Profil genové exprese v lidských kumulativních buňkách nezralého a zralého oocytu při zrání in vivo: klinické aplikace". Plodnost a sterilita. 94 (4): S88. doi:10.1016 / j.fertnstert.2010.07.338.
- ^ A b C d E F G Lee, Jae Eun; Kim, Sang Don; Jee, Byung Chul; Suh, Chang Suk; Kim, Seok Hyun (01.12.2011). "Zralost oocytů při opakované stimulaci vaječníků". Klinická a experimentální reprodukční medicína. 38 (4): 234–237. doi:10,5653 / cerm.2011.38.4.234. ISSN 2233-8233. PMC 3283078. PMID 22384448.
- ^ Dunaif, A. (01.12.1997). „Inzulínová rezistence a syndrom polycystických vaječníků: mechanismus a důsledky pro patogenezi“. Endokrinní hodnocení. 18 (6): 774–800. doi:10.1210 / edrv.18.6.0318. ISSN 0163-769X. PMID 9408743.
- ^ Martín-Coello, J .; González, R .; Crespo, C .; Gomendio, M .; Roldan, E. R. S. (2008-10-01). "Superovulace a zrání oocytů in vitro u tří druhů myší (Mus musculus, Mus spretus a Mus spicilegus)". Theriogenologie. 70 (6): 1004–1013. doi:10.1016 / j.theriogenology.2008.06.002. ISSN 0093-691X. PMID 18640710.
- ^ Johnston, L. A .; O'Brien, S. J .; Wildt, D. E. (1989-11-01). "In vitro zrání a oplodnění folikulárních oocytů kočky domácí". Gamete Research. 24 (3): 343–356. doi:10,1002 / mrd.1120240310. ISSN 0148-7280. PMID 2599509.
- ^ Goodrowe, K. L .; Hay, M .; King, W. A. (1991-09-01). "Nukleární zrání ovariálních oocytů koček in vitro". Biologie reprodukce. 45 (3): 466–470. doi:10.1095 / biolreprod45.3.466. ISSN 0006-3363. PMID 1782295.
- ^ Mahi, C. A .; Yanagimachi, R. (01.05.1976). "Zrání a pronikání spermií do ovariálních oocytů u psů in vitro". The Journal of Experimental Zoology. 196 (2): 189–196. doi:10.1002 / jez.1401960206. ISSN 0022-104X. PMID 1271036.
- ^ Nickson, D. A .; Boyd, J. S .; Eckersall, P. D .; Ferguson, J. M .; Harvey, M. J .; Renton, J. P. (01.01.1993). "Molekulárně biologické metody pro sledování zrání oocytů a oplodnění in vitro u fen". Journal of Reproduction and Fertility. Doplněk. 47: 231–240. ISSN 0449-3087. PMID 8229931.
- ^ Motlik, J .; Crozet, N .; Fulka, J. (01.11.1984). "Meiotická kompetence in vitro vepřových oocytů izolovaných z časných antrálních folikulů". Journal of Reproduction and Fertility. 72 (2): 323–328. doi:10.1530 / jrf.0.0720323. ISSN 0022-4251. PMID 6392543.
- ^ Szöllösi, D .; Desmedt, V .; Crozet, N .; Brender, C. (01.01.1988). „In vitro zrání ovariálních oocytů“. Reprodukce, výživa, vývoj. 28 (4B): 1047–1080. doi:10.1051 / rnd: 19880705. ISSN 0181-1916. PMID 3244901.
- ^ Squires, E. L. (01.04.1996). "Zrání a oplodnění koňských oocytů". Veterinární kliniky Severní Ameriky. Konská praxe. 12 (1): 31–45. doi:10.1016 / S0749-0739 (17) 30293-6. ISSN 0749-0739. PMID 8726448.
- ^ Hensleigh, H. C .; Hunter, A. G. (01.06.1985). "In vitro zrání bovinního kumulu uzavřených primárních oocytů a jejich následné oplodnění in vitro a štěpení". Journal of Dairy Science. 68 (6): 1456–1462. doi:10.3168 / jds.S0022-0302 (85) 80983-8. ISSN 0022-0302. PMID 3926843.
- ^ Barile, V. L .; Dell'Aquila, M. E .; Cinone, M .; Minoia, P. (01.09.1990). "In vitro zrání a oplodnění folikulárních oocytů u skotu". Bollettino della Società Italiana di Biologia Sperimentale. 66 (9): 899–906. ISSN 0037-8771. PMID 2073391.
- ^ Totey, S. M .; Singh, G .; Taneja, M .; Pawshe, C. H .; Talwar, G. P. (01.07.1992). "In vitro zrání, oplodnění a vývoj folikulárních oocytů z buvolů (Bubalus bubalis)". Journal of Reproduction and Fertility. 95 (2): 597–607. doi:10.1530 / jrf.0.0950597. ISSN 0022-4251. PMID 1518014.
- ^ Cervantes, Miriam P .; Palomino, J. Manuel; Anzar, Muhammad; Mapletoft, Reuben J .; Adams, Gregg P. (01.10.2016). „In vivo a in vitro zrání oocytů shromážděných ze superstimulovaného bizona dřeva (Bison bison athabascae) během anovulačních a ovulačních období“. Věda o reprodukci zvířat. 173: 87–96. doi:10.1016 / j.anireprosci.2016.09.001. ISSN 1873-2232. PMID 27601321.
- ^ Young, G .; Kagawa, H .; Nagahama, Y. (1982-12-10). „Zrání oocytů u lososa amago (Oncorhynchus rhodurus): účinky lososa gonadotropinu, steroidů a kyanoketonu (inhibitor 3 beta-hydroxy-delta 5-steroid dehydrogenázy) in vitro.“ The Journal of Experimental Zoology. 224 (2): 265–275. doi:10.1002 / jez.1402240217. ISSN 0022-104X. PMID 6961189.
- ^ A b C Rao, Brahmasani Sambasiva; Mahesh, Yelisetti Uma; Suman, Komjeti; Charan, Katari Venu; Nath, Rhisita; Rao, K. Ramachander (01.01.2015). „Meiotické zrání oocytů získané z vaječníků indických velkých koček po smrti“. In Vitro buněčná a vývojová biologie. Zvíře. 51 (1): 19–25. doi:10.1007 / s11626-014-9802-x. ISSN 1543-706X. PMID 25124872.
- ^ Nikmard, Fatemeh; Hosseini, Elham; Bakhtiyari, Mehrdad; Ashrafi, Mahnaz; Amidi, Fardin; Aflatoonian, Reza (2016-08-17). "Účinky melatoninu na zrání oocytů v myším modelu PCOS". Animal Science Journal. 88 (4): 586–592. doi:10.1111 / asj.12675. ISSN 1740-0929. PMID 27530294.
- ^ Whitworth, Kristin M .; Lee, Kiho; Benne, Joshua A .; Beaton, Benjamin P .; Spate, Lee D .; Murphy, Stephanie L .; Samuel, Melissa S .; Mao, Jiude; O'Gorman, Čad (01.09.2014). „Použití systému CRISPR / Cas9 k produkci prasat geneticky upravených z oocytů a embryí získaných in vitro“. Biologie reprodukce. 91 (3): 78. doi:10.1095 / biolreprod.114.121723. ISSN 1529-7268. PMC 4435063. PMID 25100712.
- ^ Lonergan, Patrick; Fair, Trudee (01.01.2016). "Zrání oocytů in vitro". Výroční přehled biologických věd o zvířatech. 4: 255–268. doi:10.1146 / annurev-animal-022114-110822. ISSN 2165-8110. PMID 26566159.
- ^ A b Andrabi, S. M. H .; Maxwell, W. M. C. (01.06.2007). „Přehled reprodukčních biotechnologií pro ochranu ohrožených druhů savců“. Věda o reprodukci zvířat. 99 (3–4): 223–243. doi:10.1016 / j.anireprosci.2006.07.002. ISSN 0378-4320. PMID 16919407.
- ^ Segers, Ingrid; Mateizel, Ileana; Van Moer, Ellen; Smitz, Johan; Tournaye, Herman; Verheyen, Greta; De Vos, Michel (01.08.2015). „In vitro zrání (IVM) oocytů získaných z vzorků ovariektomie v laboratoři: slibná„ ex vivo “metoda kryokonzervace oocytů, která vyústila v první zprávu o probíhajícím těhotenství v Evropě.“. Journal of Assisted Reproduction and Genetics. 32 (8): 1221–1231. doi:10.1007 / s10815-015-0528-9. ISSN 1058-0468. PMC 4554385. PMID 26253691.
- ^ Padilha, Lc; Teixeira, Ppm; Pires-Buttler, Ea; Apparício, M; Motheo, Tf; Savi, Pap; Nakaghi, Eyo; Alves, Ae; Vicente, Wrr (2014-04-01). "In vitro zrání oocytů z Santa Ines Ewes vystavených následným relacím folikulární aspirace laparoskopií". Reprodukce u domácích zvířat. 49 (2): 243–248. doi:10.1111 / rda.12261. ISSN 1439-0531. PMID 24313350.
- ^ A b C Fadini, Rubens; Renzini, Mario Mignini; Guarnieri, Teresa; Canto, Mariabeatrice Dal; Ponti, Elena De; Sutcliffe, Alastair; Shevlin, Mark; Comi, Ruggero; Coticchio, Giovanni (01.12.2012). „Srovnání porodnických a perinatálních výsledků dětí počatých z oocytů vyzrálých in vitro nebo in vivo při maturačních ošetřeních in vitro s porody z konvenčních cyklů ICSI“. Lidská reprodukce. 27 (12): 3601–3608. doi:10.1093 / humrep / des359. ISSN 0268-1161. PMID 23042796.
- ^ Sánchez, F .; Romero, S .; Vos, M. De; Verheyen, G .; Smitz, J. (01.06.2015). „Lidské zárodky váčkových oocytů uzavřených v kupě z časných antrálních folikulů odhalují heterogenní buněčné a molekulární rysy spojené s in vitro schopností zrání“. Lidská reprodukce. 30 (6): 1396–1409. doi:10.1093 / humrep / dev083. ISSN 0268-1161. PMID 25904637.
- ^ Sonigo, C .; Simon, C .; Boubaya, M .; Benoit, A .; Sifer, C .; Sermondade, N .; Grynberg, M. (01.07.2016). „Jaké prahové hodnoty počtu antrálních folikulů a sérových hladin AMH by měly být brány v úvahu pro kryokonzervaci oocytů po zrání in vitro?“. Lidská reprodukce (Oxford, Anglie). 31 (7): 1493–1500. doi:10.1093 / humrep / dew102. ISSN 1460-2350. PMID 27165625.
- ^ Grynberg, M .; Poulain, M .; le Parco, S .; Sifer, C .; Fanchin, R .; Frydman, N. (01.03.2016). „Podobné rychlosti zrání inocytů oocytů získaných během folikulární nebo luteální fáze nabízejí flexibilní možnosti pro urgentní zachování plodnosti u pacientek s rakovinou prsu“. Lidská reprodukce (Oxford, Anglie). 31 (3): 623–629. doi:10.1093 / humrep / dev325. ISSN 1460-2350. PMID 26759139.
- ^ Moawad, Adel R .; Xu, Baozeng; Tan, Seang Lin; Taketo, Teruko (10.10.2014). „Suplementace l-karnitinu během vitrifikace oocytů ve fázi zárodečných váčků myší a jejich následné zrání in vitro zlepšuje konfiguraci meiotického vřetene a mitochondriální distribuci v oocytech metafáze II“. Lidská reprodukce (Oxford, Anglie). 29 (10): 2256–2268. doi:10.1093 / humrep / deu201. ISSN 1460-2350. PMID 25113843.
- ^ Wang, Xuemei; Tsai, Tony; Qiao, Jie; Zhang, Zhan; Feng, Huai L. (01.06.2014). "Dopad gonadotropinů na zrání, hnojení a vývojové schopnosti oocytů in vitro". Reprodukce, plodnost a vývoj. 26 (5): 752–757. doi:10.1071 / RD13024. ISSN 1031-3613. PMID 23726536.
